5-羟色胺在觉醒肽(Orexin-A)促醒酒精性昏迷大鼠中的作用
2013-11-21解放军第309医院急救部北京100091王天昊樊双义马朋林
解放军第309医院急救部(北京100091) 王天昊 樊双义 闫 洁 陈 远 马朋林
由于对觉醒系统认识的不充分,昏迷的促醒研究也无重大进展。1998年觉醒肽(Orexins)的发现使人们对睡眠、觉醒的认识进入新的阶段,也为昏迷的治疗提供广阔的前景。研究发现[1-2]分泌Orexins的神经元仅位于下丘脑外侧区(LHA),但其神经纤维却可投射到网状上行激动系统的广泛区域,如5-羟色胺能的中背缝核(DR)、组胺能的乳头体核(TMN)、去甲肾上腺素能的蓝斑(LC)等,因此,Sakurai等[3]推测 Orexins可能作用于5-羟色胺能等神经系统,促进5-羟色胺、组胺、去甲肾上腺素的释放从而促进睡眠的觉醒并实验证实。Orexins可促进睡眠觉醒,但是否可促醒昏迷。酒精性昏迷是临床上常见的昏迷类型,贾晓军[4]的前期研究证实,脑室注射Orexin-A可对酒精性昏迷起到促醒作用。然而,其促醒机制是否与5-羟色胺素能等神经系统的激活相关尚无定论。本实验拟通过向酒精性昏迷大鼠模型脑室内注入特异性5-羟色胺(5-HT2)受体阻断剂,以翻正反射持续时间(LORR)和大鼠皮层脑电δ波为评价指标,探讨Orexin-A对酒精性昏迷促醒作用是否与5-羟色胺系统相关。
材料和方法
1 实验动物及分组 本研究选取健康成年雌性SD大鼠24只(由第三军医大学实验动物中心提供),平均体重200±30g。按随机数排序分组法,将大鼠分为对照组(人工脑脊液,ACSF)、觉醒肽组(Orexin-A)、阻断剂组(5-羟色胺受体阻断剂利坦色林,Ritanserin)及阻断剂+觉醒肽组(Ritanserin+Orexin-A)4组。
2 主要溶液的配置 人工脑脊液(ACSF)的配制:ACSF中各种离子成份及其浓度(mM):NaCl 126,KCl 2.5,CaCl22,MgCl22,NaH2PO41.25,NaHCO326,葡萄糖10。Orexin-A溶液的配制:用ACSF溶解配制成 Orexin-A溶液:4nmol/5μl、4nmol/10μl。配制剂量参考以往文献[5-6]。32%酒精溶液的配制:取无水乙醇以生理盐水稀释配制成32%的酒精溶液。Ritanserin溶液的配制:用新鲜ACSF配制,所配浓度分别为:Ritanserin40μg/5μl、40μg/10μl。
3 酒精昏迷模型建立及意识状态分级 参照Yacoubi、贾晓军等建立酒精性昏迷模型[4,7]。腹腔注射32%酒精溶液(14ml/kg),将大鼠的意识状态分为6级:Ⅰ级:在笼内活动如常;Ⅱ级:在笼内活动减少;Ⅲ级:在笼内活动减少并运动失调;Ⅳ级:当背部放在笼的底部时能滚动(翻正反射存在)但不能站立;Ⅴ级:翻正反射消失(Loss of righting reflex,LORR)但对疼痛刺激有肢体回缩反应;Ⅵ级:对任何刺激无反应。其中Ⅴ、Ⅵ级被认为是昏迷状态[8]。本实验中,我们以LORR作为昏迷的判别标准。
4 安放脑电皮层电极及侧脑室套管 腹腔注射4%戊巴比妥钠(30mg/kg)麻醉大鼠后,安装头部电极和侧脑室金属套管,额叶电极:前囟前2mm,中线左旁开2mm;双顶叶电极:中线左、右旁开4mm,前囟后6mm,深度(约0.7~1.0mm)触及硬脑膜。埋置侧脑室金属套管参照Paxinos-Watson图谱,中线旁1.5mm,前囟后1.5mm,深度3.0mm,自制套管直径0.8mm。电极安放后,大鼠饲养2周。进行皮层脑电图记录时,将脑皮层电极导线连接到RM6240生理信号采集处理系统。记录脑电图,以δ波所占脑电波比例多少作为昏迷深度的判别指标。随着昏迷深度增加,δ波所占脑电波的百分比增加。将给药前δ波所占的百分比标准化为1,根据δ波百分比变化判断给药是否加深或减轻昏迷。
5 给药方式 大鼠翻正反射消失后,各组均通过侧脑室埋置的金属套管微注射实验药物。对照组脑室注入 ACSF10μl;Orexin-A 组脑室注入 Orexin-A10μl(4nmol/10μl);阻断剂组脑室注入 Ritanserin 40μg/10μl;阻断剂+Orexin-A组脑室注入Ritanserin 40μg/5μl后注入 Orexin-A5μl(4nmol/5μl)。
6 统计学处理 采用SPSS 13.0统计软件进行统计分析,所有计量资料以±s表示,组间比较采用单因素方差分析,组间不同时间点比较采用重复测量方差分析,P<0.05为差异有统计学意义。
结 果
1 侧脑室不同给药对酒精性昏迷大鼠LORR持续时间的影响 同对照组相比,给Orexin-A后LORR持续时间明显缩短(2.90±0.30、1.85±0.35,P<0.01);而给5-羟色胺(5-HT2)受体阻断剂利坦色林后,LORR持续时间明显延长(2.90±0.30、4.47±0.49,P<0.01);在预先给予利坦色林处理然后再给Orexin-A,与对照组相比,LORR持续时间无明显缩短(2.90±0.30、3.11±0.48,P>0.05),与 Orexin-A组比较LORR持续时间则明显延长(P<0.01)。见图1。
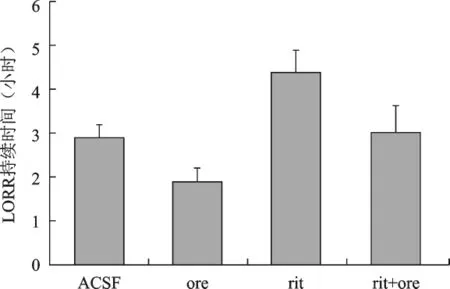
侧脑室不同给药对酒精昏迷大鼠LORR持续时间影响
2 侧脑室给药后不同时间对酒精性昏迷大鼠ECoG中δ波比例的影响 对照组(人工脑脊液)随着给药时间延长,δ波相对百分比逐渐下降;同对照组相比,给Orexin-A后大鼠δ波相对百分比下降速率显著加快(P<0.01);给予利坦色林组大鼠,5min后δ波相对百分比却明显升高(96.46±6.55、118.89±7.60,P<0.01);此外,先给利坦色林预处理然后再给Orexin-A,δ波相对百分比与对照组相比无明显差异(P>0.05),但与Orexin-A组比较差异显著(P<0.01)。见图2。

图2 侧脑室给药后不同时间对酒精昏迷大鼠ECoG中δ波比例的影响
讨 论
昏迷的促醒治疗具有重要的临床意义。昏迷是觉醒系统结构受损或功能受抑所致[9]。传统观点认为,觉醒系统即是指脑干上行网状激活系统。Orexins的发现是一个里程碑。目前观点认为,下丘脑外侧区的觉醒肽Orexins直接调节和影响着上行网状激活系统的功能,被称为机体的“觉醒启动区”[9-10]。是调节睡眠和觉醒的关键神经元。贾晓军研究发现其不仅可调节睡眠觉醒,还可对昏迷起促醒作用。本研究进一步探讨其促醒机制。
5-羟色胺是传统的兴奋性神经递质。5-羟色胺能神经元主要存在于低位脑干,其中中背缝核内(DR)是5-HT相对集中区。中背缝核同时也是重要的觉醒区域。Sakai等[11]运用在体单细胞神经元放电记录方法研究发现觉醒期间5-HT能神经元放电活跃,而在慢波睡眠(SWS)期开始减少;Portas等[12]运用微量渗透方法研究发现脑中5-HT及其代谢产物含量在清醒期明显升高。并发现5-HT与睡眠有着密切的关系,觉醒时5-HT系统激活,功能增高,睡眠时5-HT能系统功能降低,快眼动(REM)睡眠时最低。上述结果均提示5-HT与觉醒有关。Orexins神经元仅分布于下丘脑外侧区(LHA),但Orexins神经元纤维投射到上行激动系统的广泛区域,既往人们已认识到睡眠和觉醒之间的转换是由单胺能(组胺,5-羟色胺,去甲肾上腺素)等兴奋性神经递质和腺苷、P物质、GABA能抑制性神经递质等相互作用调节,但他们受何精确调节而实现睡眠和觉醒的转换无法认知。Orexins的发现使人们认识到它的觉醒调节启动作用,以及这些递质与Orexins的关系。
近期研究发现Orexins的觉醒机制与传统的兴奋性单胺能神经递质(5-羟色胺、组胺、5-HT)相关[3]。Wang等[13]通过免疫组化研究发现,背缝核的5-羟色胺能神经元活性受到Orexins系统的支配,Orexin-A通过Orexin-1受体对5-羟色胺能神经元起到调节作用。最近有实验发现[14],Orexin-A对麻醉大鼠具有促醒效应,这主要是通过5-羟色胺能神经元在快眼动睡眠及慢波睡眠期作用放电频率增加实现的。上述研究结果证明Orexins对觉醒的促醒作用机制与5-羟色胺能系统有关。然而,Orexins对酒精性昏迷——这一临床常见昏迷的促醒机制是否也与兴奋单胺能神经系统(如5-羟色胺)相关?本研究针对这一问题进行了实验论证。实验运用两种经典的监测手段——翻正反射消失(LORR)持续时间和皮层脑电图来评判实验大鼠的意识状态[14]。其中,皮层脑电图可连续监测皮层脑电活动状况,且振幅比头皮脑电图大10倍,灵敏度高。昏迷时皮层脑区电活动频率减慢、δ波所占比例明显增加。采用向侧脑室内给予5-羟色胺(5-HT2)受体阻断剂利坦色林阻断5-羟色胺能系统的激活,观察对Orexin-A逆转酒精性昏迷作用的影响。研究发现,与给予Orexin-A的促醒作用相反,给予5-羟色胺(5-HT2)受体阻断剂利坦色林组大鼠,与对照组(人工脑脊液)比较,5min后δ波相对百分比明显升高,并持续30min以上(图2),LORR持续时间亦显著延长(图1),提示阻断5-羟色胺递质的作用可显著加深昏迷的程度。进一步研究发现,先给予利坦色林预处理然后再给Orexin-A,与对照组相比,δ波比例并没有因Orexin-A而降低,LORR持续时间亦并没有因Orexin-A的兴奋性作用而缩短,Orexin-A的兴奋作用被利坦色林阻断。此结果提示5-羟色胺能系统的激活是Orexin-A对酒精性昏迷大鼠促醒的重要作用机制之一。
综上,Orexin-A对酒精性昏迷大鼠有良好的促醒作用。其促醒作用机制,与5-羟色胺能系统的激活相关,为临床昏迷的促醒研究及促醒药物研制等提供了新线索。
[1]Kotagal S.The emerging role of hypocretin(orexin-a)in the developing central nervous system[J].Sleep,2012,35(2):171-172.
[2]Marcus JN,Aschkenasi CJ,Lee CE.Differential expression of orexin receptors 1and 2in the rat brain[J].J Comp Neurol,2001,435(1):6-25.
[3]Ohno K,Sakurai T.Orexin neuronal circuitry:role in the regulation of sleep and wakefulness[J].Frontiers in Neuroendocrinology,2008,29(1):70-87.
[4]贾晓军,王艳芳,胡志安.Orexin-A对急性乙醇中毒昏迷大鼠的实验性促醒疗效研究[J].第三军医大学学报,2006,28(8):750-752.
[5]Kushikata T,Hirota K,Yoshida H,et al.Orexinergic neurons and barbiturate anesthesia[J].Neuroscience,2003,121(4):855-863.
[6]Shigemoto Y,Fujii Y,Shinomiya K.Participation of histaminergic H1and noradrenergic alpha 1receptors in orexin A-induced wakefulness in rats[J].Brain Res,2004,1023(1):121-125.
[7]Ledent C,Parmentier M.Caffeine reduces hypnotic effects of aDRohol through adenosine A2Areceptor blockade[J].Neuropharmacology,2003,45(7):977-985.
[8]Stephens JR,Levy RH.Effects of valproate and citrulline on ammonium-induced encephalopathy[J].Epilepsia,1994,35(1):164-171.
[9]Jones BE.Arousal systems[J].Front Biosci,2003,8(5):438-451.
[10]Aran A,Shors I,Lin L,et al.CSF Levels of Hypocretin-1(Orexin-A)Peak during Early Infancy in Humans[J].Sleep,2012,35(2):187-91.
[11]Sakai K,Crochet S.Serotonergic dorsal raphe neurons cease firing by disfacilitation during paradoxical sleep[J].Neuroreport,2000,11(14):3237-3241.
[12]Portas CM,Bjorvan B,Fagerland S,et al.On-line detection of extracellar levels of serotonin in dorsal raphe nucleus and frontal cortex over the sleep-wake cycle in the freely moving rat[J].Neurosci,1998,83(4):8072.
[13]Wang QP,Koyama Y,Guan JL,et al.The orexinergic synaptic innervation of serotonin and orexin 1receptor containing neurons in the dorsal raphe nucleus[J].Regul Pept,2005,126(1-2):35-42.
[14]Takahashi K,Wang QP,Guan JL,et al.State-dependent effects of orexins on the serotonergic dorsal raphe neurons in the rat[J].Regul Pept,2005,126(1-2):43-47.
