聚合后功能化法合成硫氰液晶高分子及其表征*
2013-11-19王彩虹刘卫东
王彩虹, 谭 帅, 刘卫东, 梁 婷, 伍 勇
(四川大学 化学工程学院,四川 成都 610065)
液晶高分子由于兼具液晶的各向异性与高分子的可加工性而受到了各个学科的关注。侧链含有液晶基元的高分子在信息储存[1~3]、非线性光学[4~6]、动态全息技术[7~9]和分子开关[10,11]等领域显示出了良好的应用前景。而在侧链液晶高分子的侧链末端引入特定官能团则有可能制备新的功能材料。如在侧链末端引入甲基咪唑盐[12]或乙氧烷片段[13]的液晶高分子表现出各向异性的离子传导能力。功能侧链液晶高分子通常采用含官能团单体的自由基聚合制备。而聚合后功能化方法可以将所需基团快速引入高分子从而获得新的功能材料[14~16]。然而,对液晶高分子前体进行后功能化制备功能液晶高分子的方法鲜见报导。

Scheme1
本研究设计合成了一个可用于聚合后功能化的液晶高分子构架。该构架由柔性的聚丙烯酸酯高分子骨架和含可修饰基团的液晶基元侧链组成。基元选择具有强烈近晶相诱导性的苯甲酸联苯酯,在基元与高分子骨架间引入柔性碳链的间隔臂以稳定液晶相下基元的空间有序排列。侧链末端的官能团与基元之间也由柔性链连接以减小官能团对液晶相的影响。溴的亲核取代在高分子聚合后功能化中表现出强大的能力,能将羧酸、氨基和硫醇等官能团引入高分子[17],故选择溴作为侧链液晶高分子的可修饰基团。
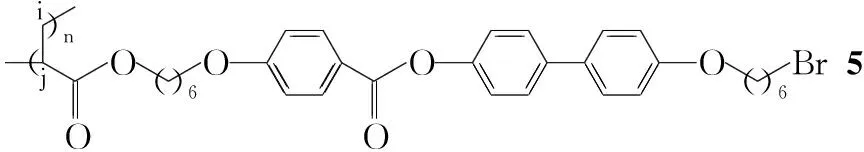
以合成硫氰小分子液晶的方法[18]为基础,通过自由基聚合制得侧链末端含溴的可修饰性液晶高分子(3); 以3为前体,采用聚合后功能化法制得含溴官能团的液晶高分子(5);用硫氰酸盐取代5中的溴成功地合成了硫氰液晶高分子(6Ⅰ, Pathway Ⅰin Scheme 1)。以3为前体,采用聚合前功能化法制得含液晶基元的硫氰单体(4);再通过自由基聚合制得硫氰液晶高分子(6Ⅱ, Pathway Ⅱ in Scheme 1),其结构经1H NMR和IR表征。
1 实验部分
1.1 仪器与试剂
美国Bruker AV Ⅱ-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);FT-IR NEXUS 670型红外光谱仪(KBr压片);Euro EA3000 CHNS/O型元素分析仪;Waters 2410型凝胶渗透色谱仪(GPC,聚苯乙烯为标样,淋洗液THF);巍途 XPL-30TF型偏光显微镜(POM); NETZSCH DSC 204 F13型差示扫描量热仪(DSC)和Netzsch TGA 209C型热重分析仪(TGA, N2氛围,升/降温速率10 ℃·min-1); Bruker AXS D8 Discovery型X-射线衍射(XRD)。
1和2参考文献[19,20]方法合成;1,6-二溴己烷,梯希爱上海化成公司;其余所用试剂均为分析纯。所有合成反应均在氮气保护下进行。
1.2 3的合成
在三口瓶中加入22.39 g(6.85 mmol)的二氯甲烷(30 mL)溶液,冰水浴冷却,搅拌下依次避光滴加Et3N 13.75 mmol,12 g(6.85 mmol),滴毕,于室温反应8 h。减压浓缩,残余物用甲醇洗涤两次后经硅胶柱层析(洗脱剂:二氯甲烷)分离得白色固体3 3.45 g,产率81%;1H NMRδ: 8.15(d,J=8.4 Hz, 2H, ArH), 7.59(d,J=8.2 Hz, 2H, ArH), 7.57(d,J=8.4 Hz, 2H, ArH), 7.23(d,J=8.2 Hz, 2H, ArH), 6.98(d,J=8.4 Hz, 2H, ArH), 6.91(d,J=8.4 Hz, 2H, ArH), 6.40(s, 1H, a-H), 6.13(m, 1H, a-H), 5.82(s, 1H, b-H), 4.21(t,J=6.4 Hz, 2H, e-H), 4.01(t,J=6.0 Hz, 4H, c-H), 3.44 (t,J=6.4 Hz, 2H, g-H), 1.75~1.24(m, 16H, d,f-H);13C NMRδ: 25.3, 25.6, 25.7, 27.9, 28.6, 29.0, 29.1, 32.7, 33.8, 64.5, 67.8, 68.0, 114.3, 114.8, 122.0, 127.4, 127.7, 128.1, 128.6, 130.6, 132.3, 132.9, 138.5, 150.0, 154.6, 158.6, 166.4; IRν: 2 932, 2 861, 1 725, 1 636, 1 606, 1 498, 1 470, 1 392, 1 288, 1 165, 1 070, 997, 802 cm-1; Anal.calcd for C34H39O6Br: C 65.49, H 6.30; found C 65.51, H 6.31。
1.3 聚合后功能化合成6Ⅰ
(1)5的合成[21,22]
在三口瓶中加入3 2 g(3.22 mmol)的1,4-二氧六环(10 mL)溶液,搅拌下滴加AIBN(偶氮二异丁腈)16 mg(0.097mmol)的1,4-二氧六环(3 mL)溶液,滴毕,于65 ℃(油浴)反应8 h。冷却至室温,倾入大量乙酸乙酯中,析出白色沉淀,过滤,滤饼依次用乙酸乙酯和甲醇洗涤,干燥得白色固体51.24 g,产率62%;1H NMRδ: 8.15(s, 2H, ArH), 7.55(s, 4H, ArH), 7.23(s, 2H, ArH), 6.94(s, 4H, ArH), 4.03(s, 6H, c,e-H), 3.44(s, 2H, g-H), 1.75~1.24(m, 19H, d,f,i,j-H); IRν: 2 931, 2 856, 1 732, 1 605, 1 498, 1 471, 1 393, 1 288, 1 165, 1 070, 997, 823, 803 cm-1; GPC: Mw 10 600, Mw/Mn 1.63。
(2)6Ⅰ的合成
在三口瓶中依次加入51 g, KSCN(硫氰酸钾)1.6 g(16.49 mmol)和DMF 15 mL,搅拌下于70 ℃(油浴)反应5 h。冷却至室温,加入过量蒸馏水,析出沉淀,过滤,滤饼用甲醇洗涤,干燥得白色固体6Ⅰ0.7 g,产率70%;1H NMRδ: 8.15(s, 2H, ArH), 7.59(d,J=8.2 Hz, 4H, ArH), 7.24(s, 2H, ArH), 6.97(s, 4H, ArH), 3.97(s, 6H, c,e-H), 2.99(s, 2H, h-H), 1.75~1.24(m, 19H, d,f,i,j-H); IRν: 2 937, 2 859, 2 154(SC≡N), 1 730, 1 604, 1 498, 1 471, 1 393, 1 259, 1 162, 1 073, 998, 823, 801 cm-1; GPC: Mw 13 000, Mw/Mn 1.5。
1.4 聚合前功能化合成6Ⅱ
(1)4的合成
在三口瓶中依次加入32 g(3.2 mmol), KSCN 3.12 g(32.2 mmol)和DMF 20 mL,搅拌下避光于40 ℃反应8 h。用蒸馏水充分洗涤,过滤,滤饼用甲醇重结晶;用乙酸乙酯溶解,过滤,滤液蒸干得白色固体41.8 g,产率93%;1H NMRδ: 8.16(d,J=8.8 Hz, 2H, ArH), 7.58(d,J=8.4 Hz, 2H, ArH), 7.52(d,J=8.4 Hz, 2H, ArH), 7.26(d,J=8.8 Hz, 2H, ArH), 6.99(d,J=8.8 Hz, 2H, ArH), 6.97(d,J=8.8 Hz, 2H, ArH), 6.43(s, 1H, a-H), 6.16(m, 1H, a-H), 5.84(s, 1H, b-H), 4.20(t,J=6.8 Hz, 2H, e-H), 4.03(t,J=6.4 Hz, 4H, c-H), 2.99(t,J=7.2 Hz, 2H, h-H), 1.75~1.24(m, 16H, d,f-H);13C NMRδ: 25.6, 25.8, 25.8, 27.7, 28.6, 28.8, 29.0, 29.6, 31.1, 65.3, 68.7, 68.9, 111.9, 112.1, 114.3, 114.9, 122.1, 121.8, 128.2, 129.5, 129.7, 130.9, 131.3, 132.4, 137.5, 148.6, 158.3, 164.5, 165.2, 166.4; IRν: 2 932, 2 861, 2 154(SC≡N), 1 725, 1 636, 1 606, 1 498, 1 470, 1 392, 1 288, 1 165, 1 070, 997, 802 cm-1; Anal.calcd for C34H39NO6SC: C 69.86, H 6.51, N 2.33, S 5.33; found C 70.28, H 7.35, N 3.37, S 5.89。
(2)6Ⅱ的合成
在三口瓶中加入42 g(3.33 mmol)的1,4-二氧六环(10 mL)溶液,搅拌下滴加AIBN 16 mg(0.097 mmol)的1,4-二氧六环(3 mL)溶液,滴毕,于65 ℃(油浴)反应8 h。冷却至室温,倾入大量乙酸乙酯中,析出白色沉淀,过滤,滤饼依次用乙酸乙酯和甲醇洗涤,干燥得白色固体6Ⅱ1.1 g,产率55%;1H NMRδ: 8.15(s, 2H, ArH), 7.55(d,J=8.2 Hz, 4H, ArH), 7.23(s, 2H, ArH), 6.94(s, 4H, ArH), 4.01(s, 6H, c,e-H), 2.99(s, 2H, h-H), 1.72~1.45(m, 19H, d,f,i,j-H); IRν: 2 931, 2 856, 2 154(SC≡N), 1 732, 1 605, 1 498, 1 471, 1 393, 1 288, 1 165, 1 070, 997, 803 cm-1; GPC: Mw 9 430, Mw/Mn 1.72。
2 结果与讨论
2.1 6的结构表征
1H NMR分析结果表明,在单体3和4中出现丙烯酸的双键质子(a,b-H)峰5.9~6.4。3和5在3.44处的峰对应与溴元素相连接的亚甲基质子(g-H),而在4和6中该峰完全消失;在3.0处出现新的峰,对应于与硫氰官能团相连接的亚甲基质子(h-H),且积分数恰好与g-H的峰面积相等。6Ⅰ未出现g-H吸收峰,表明5中的-Br在聚合后被-SCN完全取代。
IR分析结果表明,3和4在1 636 cm-1处均有C=C吸收峰,符合单体的结构特征。5和6在此处的吸收峰消失,表明自由基聚合成功。4和6在2 154 cm-1处出现明显的C≡N吸收振动峰,这说明硫氰官能团取代了溴原子。
1H NMR和IR的分析结果证明,用两种不同方法合成的6Ⅰ和6Ⅱ具有完全相同的化学结构。
2.2 5和6的热稳定性
5和6的TGA曲线见图1。由图1可见,它们的起始分解温度(失重5%)均在290 ℃以上。6Ⅰ和6Ⅱ的分解温度非常接近,但低于5的分解温度。5和6均具有良好的热稳定性。

Temperature/℃图 1 5和6的TGA曲线Figure 1 TGA curves of 5 and 6
2.3 5和6的液晶相表征
由POM升温观察5和6的织构变化,均出现近晶A相的典型的焦锥结构。以6Ⅰ为例,由室温开始加热,初始阶段视场内没有明显变化,在121 ℃附近开始出现焦锥结构,进一步加热过程中显微镜视场保持不变,直至173 ℃左右时液晶相消失,表现出各向同性。升温过程观察到5和6的POM织构如图2所示。
DSC分析证实5和6在POM观察到的相变点出现焓变(ΔH/J·g-1),其相变温度和ΔH见表1。由表1可知,5的玻璃转化温度高于6Ⅰ。硫氰官能团作为末端基,比溴代官能团占据更大的空间位阻。从自由体积概念出发,因为链端具有较大的活动性,可以认为它比处在分子链中央的同样原子数目的基团贡献更多的自由体积,从而使得聚合物链的柔性加强,降低了玻璃化温度。6Ⅰ比对应的5具有更窄的液晶相区间。尽管硫氰取代侧链比溴代侧链具有更强的分子偶极矩,但由于空间位阻的原因不利于近晶相稳定。

5

6Ⅰ

6Ⅱ

Comp相变温度/℃(ΔH/J·g-1)玻璃态近晶A相各向同性599(3.69)106(3.27)181(0.17)6Ⅰ70(2.62)121(3.52)173(0.15)6Ⅱ63(3.23)131(3.05)178(0.20)
6Ⅰ的相结构通过XRD确认,6Ⅱ的XRD谱图见图3。由图3可见,6Ⅱ是典型的近晶相高分子,在小角区1.18°出现一个尖峰,对应76 Å的层间距。而侧链展开长度约为37 Å,故该近晶相为一个双分子层结构(图3插图)。在广角区20.4°(4.4 Å)出现的峰对应于层间液晶基元的排列间距。

2θ/(°)
3 结论
用自由基聚合制备了侧链末端含溴的可修饰侧链液晶高分子,并以此为前体用硫氰酸盐进行聚合后功能化成功合成了硫氰侧链液晶高分子。该方法制备的硫氰液晶高分子与聚合前功能化方法制备的高分子具有相同的化学结构,且分子量更高。该硫氰液晶高分子在较宽的温度范围内表现出双分子层的近晶A相。含溴液晶高分子前体的聚合后功能化为制备功能液晶高分子提供了一条新途径。
[1] Meng X, Natansohn A, Barrett C,etal. Azo polymers for reversible optical storage.10.Cooperative motion of polar side groups in amorArous polymers[J].Macromolecules,1996,29:946-952.
[2] Hvilsted S, Andruzzi F, Kulinna C,etal. Novel side-chain liquid crystalline polyester architecture for reversible optical storage[J].Macromolecules,1995,28:2172-2183.
[3] Kajzar F, Noel C. Molecular design and properties of side chain liquid crystal polymers for applications in optoelectronics[J].Molecular Arys Rep,1999,25:247-262.
[4] Lee H K, Doi K, Kanazawa A,etal. Light-scattering-mode optical switching and image storage in polymer/liquid crystal composite films by means of arotochemical arase transition[J].Polymer,2000,41:1757-1763.
[5] Trollsas M, Sahlen F, Gedde U W,etal. Novel thermally stable polymer materials for second-order nonlinear optics[J].Macromolecules,1996,29:2590-2598.
[6] Craig H A, Imrie C T. Effect of spacer length on the thermal properties of side-chain liquid crystal polymethacrylates.2.Synthesis and characterization of the poly[.omega.-(4′-cyanobiArenyl-4-yloxy)alkyl methacrylate]s[J].Macromolecules,1995,28:3617-3624.
[7] Kozlovsky M V, Lazarev V V. The arotoinduced birefringence in thick films of chiral azodye copolymers[J].Macromol Chem Arys,2003,204:1226-1233.
[8] Sanchez C, Alcala R. High diffraction efficiency polarization gratings recorded by biArotonic holograAry in an azobenzene liquid crystalline polyester[J].Appl Arys Lett,2001,78:3944-3946.
[9] Zhao Y, Bai S Y, Asatryan K,etal. HolograAric recording in a arotoactive elastomer[J].Adv Func Mater,2003,13:781-788.
[10] Lee S W, Kim S, Lee B,etal. Arotoreactions and arotoinduced molecular orientations of films of a arotoreactive polyimide and their alignment of liquid crystals[J].Macromolecules,2003,26:6527-6536.
[11] Richard A D, Tommaso M, Carlo R,etal. A chiroptical molecular switch with distinct chiral and arotochromic entities and its application in optical switching of a cholesteric liquid crystal[J].Chem Eur J,2004,10:61-70.
[12] Yoshio M, Kagata T, Hoshino K,etal. One-dimensional ion-conductive polymer films:Alignment and fixation of ionic channels formed by self-organization of polymerizable columnar liquid crystals[J].J Am Chem Soc,2006,128:5570-5577.
[13] Kishimoto K, Suzawa T, Yokota T,etal. Nano-segregated polymeric film exhibiting high ionic conductivities[J].J Am Chem Soc,2005,127:15618-15623.
[14] Zhu Q, Li Q, Zeng Z,etal. New azobenzene-containing polyurethanes:Post-functional strategy and second-order nonlinear optical properties[J].Dyes and Pigments,2008,78:199-206.
[15] Rathfon J M, Tew G N. Synthesis of thermoresponsive poly(N-isopropylmethacrylamide) and poly(acrylic acid) block copolymers via post-functionalization of poly(N-methacryloxysuccinimide)[J].Polymer,2008,49:1761-1769.
[16] Bu H B, Günther Götz, Reinol E,etal. Efficient postúpolymerization functionalization of conducting poly(3,4úethylenedioxythioArene)(PEDOT) via ‘click’ reaction[J].Tetrahedron,2011,67:1114-1125.
[17] Zhai L, Pilston R L, Zaiger K L,etal. A simple method to generate side-chain derivatives of regioregular polythioArene via the GRIM metathesis and post-polymerization functionalization[J].Macromolecules,2003,36:61-64.
[18] 刘卫东,伍勇. 棒状硫氰液晶的合成与表征[J].液晶与显示,2011,26(3):281-284.
[19] Millaruelo M, Oriol L, Serrano J L,etal. Emissive anisotropic polymeric materials derived from liquid crystalline fluorenes[J].Mol Cryst Liq Cryst,2004,411:451-466.
[20] Kuo T, O’Brien D F. Cast polydiacetylene films from diacetylenic glutamate lipids[J].Langmuir,1991,7:584-589.

[22] SHI Yan, FU Zhi Feng, ZHANG Yu Dong,etal. Synthesis of comblike poly(methyl methacrylate) by atom transfer radical polymerization with poly(ethyl 2-bromoacrylate) as macroinitiator[J].Chinese Chemical Letters,2003,14:1289-1292.
