灯盏乙素苷元醚类衍生物的合成*
2013-11-19林明建杨丽梅李灵芝
林明建, 杨丽梅, 顾 军,3, 李灵芝,3
(1. 天津医科大学 药学院,天津 300070; 2. 武警后勤学院,天津 300162; 3. 天津市职业与环境危害防制重点实验室,天津 300193)
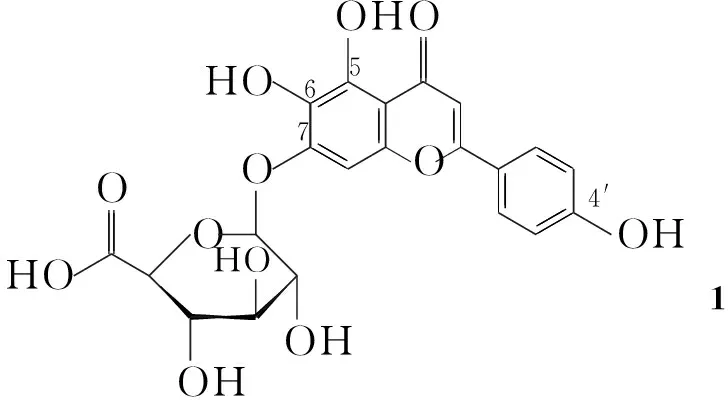
心脑血管疾病已成为严重危害人类健康的一种常见病和多发病,尤其是最常见的缺血性心脑血管病是全球死亡和伤残的首要原因之一[1]。灯盏乙素(1)又名野黄芩苷,是从我国特有的菊科植物短亭飞蓬干燥全草中提取的黄酮类有效成分。经现代药理实验表明,1具有扩张血管、增加动脉流量、改善微循环、减少血小板计数和抑制血小板凝集等作用。故临床上主要用于中风、冠心病、心绞痛等心脑血管疾病的治疗[2]。在药效学上的研究表明1在体内真正吸收和药效形式是灯盏乙素苷元(Ⅰ),且其在抗氧化性和清除自由基上的活性都比1更强[3]。但由于两者都存在水溶性、脂溶性差及口服生物利用度低等问题,使1制剂在临床上的进一步应用受到限制。酯类前药修饰在改善化合物理化性质方面有优势,且1在这方面的结构修饰也有相关性报道[4],但关于Ⅰ的结构修饰,特别是A环上酚羟基的改造至今未见文献报道,故对Ⅰ进行结构修饰和构效关系研究具有重要意义。
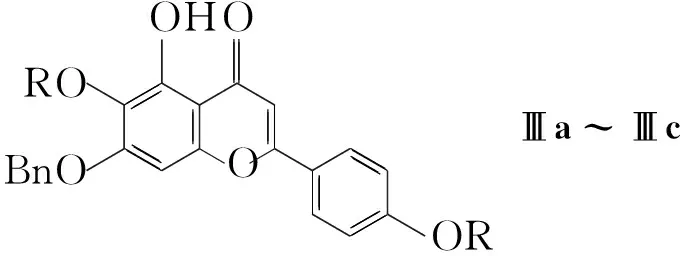
本文以1为原料,通过水解与醚化反应合成了三个灯盏乙素酯类中间体(3a~3c)和13个灯盏乙素苷元醚类衍生物(4a~4m, Scheme 1),其结构经1H NMR和MS表征,其中4d,4f~4m为新化合物。





CompdefghijklRMeBnEtBr()3-EtOO-MeBnEtBr()3-
Scheme1
本研究为进一步药理活性的测试积累化合物,同时探究了Ⅰ醚类衍生物的合成路线与方法。
1 实验部分
1.1 仪器与试剂
X-4型显微熔点仪(温度未经校正);Varian Inova 500型核磁共振仪(DMSO-d6为溶剂,TMS为内标);LCQ Advantage MAX型质谱仪。
1(>90%),南京泽朗医药科技有限公司;硅胶,青岛海洋化工公司;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1)3a~3c的合成(以3a为例)
在反应瓶中加入1 300 mg(0.65 mmol)和DMF6 mL,搅拌下加入溴乙烷(2a) 324 mg(3 mmol)和无水K2CO3414 mg(3 mmol),于室温反应至终点(TLC跟踪)。倾入碎冰中,用乙酸乙酯(3×30 mL)萃取,合并有机层,用饱和NaCl溶液洗涤,无水硫酸钠干燥,减压浓缩后经硅胶柱层析[洗脱剂:A=V(二氯甲烷) ∶V(甲醇)=20 ∶1]分离得3a305 mg。
用类似方法合成3b与3c。
3a[6,4′-二(O-乙基)灯盏乙素乙酯]: 深黄色固体,收率85.8%, m.p.102 ℃~103 ℃;1H NMRδ: 12.90(s, 1H, 5-OH), 8.02(d,J=9.0 Hz, 2H, 2′,6′-H), 7.11(d,J=9.0 Hz, 2H, 3′,5′-H), 7.08(s, 1H, 8-H), 6.93(s, 1H, 3-H), 4.11~4.16(m, 6H, CH2), 3.32~3.44(m, 3H, sugar-H), 1.35(t,J=7.0 Hz, 3H, CH3), 1.26(t,J=7.0 Hz, 3H, CH3), 1.18(t,J=7.0 Hz, 3H, CH3); ESI(+)-MSm/z: 547.0{[M+H]+}。
3b[6,4′-二(O-苄基)灯盏乙素苄酯]: 淡黄色固体,收率83.3%, m.p.95 ℃~96 ℃;1H NMRδ: 12.97(s, 1H, 5-OH), 8.04(d,J=9.0 Hz, 2H, 2′,6′-H), 7.21~7.55(m, 15H, PhH), 7.12(s, 1H, 8-H), 7.17(d,J=9.0 Hz, 2H, 3′,5′-H), 6.93(s, 1H, 3-H), 5.70(d,J=5.5 Hz, 2H, CH2), 5.60(d,J=6.0 Hz, 2H, CH2), 5.40(d,J=5.5 Hz, 2H, CH2), 4.31(d,J=9.5 Hz, 2H, CH2), 3.41~3.56(m, 3H, sugar-H); ESI(+)-MSm/z: 733.1{[M+H]+}。
3c(4′-O-苄基灯盏乙素苄酯): 黄色固体,收率64.6%, m.p.114 ℃~116 ℃;1H NMRδ: 13.02(s, 1H, 5-OH), 10.41(s, 1H, 6-OH), 7.92(d,J=8.5 Hz, 2H, 2′,6′-H), 7.21~7.55(m, 15H, PhH), 7.09(s, 1H, 8-H), 6.93(d,J=8.5 Hz, 2H, 3′,5′-H), 6.86(s, 1H, 3-H); ESI(+)-MSm/z: 643.0{[M+H]+}。
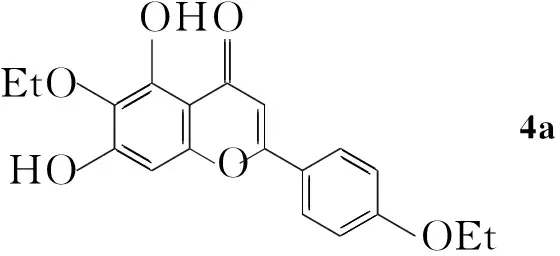
(2)4a~4c的合成(以4a为例)
在圆底烧瓶中依次加入3a100 mg(0.18 mmol)和新配制的7%盐酸-乙醇溶液15 mL,搅拌下回流(85 ℃)反应至终点(TLC跟踪)。趁热过滤,滤液减压浓缩得黄色固体,用蒸馏水洗至中性,用PTLC分离(展开剂:A=20 ∶1)得6,4′-二乙氧基-5,7-二羟基黄酮(4a) 43 mg。
用类似方法合成6,4′-二苄氧基-5,7-二羟基黄酮(4b)和4′-O-苄基-5,6,7-三羟基黄酮(4c)。
4a: 黄色固体,收率69.7%, m.p.84 ℃~86 ℃;1H NMRδ: 13.02(s, 1H, 5-OH), 10.60(s, 1H, 7-OH), 8.00(d,J=9.0 Hz, 2H, 2′,6′-H), 7.07(d,J=9.0 Hz, 2H, 3′,5′-H), 6.84(s, 1H, 8-H), 6.60(s, 1H, 3-H), 4.12(q,J=7.0 Hz, 2H, CH2), 4.00(q,J=7.0 Hz, 2H, CH2), 1.35(t,J=7.0 Hz, 3H, CH3in Et), 1.26(t,J=7.0 Hz, 3H, CH3in Et); ESI(+)-MSm/z: 341.6{[M+H]+}。
4b: 黄色固体,收率64.9%, m.p.93 ℃~94 ℃;1H NMRδ: 13.11(s, 1H, 5-OH), 10.84(s, 1H, 6-OH), 8.01(d,J=9.0 Hz, 2H, 2′,6′-H), 7.29~7.52(m, 10H, PhH), 7.17(d,J=9.0 Hz, 2H, 3′,5′-H), 6.80(s, 1H, 8-H), 6.66(s, 1H, 3-H), 5.21(s, 2H, PhCH2), 5.01(s, 2H, PhCH2); ESI(+)-MSm/z: 465.3{[M+H]+}。
4c: 深黄色固体,收率42.7%, m.p.95 ℃~96 ℃;1H NMRδ: 13.16(s, 1H, 5-OH), 10.80(s, 1H, 6-OH), 10.35(s, 1H, 7-OH), 7.92(d,J=9.0 Hz, 2H, 2′,6′-H), 7.28~7.38(m, 5H, PhH), 6.91(d,J=9.0 Hz, 2H, 3′,5′-H), 6.78(s, 1H, 8-H), 6.58(s, 1H, 3-H), 5.01(s, 2H, PhCH2); ESI(+)-MSm/z: 375.1{[M+H]+}。
(3) Ⅰ的合成
在圆底烧瓶中依次加入18.0 g(173 mmol)和新配制的7%盐酸-乙醇溶液800 mL,搅拌下回流反应4 h。趁热过滤,滤液减压蒸除溶剂(析出大量黄色固体),过滤,滤饼用大量蒸馏水洗至中性,干燥后,直接用乙酸乙酯(3×100 mL)进行固液萃取,合并有机层,浓缩至干,残余物用90%乙醇重结晶得黄色固体Ⅰ 4.5 g,收率90%, m.p.172 ℃(分解);1H NMRδ: 12.79(s, 1H, 5-OH), 10.47(s, 1H, 7-OH), 10.31(s, 1H, 6-OH), 8.74(s, 1H, 4′-OH), 7.90(d,J=8.0 Hz, 2H, 2′,6′-H), 6.90(d,J=8.0 Hz, 2H, 3′,5′-H), 6.74(s, 1H, 8-H), 6.58(s, 1H, 3-H); ESI(+)-MSm/z: 285.2{[M+H]+}。
(4)4d~4m的合成(以4d为例)
在圆底烧瓶中依次加入Ⅰ 100 mg(0.35 mmol), K2CO3212 mg(1.54 mmol)和DMF 4 mL,搅拌下于室温反应10 min; 加入碘甲烷(2d) 248 mg(1.75 mmol),反应至终点(TLC跟踪)。倾入碎冰中,用乙酸乙酯(2×30 mL)萃取,合并有机层,用无水硫酸钠干燥,减压浓缩后经硅胶层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=3 ∶1]分离得4d104 mg。
用类似方法合成4e~4m。
4d(6,7,4′-三甲氧基-5-羟基黄酮): 黄色固体,收率78.5%, m.p.88 ℃~90 ℃;1H NMR(CDCl3)δ: 12.78(s, 1H, 5-OH), 7.84(d,J=8.5 Hz, 2H, 2′,6′-H), 7.02(d,J=9.0 Hz, 2H, 3′,5′-H), 6.58(s, 1H, 8-H), 6.54(s, 1H, 3-H), 3.97(s, 3H, OCH3), 3.93(s, 3H, OCH3), 3.90(s, 3H, OCH3); ESI(+)-MSm/z: 679.0{[2M+Na]+}, 329.3{[M+H]+}。
4e(6,7,4′-三苄氧基-5-羟基黄酮): 淡黄色固体,收率85.4%, m.p.95 ℃;1H NMR(CDCl3)δ: 12.85(s, 1H, 5-OH), 7.82(d,J=8.0 Hz, 2H, 2′,6′-H), 7.08(d,J=8.5 Hz, 2H, 3′,5′-H), 6.57(s, 1H, 8-H), 6.55(s, 1H, 3-H), 7.26~7.50(m, 15H, PhH), 5.17(s, 4H, Ph CH2), 5.15(s, 2H, PhCH2); ESI(+)-MSm/z: 557.5{[M+H]+}。
4f(6,7,4′-三乙氧基-5-羟基黄酮): 黄色固体,收率73.4%, m.p.45 ℃~46 ℃;1H NMR(CDCl3)δ: 12.74(s, 1H, 5-OH), 7.81(d,J=8.5 Hz, 2H, 2′,6′-H), 6.99(d,J=9.0 Hz, 2H, 3′,5′-H), 6.56(s, 1H, 8-H), 6.51(s, 1H, 3-H), 4.09~4.19(m, 6H, CH2), 1.52(t,J=7.5 Hz, 3H, CH3), 1.46 (t,J=7.5 Hz, 3H, CH3), 1.40(t,J=7.5 Hz, 3H, CH3); ESI(+)-MSm/z: 371.45{[M+H]+}, 343.49{[M+H-Et]+}。
4g(6,7,4′-三溴丁氧基-5-羟基黄酮): 淡黄色固体,收率70.9%, m.p.44 ℃~46 ℃;1H NMR(CDCl3)δ: 12.76(s, 1H, 5-OH), 7.85(dd,J=7.2 Hz, 2.0 Hz, 2H, 2′,6′-H), 7.02(dd,J=7.2 Hz, 2.0 Hz, 2H, 3′,5′-H), 6.60(s, 1H, 8-H), 6.54(s, 1H, 3-H), 4.07~4.17(m, 6H, CH2), 3.51~3.60(m, 6H, CH2), 2.03~2.22(m, 12H, CH2); ESI(+)-MSm/z: 693.0{[M+H]+}。
4h(6,7,4′-三乙氧羰甲氧基-5-羟基黄酮): 淡黄色固体,收率76.2%, m.p.88 ℃~90 ℃;1H NMR(CDCl3)δ: 12.91(s, 1H, 5-OH), 7.85(dd,J=7.2 Hz, 2.0 Hz, 2H, 2′,6′-H), 7.04(dd,J=6.8 Hz, 2.0 Hz, 2H, 3′,5′-H), 6.60(s, 1H, 8-H), 6.47(s, 1H, 3-H), 4.72~4.83(m, 6H, CH2in Et), 4.26~4.35(m, 6H, OCH2), 1.30~1.36(m, 9H, CH3in Et); ESI(+)-MSm/z: 1 110.9{[2M+Na]+}, 545.2{[M+H]+}。
4i(7,4′-二甲氧基-5,6-二羟基黄酮): 黄色固体,收率70.0%, m.p.124 ℃~125 ℃;1H NMRδ: 12.92(s, 1H, 5-OH), 10.38(s, 1H, 6-OH), 7.96(d,J=8.5 Hz, 2H, 2′,6′-H), 6.93(s, 1H, 8-H), 6.92(d,J=9.0 Hz, 2H, 3′,5′-H), 6.85(s, 1H, 3-H), 3.92(s, 3H, OCH3), 3.72(s, 3H, OCH3); ESI(+)-MSm/z: 651.0{[2M+Na]+}, 315.3{[M+H]+}。
4j(7,4′-二苄氧基-5,6-二羟基黄酮): 淡黄色固体,收率74.5%, m.p.115 ℃~116 ℃;1H NMRδ: 13.03(s, 1H, 5-OH), 10.39(s, 1H, 6-OH), 7.95(d,J=9.0 Hz, 2H, 2′,6′-H), 7.28~7.49(m, 10H, PhH), 7.04(s, 1H, 8-H), 6.93(d,J=9.0 Hz, 2H, 3′,5′-H), 6.85(s, 1H, 3-H), 4.99(s, 2H, PhCH2), 5.25(s, 2H, PhCH2); ESI(+)-MSm/z: 955.0{[2M+Na]+}, 489.2{[M+Na]+}, 467.2{[M+H]+}。
4k(7,4′-二乙氧基-5,6-二羟基黄酮): 黄色固体,收率78.9%, m.p.82 ℃~84 ℃;1H NMRδ: 12.88(s, 1H, 5-OH), 10.37(s, 1H, 6-OH), 7.95(d,J=8.5 Hz, 2H, 2′,6′-H), 6.92(d,J=9.0 Hz, 2H, 3′,5′-H), 6.89(s, 1H, 8-H), 6.83(s, 1H, 3-H), 4.17(q,J=7.0 Hz, 2H, CH2), 3.97(q,J=7.0 Hz, 2H, CH2), 1.38(t,J=7.0 Hz, 3H, CH3in Et), 1.24(t,J=7.0 Hz, 3H, CH3in Et); ESI(+)-MSm/z: 343.2{[M+H]+}。
4l(7,4′-二溴丁氧基-5,6-二羟基黄酮): 淡黄色固体,收率70.6%, m.p.82 ℃~84 ℃;1H NMRδ: 12.93(s, 1H, 5-OH), 10.39(s, 1H, 6-OH), 7.97(d,J=8.8 Hz, 2H, 2′,6′-H), 6.94(dd,J=6.8 Hz, 2.0 Hz, 2H, 3′,5′-H), 6.92(s, 1H, 8-H), 6.85(s, 1H, 3-H), 4.17(t,J=6.0 Hz, 2H, CH2), 3.96(t,J=6.0 Hz, 2H, CH2), 3.61~3.67(m, 4H, CH2), 1.76~2.07(m, 8H, CH2); ESI(+)-MSm/z: 555.0{[M+H]+}。
4m(7-苄氧基-5,6,4′-三羟基黄酮): 深黄色固体,收率70.1%, m.p.132 ℃~134 ℃;1H NMR(CDCl3)δ: 12.69(s, 1H, 5-OH), 10.35(s, 1H, 6-OH), 8.74(s, 1H, 4′-OH), 7.93(d,J=8.5 Hz, 2H, 2′,6′-H), 7.32~7.53(m, 5H, PhH), 6.99(s, 1H, 8-H), 6.92(d,J=9.0 Hz, 2H, 3′,5′-H), 6.80(s, 1H, 3-H), 5.29(s, 3H, OCH3); ESI(+)-MSm/z: 375.1{[M-H]-}。

Scheme2
2 结果与讨论
2.1 4a~4c的合成
合成7-OH暴露的4a~4c时,可以采用两种路线(Scheme 2)。本文采用路线二,其原因在于路线一反应步骤过多,后处理繁琐,收率极低,最终收率小于10%。而路线二略去了苄基保护和脱保护的过程,极大地简化了反应步骤,且中间产物可以不经纯化直接用于下一步反应。同时实验证明路线二中用于水解糖苷键的反应条件对醚键无影响。
2.2 4d~4m的合成
质子性和非质子性溶剂,均可用于醚类的合成,其中后处理简单的丙酮、二氯甲烷等低沸点的质子性溶剂是醚化的首选溶剂。但实际过程中这些质子性溶剂对Ⅰ的溶解性都很差,不利于反应的进行;同时会对Ⅰ中各酚羟基的活性产生均化效应,降低反应位点的选择性。故本文选用了对Ⅰ溶解性较好的强极性非质子性溶剂DMF作反应介质,在使Ⅰ充分溶解的同时提高了反应位点的选择性。
Ⅰ有4个酚羟基,其中5-OH活性极弱,一般条件下不参与反应,6,7,4′-OH均可发生反应。通过分析Ⅰ与2b的反应产物,得知Ⅰ中4个酚羟基的反应活性次序为:7-OH>4′-OH>6-OH>5-OH。故可以通过控制2的用量来控制醚化主产物。当r=n(2) ∶n(1)=1 ∶1时,主产物以7-位取代的单醚类为主(4m);但r=2 ∶1时,主产物是以7,4′-双取代醚为主(4i~4l);要想得到三取代醚类化合物,r应不少于3 ∶1(4d~4h)。
[1] Donnan G A, Fisher M, Macleod M,etal. Stoke[J].Lancet,2008,371:1612-1623.
[2] 杨丽梅,顾军,林明建,等. 灯盏花素的研究进展[J].天津药学,2010,22(1):56-60.
[3] Qian L H, Li N G. Synthesis and bio-activity evaluation of scutellarein as a potent agent for the therapy of ischemic cerebrovascular disease[J].Int J Mol Sci,2011,12:8208-8216.
[4] 王振江,李念光,冯锋,等. 灯盏乙素衍生物的合成及其体外抗凝血活性研究[J].中国药物化学杂志,2011,21(2):147-150.
