(S,S)-2,8-二氮杂双环[4,3,0]壬烷的合成工艺改进
2013-11-19陈志卫陈君培
陈志卫, 陈君培
(浙江工业大学 药学院 绿色制药技术与装备教育部重点实验室,浙江 杭州 310014)
莫西沙星是德国Bayer公司研制的第四代氟喹诺酮类药物,具有广谱抗菌作用,临床上主要用于慢性支气管炎急性发作、社区获得性肺炎、耐多药肺结核病等疾病。(S,S)-2,8-二氮杂双环[4,3,0]壬烷(1)是合成莫西沙星的关键中间体[1],其合成路线主要有两条。路线一:以2,3-吡啶二羧酸(2)为起始原料,经醋酐脱水,与苄胺环合后用钌碳催化加氢还原吡啶环,氢化铝锂还原酰亚胺,经D-(-)酒石酸拆分,在甲醇中氢解脱苄得1[1],总收率23%,对映选择性>99%。该路线主要缺点是还原剂氢化铝锂价格昂贵,生产成本较高。路线二:以2为起始原料,经甲醇酯化、还原酯基后氯代,与对甲苯磺酰胺环合,用钌碳催化加氢还原吡啶环,经R-(-)-扁桃酸拆分后用氢溴酸在苯酚和乙酸中脱去对甲苯磺酰基得1[2],总收率15%,对映选择性>99%。该路线的主要缺点是反应步骤长,且使用工业上禁用的苯酚等试剂,反应条件苛刻,生产成本高。
本文在文献[1,3]方法的基础上,对1的合成工艺进行多处改进。即以2为起始原料,经双
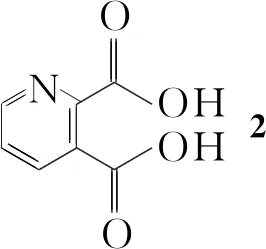
6 7 1
Scheme1
(三氯甲基)碳酸酯(BTC)脱水得2,3-吡啶二酸酐(3);3在甲苯中与苄胺环合得6-苄基-吡咯并[3,4-b]吡啶-5,7-二酮(4);在惰性溶剂甲苯中用5%钯碳催化加氢还原4中吡啶环生成6-苄基-吡咯并[3,4-b]吡啶-5,7-二酮(5);用硼烷还原5中酰亚胺的羰基得6-苄基-六氢-吡咯并[3,4-b]吡啶-5,7-二酮(6); 6用D-(-)酒石酸在正丁醇和水混合溶剂中拆分得(S,S) -6-苄基-八氢-吡咯并[3,4-b]吡啶(7); 7经氢解脱苄合成了1(Scheme 1),总收率33.0%,对映选择性99.5%,其结构经1H NMR,13C NMR和MS确证。
改进工艺将总收率从23%[1]提高至33%,且反应条件温和,操作简便,更有利于工业化生产。
1 实验部分
1.1 仪器与试剂
WRS-1A型数字熔点仪(温度未校正);Varian-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Trace DSQ FINNIGSN型质谱仪。
所用试剂均为分析纯。
1.2 合成
(1)3的合成
在反应瓶中加入275.2 g(0.45 mol),甲苯200 mL及DMF 2.0 g(0.03 mol),搅拌下于80 ℃滴加BTC 44.5 g(0.15 mol)的甲苯(100 mL)溶液,滴毕,于80 ℃反应5 h。蒸除溶剂,干燥得淡棕色固体365.8 g,收率98%, m.p.138 ℃~139 ℃(137 ℃~139 ℃[1]);1H NMR (DMSO-d6)δ: 7.84(dd,J=4.8 Hz, 7.6 Hz, 1H), 8.39(dd,J=1.2 Hz, 7.6 Hz, 1H), 9.18(dd,J=1.2 Hz, 4.8 Hz, 1H);13C NMR(DMSO-d6)δ: 127.3, 127.8, 139.1, 148.4, 151.5, 162.0, 163.5; ESI-MSm/z: 150{[M+H]+}。
(2)4的合成
在反应瓶中加入359.6 g(0.40 mol)和甲苯80 mL,搅拌下于室温滴加苄胺42.9 g(0.40 mol), 滴毕,于30 ℃反应3 h。蒸除溶剂,残余物加醋酐60 mL,于110 ℃反应2 h。蒸除溶剂后加乙醇60 mL,搅拌10 min,抽滤,滤饼用少量乙醇洗涤,干燥得白色粉末493.8 g,收率98%, m.p.167 ℃~168 ℃(167 ℃~168 ℃[1]);1H NMRδ: 4.90(s, 2H), 7.26~7.33(m, 3H), 7.44(d,J=7.6 Hz, 2H), 7.59(q,J=7.2 Hz, 7.6 Hz, 1H), 8.14(dd,J=1.6 Hz, 7.6 Hz, 1H), 8.94(dd,J=1.6 Hz, 7.6 Hz, 1H);13C NMRδ: 41.9, 127.2, 127.8, 128.5(C2), 128.6(C2), 131.0, 135.6, 151.5, 155.0, 165.3, 165.6; ESI-MSm/z: 261{[M+Na]+}。
(3)5的合成
将447.6 g(0.20 mol)溶于甲苯(300 mL)中,搅拌下加入5%Pd/C 2.4 g,高压釜加压通氢,于79 ℃~82 ℃/1 MPa下反应10 h。冷却至室温,过滤,滤液蒸除溶剂,残余物冷却至室温,析出淡黄色固体,干燥得淡黄色固体545.9 g,收率94.0%, m.p.69 ℃~70 ℃(69 ℃~71 ℃[1]);1H NMRδ: 1.46~1.52(m, 2H), 1.61~1.69(m, 1H), 1.90~1.98(m, 1H), 2.15(s, 1H), 2.62~2.68(m, 1H), 2.74~2.79(m, 1H), 2.80~2.86(m, 1H), 3.81(d,J=8.0 Hz, 1H), 4.63(s, 2H), 7.23~7.33(m, 5H);13C NMRδ: 22.0, 22.8, 39.0, 41.9, 42.1, 55.1, 127.4, 128.0(2C), 128.2(2C), 135.4, 177.2, 177.3; ESI-MSm/z: 245{[M+H]+}。
(4)6的合成
在反应瓶中加入524.4 g(0.10 mol)和THF 293 mL,搅拌下于5 ℃~10 ℃(内温)滴加1 mol·L-1硼烷THF络合物269.4 g(0.30 mmol),滴毕,于80 ℃反应5 h。冷却至0 ℃,搅拌下加水至无气泡生成为止。反应液浓缩至干,加入6 mol·L-1盐酸36.6 mL,回流反应30 min。冷却至室温,用45%氢氧化钠溶液调至pH 11,用乙酸乙酯(45 mL)萃取,无水硫酸钠干燥,蒸除溶剂得淡黄色液体620.6 g,收率95.2%;1H NMRδ: 1.34~1.42(m, 1H), 1.43~1.54(m, 1H), 1.60~1.71(m, 2H), 1.78(bs, 1H), 2.13~2.20(m, 1H), 2.51~2.61(m, 3H), 2.73(t,J= 8.8 Hz, 1H), 2.82(dd,J=5.2 Hz, 9.6 Hz, 1H), 2.95(dt,J=12.4 Hz, 4.0 Hz, 1H), 3.19(dt,J=5.2 Hz, 2.0 Hz, 1H), 3.70(q,J=13.2 Hz, 2H), 7.18~7.32(m, 5H);13C NMRδ: 22.9, 24.8, 37.1, 45.0, 55.9, 57.1, 61.2, 61.4, 77.3, 77.6, 77.9, 127.0, 128.5(C2), 128.9(C2), 140.0; ESI-MSm/z: 217{[M+H]+}。
(5)7的合成
在反应瓶中加入619.5 g(90 mmol),混合溶剂[V(正丁醇) ∶V(水)=4 ∶1]80 mL及D-(-)酒石酸21.6 g(140 mmol),搅拌下于80 ℃反应2 h。冷却至0 ℃,继续反应1 h。过滤,滤饼用乙二醇单甲醚重结晶得白色固体酒石酸盐15.8 g,收率44.6%, m.p.141 ℃~146 ℃(148 ℃~154 ℃[1])。
(6)1的合成
2 结果与讨论
在.3的合成中,2在甲苯中的脱水以DMF为催化剂,BTC为脱水剂,反应条件温和,收率98%;在5的合成中,以5%Pd/C为催化剂,以甲苯替代THF[4,5],反应压力从8.0 MPa[3,4]降至1.0 MPa,选择性提高,收率提高至94%;在6的合成中,以硼烷替代氢化铝锂[1,3,4]、红铝[6]、硼氢化钠[7],收率提高至95.2%,且无固体废渣降低生产成本;在7的合成中,以混合溶剂[V(正丁醇) ∶V(水)=4 ∶1]替代DMF[1],成盐后将酒石酸盐溶于饱和食盐水后经氢氧化钠解离,以乙酸乙酯替代萃取溶剂叔丁基甲基醚[1]或环己烷[4],收率由78.4%[1]提高至92%。
[1] Uwe P, Andreas K, Thomas S,etal. Chinolon und naphthridon carbonsaur der ivateals antibakterielles mittel[P].EP 550 903,1992.
[2] Kim J W, Park T H, Kim M,etal. Quinolone derivatives and processes for preparing the same[P].US 5 770 597,1998.
[3] Motterle R, Arvotti G, Bergantino E,etal. Synthesis of (4aS,7aS)-octahydro-1H-pyrrolo[3,4-b]pyridine[P].WO 2 010 100 215,2012.
[4] 刘明亮,孙兰英,郭慧元,等. 莫西沙星的合成[J].中国医药工业杂志,2004,35(3):129-131.
[5] Takemura M, Kimura Y, Matlshashi N. Bicyclic amine derivatives of quinolones as single stereoisomers,useful as antimicrobials[P].EP 603 887,1994.
[6] Ramakrishnan A, Bhawsar S, Narayana V. Improved process for the preparation of (S,S)-2,8-diazabicyclo-[4.3.0]nonane[P].WO 2 009 125 425,2009.
[7] 屠雄飞. 8-苄基-2,8-二氮杂双环[4.3.0]壬烷及其手性异构体的还原方法[P].CN 101 591 336,2009.
