土壤加砷对魔芋砷的含量、吸收与分布的影响
2013-11-19裴艳艳杨兰芳麻成杰万梦雪
裴艳艳,杨兰芳,麻成杰,万梦雪
(1.湖北大学资源环境学院,湖北 武汉 430062;2.中国科学院测量与地球物理研究所,湖北 武汉 430077)
0 引言
砷是广泛存在于环境中对人类健康有巨大危害的微量元素,全世界数百万人因长期砷暴露而面临癌症、心脏病和糖尿病的威胁[1].全球每年向土壤中输入的总砷量估计达9.4万吨[2],人为砷污染可以使土壤砷含量达到很高的浓度,如皮革厂污水可以使土壤表层和亚表层砷含量分别达到0.435和1.01 g kg-1[3],波兰矿区的土壤砷含量高达43.5 g kg-1[4],贵州杏仁县高砷煤矿区的污水灌溉使土壤砷含量也高达0.237g kg-1[5],该含量是我国国家二级土壤质量标准25 mg kg-1的近10倍,是一级标准15 mg kg-1的近16倍.进入土壤中的砷可以被植物吸收,再通过食物链危害人体和动物健康.如水稻籽粒累积的砷可以达到对人类健康有害的浓度[6],不同植物的富集土壤砷能力不同,一般用迁移系数表示植物富集某元素的能力,不同植物砷的迁移系数变化为0.01~0.1[7].研究土壤砷污染与植物砷含量与分布的关系,既有助于认识植物富集土壤砷的能力和植物响应土壤砷污染的机制,也有助于食品安全标准的制定和人类身体健康.魔芋(Amorphophalluskonjac)是天南星科多年生草本植物[8],因其富含葡甘聚糖而具有较高的药用、食用和保健价值深受发达国家人们的青睐[9-10],日益成为山区脱贫致富和我国出口创汇的重要经济作物.认识魔芋砷含量与分布特点对于魔芋资源的开发利用和魔芋产品的安全生产与经营具有重要意义.我们利用土壤加砷盆栽魔芋试验研究了土壤砷水平对魔芋砷含量与分布的影响,为魔芋安全生产和魔芋产品开发利用提供科学依据.
1 材料与方法
1.1试验材料供试植物为魔芋Amorphophalluskonjac,属天南星科,魔芋属,芋种来源于湖北省恩施土家族苗族自治州恩施市太阳河.所用土壤为红壤,采自武汉市鲁磨路旁南望山下的灌木林地表层,土壤采回后摊开剔除植物残体和石块,风干后过5 mm筛备用.供试土壤有机质为16.1 g kg-1,碱解氮、速效磷、速效钾分别为98.1、5.5和68.8 mg kg-1,土壤砷含量为14.5 mg kg-1,土壤阳离子交换量为10.7 cmol(+) kg-1,土壤pH(水提,水土比为2.5∶1)为5.76.
1.2盆栽实验盆栽试验所用盆钵为圆台形陶瓷钵,高18 cm,体积为3.2 L,每盆装入过5 mm的风干土3.0 kg.设置加砷量0、10.0、20.0、50.0、100.0、200.0 mg kg-1共6个处理,每处理重复3次,共18个盆钵.以亚砷酸钠为砷源,配成含砷0、1.2、2.4、6.0、12.0、24.0 mg mL-1的溶液.称土3.0 kg于塑料盆中,然后按处理水平分别加相应浓度的溶液25 mL于土壤中,并与底肥一起拌均匀,再装入盆栽陶瓷钵中.每kg土施N 200 mg、P 100 mg、 K 200 mg做底肥,以尿素、磷酸二氢钾、硫酸钾为肥源,即分别称取尿素26.67 g、磷酸二氢钾26.32 g、硫酸钾9.93 g,溶解后定容至1 L,每盆加此溶液50 mL,则每盆含尿素1.33 g、磷酸二氢钾1.32 g、硫酸钾0.50 g.2011年3月25日完成称土、处理、拌土、装盆、清洗魔芋种子工作,于2011年3月26日上午播种后,每盆加水500 mL,魔芋质量如表1所示.魔芋生长期间,每天进行水分管理和出苗长势观察,直至茎叶变黄枯萎时收获,收获日期为2011年8月25日.
1.3样品制备魔芋收获时,先将其按地上和地下部分分开.地下部分即为魔芋球茎,将土壤弄碎,选出魔芋球茎,将球茎用自来水洗净,再用蒸馏水清洗,擦干表面水分后称重即为鲜重.然后将其切成细丝,装入陶瓷碟中,放入鼓风干燥箱于60~70 ℃下烘干.地上部分即为魔芋茎叶,先用自来水洗净,然后用蒸馏水清洗,再剪成小于1 cm的小段后,装入纸袋中,放入鼓风干燥箱中,在60~70 ℃条件下烘干.烘干后样品先在干燥器中冷却,然后用百分之一电子天平称重,记录其质量即得球茎和茎叶的干生物量,二者之和即为总生物量.将烘干的魔芋球茎和茎叶分别磨细并过60目筛,装入塑料瓶中备分析测试之用.
表1盆栽试验的魔芋芋种质量g

重复处理砷水平/(mg/kg)0102050100200145.6956.2441.3147.0242.7057.49247.3037.9436.7239.1139.9354.34338.2434.8150.4543.7847.5955.46
1.4土壤基本理化性质的分析土壤基本理化性质用常规法分析[11],即有机质用硫酸-重铬酸钾外加热容量法;碱解氮用碱解扩散法;速效磷用0.5 mol/L NaHCO3浸提,钼蓝法分光光度法测定;速效钾用火焰光度法,CEC用醋酸铵法;pH用电位法.
1.5魔芋砷含量的测定魔芋砷含量的测定用氢化物发生,砷钼蓝分光光度法测定.
1.5.1 样品消解 称取磨细混合均匀魔芋样品于三角瓶中,加水2 mL湿润,加4∶1硝酸-高氯酸混合酸10 mL,低温加热,剧烈反应停止后,加硝酸5 mL,升温加热,呈棕色时再加2 mL混合酸,加热至冒白烟,溶液无棕色.取下冷却后加水20 mL,加热至冒白烟,再重复一次.然后用水少量多次地转移至50 mL容量瓶或比色管并定容.
1.5.2 待测液中砷的测定 吸取一定体积的样品消解液于反应瓶中,加入4 mL 1∶1硫酸、10 mL混合反应液(每升该反应液含有80 g SnCl2,100 mL浓盐酸溶解,125 g酒石酸和30 g KI),放置15 min后加锌粒4 g,立即连接装有醋酸铅脱脂棉的导气管,导气管出口端放入盛有7 mL 0.43%高锰酸钾溶液的10 mL比色管中,反应1 h.反应结束后向比色管中加入2 mL反应液(每升该溶液含有50 g盐酸羟胺、0.3 g硝酸铋、40 g抗坏血酸和140 mL浓盐酸)、1 mL钼酸铵溶液,摇匀放置30 min后,于700 nm处用3 cm比色皿测定吸光度.根据所测得的吸光度用标准曲线法定量.
1.6数据处理和计算所有数据用Excel 2003计算平均值和标准差,也用Excel 2003作图和进行t检验和相关分析.用SPSS10.0进行方差分析和多重比较,多重比较用LSD法,显著水平均用0.05.
2 结果分析

图1 土壤加砷对魔芋砷含量的影响
2.1土壤加砷对魔芋砷含量的影响图1表明,在本实验土壤加砷的水平下,魔芋球茎的砷含量在2.12~14.98 μg g-1之间,茎叶的砷含量在1.23~21.23 μg g-1之间.魔芋球茎和茎叶的砷含量均随着土壤砷水平的增加而增加,相关分析表明,魔芋球茎、球叶的砷含量均与土壤加砷水平呈极显著的线性相关,其相关系数分别为0.985 4、0.986 5(P<0.01).对照即不加砷的处理是球茎砷含量显著高于茎叶,而所有加砷处理的魔芋砷含量均是茎叶高于球茎.所有加砷的魔芋茎叶砷含量比球茎高47.1%~201.6%,也就是魔芋茎叶的砷含量是球茎的1.4~2.5倍,而对照的茎叶砷含量却比球茎低41.7%.

图2 土壤加砷水平对魔芋砷富集量的影响
2.2土壤加砷水平对魔芋砷富集量的影响用魔芋生物量乘以其魔芋砷含量来表示魔芋富砷量,以说明魔芋对土壤砷的富集能力.图2可见,魔芋球茎的富砷量为25~256 μg,茎叶的富砷量为7~285 μg,魔芋总富砷量在38~541 μg.随土壤砷水平增加,魔芋球茎、茎叶的富砷量和总富砷量均增加,相关分析表明,魔芋球茎、茎叶富砷量和总富砷量与土壤砷水平的线性相关系数分别为0.976 0、0.998 2和0.997 7,均超过了0.01的显著水平(0.911),证明魔芋球茎、茎叶富砷量和总富砷量均与土壤砷水平呈极显著的线性相关.在较低的土壤砷水平下,富砷量为球茎大于茎叶,当土壤砷水平在20 mg kg-1以上时,则是茎叶富砷量高于球茎.

图3 土壤加砷对魔芋富砷量的分配的影响
2.3魔芋富集砷的分配魔芋富集砷的分配是指球茎、茎叶所富砷量占魔芋植株总富砷量的比例.图3可见,球茎的富集砷量占总富集量的30%~80%,茎叶的富砷量占总砷量的18%~70%.在0~100 mg kg-1的土壤加砷水平范围内,魔芋球茎富砷量占总富砷量比例随土壤砷水平增加而呈降低的趋势,茎叶的富砷量占总富砷量的比例则呈增加的趋势,在200 mg kg-1土壤加砷水平下,球茎富砷量所占比例又增加,茎叶所占比例又下降.同对照相比,所有加砷处理魔芋球茎富砷量所占比例均低于对照,魔芋茎叶富砷量所占比例均显著高于对照.在0~20 mg kg-1的土壤加砷水平内,魔芋球茎富砷量占总富砷量的比列高于茎叶富砷量占总富砷量的比例,而在50~200 mg kg-1的土壤加砷水平下,则是魔芋茎叶富砷量所占比例高于球茎富砷量所占比例.
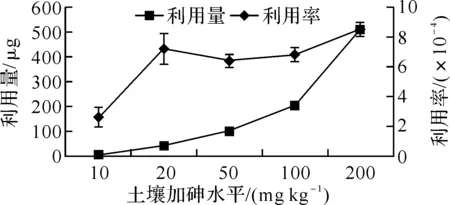
图4 魔芋对土壤加砷的利用量和利用率
2.4魔芋对土壤加砷利用率的影响用加砷处理魔芋的总富砷量减去对照的总富砷量作为魔芋对土壤加砷的利用量,利用量占土壤加砷量的比例就是魔芋对土壤加砷的利用率.在不同的土壤加砷的水平下,魔芋对土壤加砷的利用量和利用率不同.随土壤加砷水平增加,魔芋对土壤加砷的利用量增加,利用量与土壤加砷量的线性相关系数为0.997 9(P<0.01),表明利用量与土壤加砷量呈极显著的线性相关.魔芋对土壤加砷的利用量在0.25‰~0.84‰之间,土壤加砷10 mg kg-1的利用率最低,显著低于其他加砷水平的利用率,加砷水平200 mg kg-1的利用最高,显著高于加砷50和100 mg kg-1的处理,但与加砷20 mg kg-1的无显著差异,而加砷20、50和100 mg kg-1的利用率无显著性差异.
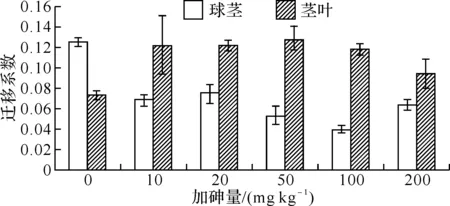
图5 土壤加砷对魔芋砷富集系数的影响
2.5魔芋对土壤砷的富集系数富集系数也叫迁移系数,是指植物中某元素的含量与土壤中某元素含量的比值.图5可见,魔芋球茎对砷的富集系数在0.03~0.13之间,魔芋茎叶砷的富集系数在0.07~0.13之间.同对照相比,所有加砷处理魔芋球茎的富集系数均显著小于对照,而茎叶的富集系数均显著高于对照.对照魔芋球茎的富集系数显著高于茎叶,而所有加砷处理的富集系数则是茎叶显著高于球茎.
3 讨论
3.1魔芋的砷含量本实验中魔芋球茎和茎叶砷含量均与土壤砷水平呈极显著的线性相关,说明土壤中的砷能够从土壤中转移到魔芋球茎和茎叶中,也说明土壤砷水平是决定魔芋砷含量的重要因素.在低砷土壤环境中,植物砷含量很低,而在高砷土壤下,植物砷含量会明显升高.如本实验中土壤加砷200 mg kg-1下魔芋球茎砷含量是对照的7.6倍,茎叶砷含量是对照的17.9倍;土壤加砷盆栽大豆实验也表明,大豆根、茎叶和籽粒的砷含量均与土壤砷水平呈极显著的线性相关[12];无论是蔬菜作物还是粮食作物,都是污染区的砷含量高于清洁区[13].植物类型不同,砷含量也不同.如对蔬菜和粮食作物的研究表明,砷含量为叶菜类>根茎类>茄果类>鲜豆类,水稻砷含量显著高于小麦和玉米[13].分析作物可食部位发现砷含量呈洋葱>花菜>水稻>茄子>土豆[14].大多数植物砷含量都不是很高,多在100 mg kg-1以下,但也发现一些植物特别能富集土壤中的砷的植物,如凤尾蕨叶子中的砷可以高达3 650 mg kg-1、根中砷含量可以高达507 mg kg-1[15],蜈蚣草叶子中的砷含量可高达6 151 mg kg-1[16],锑矿区水薄荷根与叶的砷含量分别为540和216 mg kg-1,而芦苇根的砷含量为688 mg kg-1[17].这些砷含量能够达到很高水平的植物被称为砷超积累植物,有的可用于修复砷污染严重的土壤.能够用作修复污染土壤的砷超积累植物必须满足富集土壤砷的能力强,生物量大,生长能力强.本实验表明,在土壤加砷200 mg kg-1的条件下,魔芋球茎和茎叶砷含量才达到15和21 mg kg-1,说明魔芋吸收利用土壤砷的能力很弱.
植物部位不同,砷的含量也不相同.本实验表明,所有加砷处理的砷含量呈茎叶高于球茎的现象,而对照是球茎高于茎叶,说明土壤加砷也就是土壤砷污染可以改变魔芋砷在地上和地下的分配模式.大豆盆栽试验表明,大豆砷含量呈根>茎>籽粒[12],对污染区22种植物砷含量的研究发现,植物砷含量一般呈根>叶>茎>果[18],水稻砷含量的分布是根>茎叶>谷壳>糙米[18],土壤盆栽油菜和小麦实验结果表明,油菜和小麦砷含量呈根系>茎叶>颖壳>种子[19].本实验结果是在砷污染条件下,魔芋砷含量是茎叶高于球茎,而魔芋球茎为可食部位.因此上述文献的结果和本实验的结果都说明,作物在砷污染条件下,可食部位砷含量最低,这对于砷轻度污染的土壤种植利用是有利的,因为人类一般直接利用可食部位,而可食部位砷含量最低,有利于砷污染地区的健康安全.
3.2魔芋对土壤砷的富集能力仅用含量不能完全反应植物对土壤砷的吸收和富集能力,因为含量只是单位数量的物质中所含有数量,实际上是一种相对指标.含量高,如果生物量低,其吸收和富集能力也不会强.我们用魔芋的砷含量乘以魔芋的生物量,得到魔芋吸收砷的总量,作为魔芋的富砷量.富砷量可以反映魔芋在一定土壤环境条件下的吸收和富集土壤砷的能力.本实验结果中,魔芋球茎、茎叶和总富砷量均与土壤加砷水平呈极显著的线性相关,说明魔芋吸收和富集土壤砷的能力随土壤砷水平的提高而增加.在低土壤砷水平下,魔芋富砷量呈球茎大于茎叶的趋势,而在较高的土壤砷水平(>20 mg kg-1)下,魔芋富砷量则是茎叶高于球茎,同时,在富砷量的分配中,低土壤砷水平下,球茎富砷量所占比例高于茎叶,较高土壤砷水平条件下,茎叶富砷量所占比例大于球茎,这说明魔芋能够通过将所吸收的砷转移到地上部分来适应高砷土壤环境.将砷转移到植物特定的组织或器官也是植物的耐砷机制之一[20].魔芋对土壤加砷的利用率只有0.25‰~0.84‰,这与大豆对土壤加砷的利用率基本一致[12],这说明魔芋对土壤加砷的利用率很低,表明魔芋是吸收和富集砷能力很弱的植物,同时也表明,加入土壤中的砷容易被土壤转化固定,对植物的有效性低.
用富集系数比较不同作物的富集能力也许是可行的,但是由于富集系数只是根据含量来计算的,含量是相对指标,没有考虑植物的生物量,因此用富集系数来比较植物不同部位的富集能力是不恰当的,如根据富砷量和富集系数得出大豆不同部位的富集砷的能力就不一致[12].本实验中魔芋对砷的富集系数在0.03~0.13之间,与大豆对土壤加砷的富集系数基本相近[12],也与Warren等[7]计算的不同作物富集系数变化范围0.01~0.1大致相符.本实验中,在土壤低砷水平下,魔芋球茎的富砷量大于茎叶或与茎叶差异不显著,而土壤高砷水平(>20 mg kg-1)下是茎叶富砷量大于球茎,而所有加砷处理的富集系数都是茎叶大于球茎.这也说明利用富砷量比较出的魔芋球茎和茎叶的富集能力与利用富集系数比较出的富集能力也不一致.因此要准确衡量植物的富集能力,应该将富集量和富集系数相结合为好.
4 结论
1)魔芋球茎和茎叶砷含量与土壤加砷量呈极显著的线性相关,土壤加砷改变了魔芋砷含量的分布,对照条件下球茎砷含量高于茎叶,而加砷条件下,茎叶砷含量高于球茎.
2)魔芋富砷量与土壤加砷量呈极显著的线性相关,土壤低砷条件下,球茎富砷量大于茎叶,高砷条件下茎叶富砷量大于球茎.
3)土壤加砷降低了球茎富砷量所占比例,增加了茎叶富砷量所占比例.
4)魔芋对土壤加砷的利用量随土壤加砷水平升高而增加,二者呈极显著的线性相关,魔芋对土壤加砷的利用率较低,在0.25‰~0.84‰之间.
5)土壤加砷降低了球茎的富集系数,增加了茎叶的富集系数,加砷处理下茎叶富集系数大于球茎,对照条件下,球茎富集系数大于茎叶.
6)土壤加砷不仅影响魔芋砷的含量和吸收,也改变魔芋体内砷的分配格局,魔芋通过将所吸收的砷转移到茎叶来适应砷污染土壤环境.
[1] Aposhian H V, Zakharyan R A, Avram M D, et al. A view of the enzymology of arsenic metabolism and a mew potential role of hydrogen peroxide in the detoxication of the trivalent arsenic species[J]. Toxicol Appl Pharmacol,2004,198:327-335.
[2] Nriagu J O, Pacyan J M. Quantitative assessment of world wide contamination of air water and soils by trace metals[J]. Nature,1999,28(1):12-14.
[3] Salder R, Olszowy H, Shaw G, et al. Soil and water contamination by arsenic from tannery waste[J]. Water, Air and Soil Pollution,1994,78:189-198.
[4] Bhattacharya P, Weleh A H, Stollenwerk K G, et al. Arsenic in the environment: biology and chemistry[J]. Science of the Total Envirenment,2007,379:109-120.
[5] 刘宏,吴攀,张翅鹏,等.高砷煤矿废水灌溉区土壤砷的分布特征研究[J].环境科学与技术,2010,33(8):57-61.
[6] Zhu Y G, Williams P N, Meharg A A. Exposure to inorganic arsenic from rice: a global health issue?[J]. Environ Pollut,2008,154:169-171.
[7] Warren G P, Alloway B J, Lepp N W, et al. Field trials to assess the uptake of arsenic by vegetables from contaminated soils and soil remediation with iron oxides[J]. Science of the Total Envirenment,2003,311:19-33.
[8] 孙继华,杨超,刘菊华,等.魔芋高效再生体系的建立与优化[J].热带作物学报,2012,33(1):84-88.
[9] Fang W, Wu P. Variations of konjac glucomannan(KGM) from Amorphophallus konjac and its refined powder in China[J]. Food Hydrocolloids,2004,18:167-170.
[10] Melinda Chuaa, Timothy C Baldwina, Trevor J Hockinga, et al. Traditional uses and potential health benefits ofAmorphophalluskonjacK. Koch ex N.E.Br[J]. Journal of Ethnopharmacology,2010,128:268-278.
[11] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:12-95.
[12] 杨兰芳,何婷,赵莉.土壤砷污染对大豆砷含量与分布的影响[J].湖北大学学报:自然科学版,2011,33(2):202-208.
[13] 肖细元,陈同斌,廖晓勇,等.我国主要蔬菜和粮油作物的砷含量与砷富集能力比较[J].环境科学学报,2009,29(2):291-296.
[14] Dahal B M, Fuerhacker M, Mentler A, et al. Arsenic contamination of soils and agricultural plants through irrigation water in Nepal[J]. Environmental Pollution,2008,155:157-163
[15] Srivastava M, Ma L Q, Stantos J A G. Three new arsenic hyperaccumulating ferns[J]. Science of the Total Environment,2006,364:24-31.
[16] Gonzaga M I A, Santos J A G, Lena Q, et al. Phytoextraction by arsenic hyperaccumulatior Pteris vittata L. from six arsenic-contaminated soils: repeated harvests and arsenic redistribution[J]. Environmental Pollution,2008,154:212-218.
[17] Baroni F, Boscagli A, Lella L A D, et al. Arsenic in soil and vegetation of contaminaed areas in southern Tuscany(Italy)[J]. Journal of Geochemical Exploration,2004,81:1-14.
[18] 黄丽玫,陈志澄,颜茂利.砷污染区植物种植的筛选研究[J].环境与健康杂志,2006,23(4):308-310.
[19] 刘全吉,郑床木,谭启玲,等.土壤高砷污染对冬小麦和油菜生长影响的比较研究[J].浙江农业学报,2011,23(5):967-971.
[20] 蒋汉明,邓天龙,赖冬梅,等.砷对植物生长的影响及植物耐砷机理研究进展[J].广东微量元素科学,2009,16(11):1-5.
