土壤加砷对大豆叶绿素、脯氨酸和过氧化氢酶活性的影响
2013-11-19牛昌美杨兰芳彭小兰裴艳艳
牛昌美,杨兰芳,彭小兰,裴艳艳
(1.湖北大学资源环境学院,湖北 武汉 430062;2.中国科学院土壤研究所,江苏 南京 210008)
0 引言
砷广泛分布于自然界中,可以通过自然、工业活动和农业利用进入环境,很多国家和地区如印度、孟加拉、泰国、尼泊尔、美国、中国等都有严重的砷污染问题[1],砷是动植物的非必需元素,矿业及冶炼、化石燃料燃烧、含砷物质和肥料的利用、城市和工业废弃物的处置等人类活动是环境砷污染的主要来源[2].如英格兰西北部的矿区土壤中砷的含量高达200 g kg-1,园艺利用含砷的杀虫剂可使土壤表层砷含量达到124 mg kg-1[3].砷是自然界中毒性最大的元素之一,砷及其化合物具有致癌性、致突变性和致畸性[4-5].砷对植物也具有毒性,土壤砷污染对植物的危害主要表现为阻碍水分在植株内运行,影响水分和营养的吸收,并使砷在植物中累积,造成叶绿素的破坏[6].实验表明,当土壤加砷水平达到50 mg kg-1时,大豆出现中毒症状,叶片皱缩,叶色变暗,叶缘焦枯,植株矮化,成熟延迟[7].研究植物对土壤环境中砷的生理生化响应对于正确评价土壤砷污染水平、食品安全和人类健康都具有极其重要的意义.大豆是我国及世界的主要油料作物[8],也是人类植物蛋白质的主要来源[9],研究大豆生理指标与土壤砷污染之间关系有助于揭示大豆砷毒害的机理.本研究利用土壤盆栽大豆实验,通过测定叶绿素、脯氨酸、过氧化氢酶活性等生理指标,探索土壤砷污染与大豆生理指标的关系,为认识大豆对土壤砷污染的生理响应和大豆安全生产提供科学依据.
1 材料与方法
1.1土样的采集与处理实验所用的土壤为红壤,属于铁铝土纲,湿热铁铝土亚纲,红壤土类,棕红壤亚类.土壤采自武汉市鲁磨路南望山山麓旁的荒芜耕地.土壤从野外采回后,在室内摊开,剔除石块和植物残体,经常翻动使其自然风干,然后过5 mm筛混合均匀后备盆栽试验之用.从中取约500 g土壤再过1 mm筛后混合均匀,从中再取约50 g土样磨细过0.15 mm筛混合均匀.过0.15 mm筛的土壤供测定土壤有机质之用,过1 mm的土壤样供测定其余的土壤基本农化性质之用.土壤基本理化性质见表1所示.

表1 供试土壤基本理化性质
供试大豆品种为春大豆,为有限结荚型,大豆株型较矮,适合盆栽,种子由中国农业科学院武汉油料作物研究所提供.
1.2盆栽试验用圆台形陶瓷钵作为实验盆钵,盆钵高15 cm,体积3.2 L.每盆装土3.0 kg,设置土壤加砷0、5.0、10.0、30.0、50.0、100.0 mg kg-1总共6个处理,每处理重复3次.每盆施入相同数量的基肥,基肥用(NH4)2SO4、KH2PO4和KCl配制成含N、P2O5、K2O分别为21.6、16.2、36.0 mg mL-1的溶液,装盆时每盆加入此溶液10 mL混匀即可.砷用亚砷酸钠配制成0、0.6、1.2、3.6、6.0、12.0 mg mL-1的系列溶液,每盆按顺序加入相应的溶液25 mL,连同肥料一起拌均匀后装入盆栽钵中,即得土壤加砷0、5.0、10.0、30.0、50.0、100.0 mg kg-1的处理水平.
2009年5月10日装盆播种,每盆播种籽粒饱满、大小一致的种子3颗,播种后灌足水分,将所有盆钵放置在1.2 m×2.0 m的可移动推车上,雨天将车推进玻璃房内,非雨天则将车推到玻璃房外的露天里.待苗长至5~8 cm以上时,进行间苗,每盆保留长势较一致的苗1株.实验期间每天进行观察和水分管理并记录植物生长状况.
1.3 化学分析
1.3.1 叶绿素含量的测定 叶绿素测定了两次,一次是结荚期即2009年7月8日采样测定,第二次是鼓粒期即2009年8月1日采样测定.剪取大豆新鲜叶片(从上往下,第3片完整叶),立即带回室内,洗干净后用吸水纸吸干水分,去掉中脉剪碎后混匀.称取剪碎样品0.2 g,放入25 mL比色管中,加入95%乙醇25 mL,用黑色袋子套住,放在暗处,直到叶片完全变白,在波长665、649、470 nm下分别测定其吸光度,根据公式计算出叶绿素a、叶绿素b和类胡萝卜素的含量[10].
1.3.2 脯氨酸含量的测定 在大豆结荚期即2009年7月9日采样测定大豆叶片的脯氨酸含量,利用茚三酮显色,甲苯萃取分光光度法测定[10].
1.3.3 过氧化氢酶活性的测定 在大豆结荚期即2009年7月7日采样测定过氧化氢酶活性,用紫外分光光度法测定[11].
1.3.4 土壤基本理化性质用的测定 土壤基本理化性质用常规法分析,即有机质用硫酸-重铬酸钾外加热容量法,碱解氮用碱解扩散法,速效磷用钼蓝法分光光度法,速效钾用火焰光度法,CEC用醋酸铵法,pH用电位法,土壤质地用吸管法测定[12].
1.4数据分析所有数据用Excel 2003计算平均值、标准差和作图,用SPSS10.0进行方差分析和多重比较,多重比较方法用LSD法,显著水平用0.05.
2 结果与分析
2.1土壤加砷对大豆叶绿素的影响在结荚期的采样测定中(表2),各加砷处理的叶绿素a(ya)、叶绿素b(yb)、类胡萝卜素(yc)的含量以及叶绿素总量(ya+b)与不加砷的对照之间均无显著差异,表明在本实验的条件下,土壤加砷对大豆叶绿素含量的影响不显著.虽然含量看不出与对照的差异,但叶绿素a与叶绿素b的比值和叶绿素a占总叶绿素的比例则是有显著差异的.无论是叶绿素a与叶绿素b的比值,还是叶绿素a占总叶绿素的比例,土壤加砷5~30 mg kg-1的处理与对照之间无显著差异,而加砷50和100 mg kg-1的处理则显著低于对照.
在鼓粒期的采样测定中(表3),土壤加砷处理显著影响大豆叶片的叶绿素含量.叶绿素a、叶绿素b和叶绿素总量中,土壤加砷5、10、30 mg kg-1的处理与对照无显著差异,而加砷50和100 mg kg-1的处理显著高于对照.加砷处理的类胡萝卜素除了10 mg kg-1的处理与对照差异不显著外,其余处理均显著高于对照.虽然加砷处理使叶绿素a与叶绿素b的比值有增加的趋势,但是除了10 mg kg-1的处理之外,其余处理均与对照无显著差异.叶绿素a所占的比例是5、10、30 mg kg-1的处理与对照无显著差异,加砷50和100 mg kg-1处理的显著高于对照.土壤加砷使叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素的最大增加率分别为119.8%、111.0%、117.2%和105.6%.
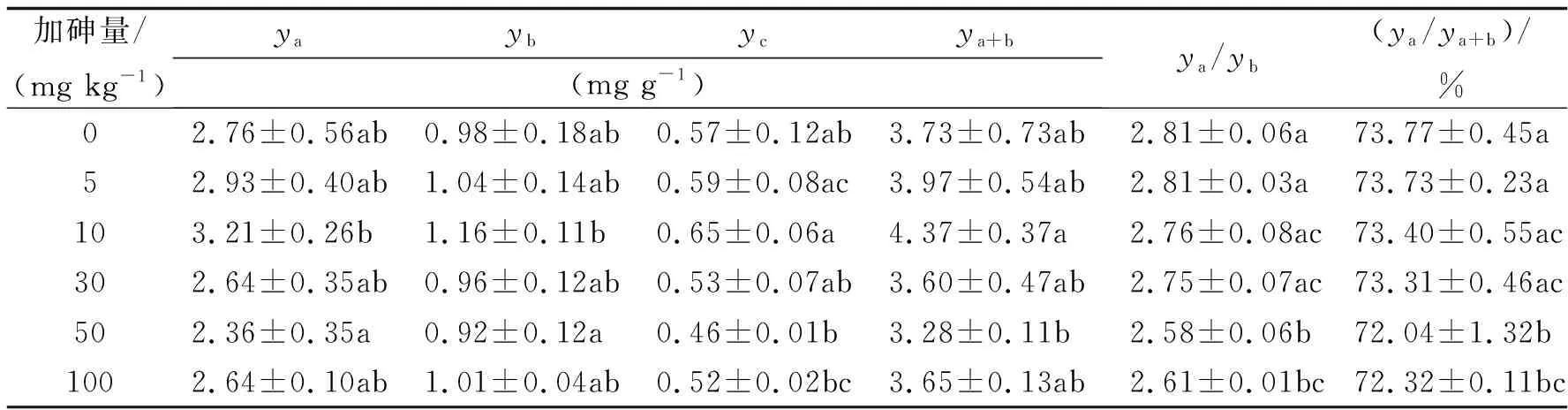
表2 大豆结荚期的叶绿素含量与构成
ya、yb、ya+b、ya/yb、ya/ya+b分别表示叶绿素a、叶绿素b、叶绿素总量、叶绿素a与叶绿素b的比值、叶绿素a占叶绿素总量的百分率,下同.
2.2土壤加砷量对大豆脯氨酸含量的影响图1表明,土壤加砷处理对大豆叶片脯氨酸含量有显著影响.在土壤加砷0~10 mg kg-1的范围内,大豆叶片脯氨酸含量呈增加的趋势,但是统计分析表明,加砷5和10 mg kg-1的处理与对照之间无显著差异,加砷30、50和100 mg kg-13个处理的脯氨酸含量显著低于对照和加砷5和10 mg kg-1的处理,但是后三者之间无显著差异.同对照相比,土壤加砷使大豆叶片脯氨酸含量的降低率在23.4%~31.4%.
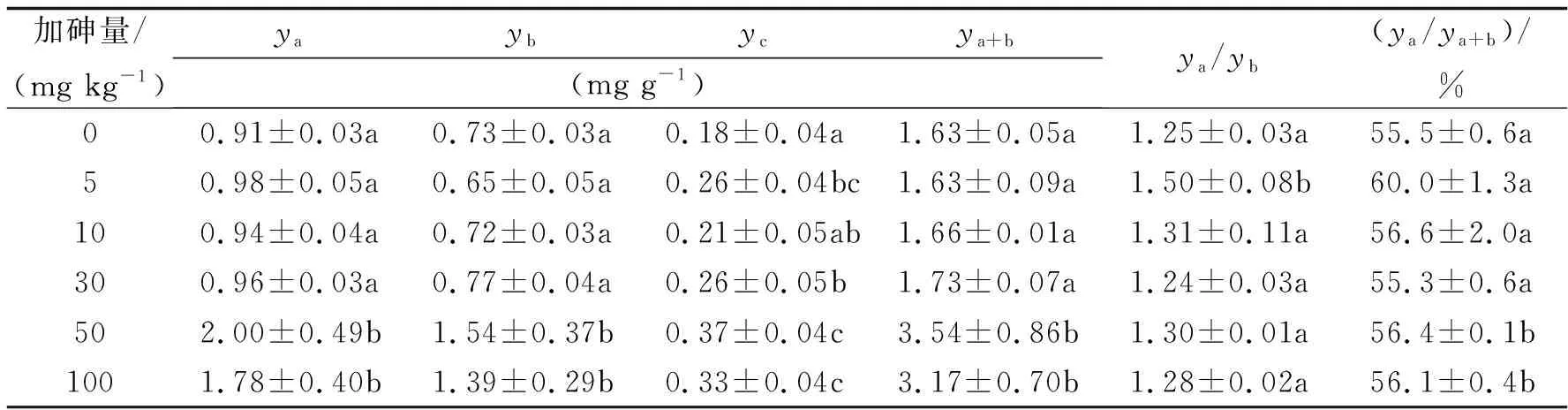
表3 大豆鼓粒期的叶绿素含量与构成
2.3土壤加砷量对大豆过氧化氢酶含量的影响图2可见,土壤加砷显著影响大豆叶片过氧化氢酶活性.在0~50 mg kg-1的土壤加砷范围内,过氧化氢酶活性首先呈下降趋势,当土壤加砷水平达到100 mg kg-1时,过氧化氢酶活性又有回升.统计分析表明,所有增加砷处理的过氧化氢酶活性均显著低于对照,土壤加砷使过氧化氢酶活性降低了10.7%~46.6%,以加砷50 mg kg-1的过氧化氢酶活性最低.
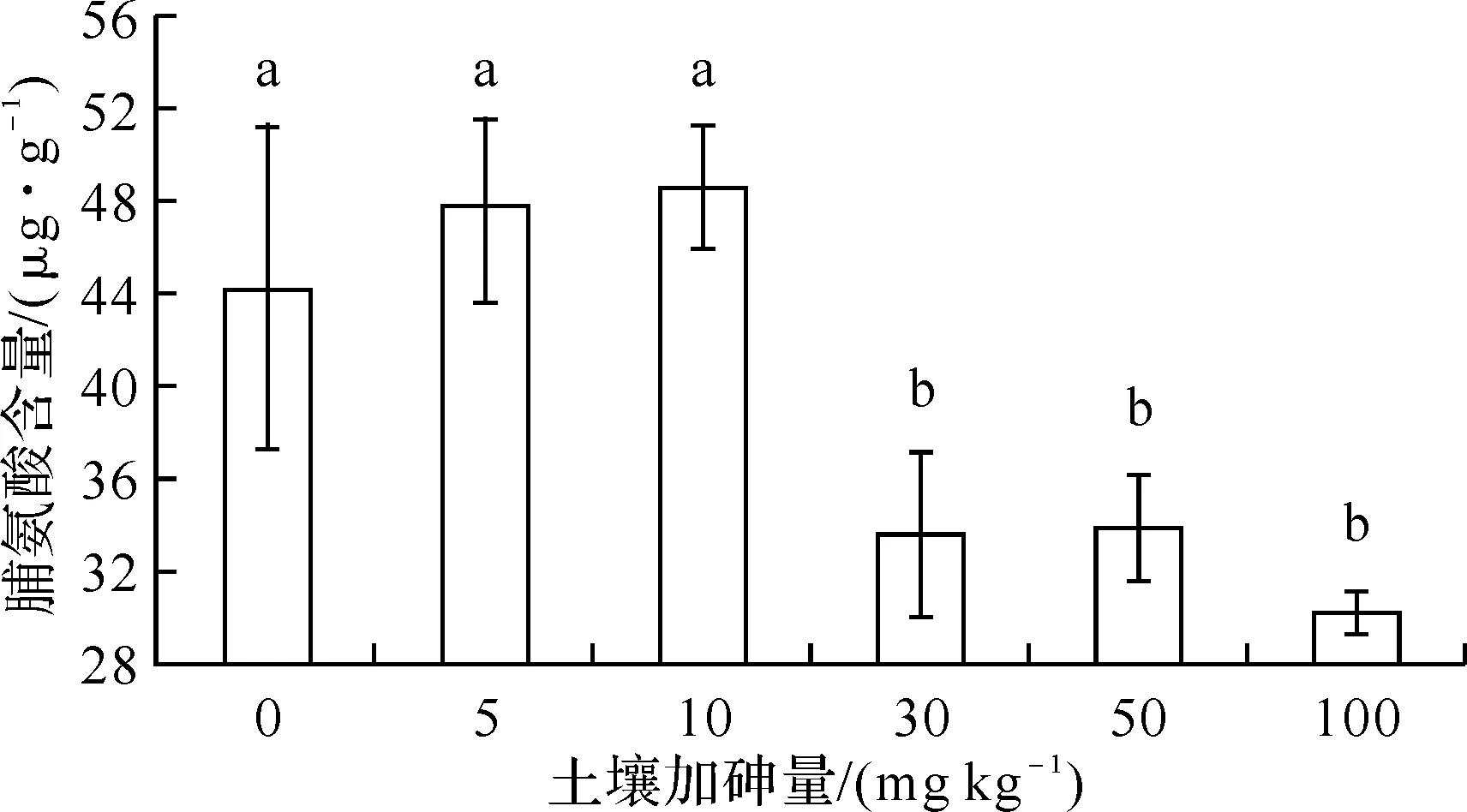
图1 土壤砷污染对大豆脯氨酸含量的影响

图2 土壤加砷对大豆过氧化氢酶活性的影响
3 讨论
砷不是植物生长的必须元素,会妨碍植物代谢和抑制植物生长[13],目前砷对植物生长代谢的影响机理认识还相当欠缺.本实验结果表明,土壤加砷影响大豆叶绿素、脯氨酸和过氧化氢酶等生理指标.
叶绿素是植物叶绿体内参与光合作用的重要色素,它的功能是捕获光能并驱动电子转移到反应中心,对植物生长和农作物产量具有极其重要的作用[14].本实验证明,在大豆的结荚期,不同土壤加砷水平下的大豆叶片叶绿素含量无显著差异,但是加砷50和100 mg kg-1水平下的叶绿素a与叶绿素b的比值以及叶绿素a所占比例显著低于对照,说明较高的土壤砷水平影响大豆结荚期的叶绿素构成.在大豆鼓粒期,土壤加砷50和100 mg kg-1处理的叶绿素含量、类胡萝卜素含量和叶绿素a所占比例均显著高于对照,说明土壤砷水平既影响大豆鼓粒期的叶绿素含量,也影响叶绿素的构成.目前有关砷与叶绿素关系的研究不多,利用土壤加入砷酸钠栽培豌豆的实验表明,培养32 d后,加砷处理的叶绿素含量增加,而叶绿素a与b的比值降低[15].叶绿素a与b的比值降低的结果与本实验结荚期的结果一致,叶绿素含量增加的结果与本实验鼓粒期的结果一致.这说明土壤砷污染影响叶绿素含量和构成,从而可以通过影响植物光合作用来影响植物的生长.植物成熟延迟也是植物砷毒害的一种表现,本实验表明,大豆鼓粒期高砷水平下叶绿素含量高,与砷毒害延迟植物成熟应该是一致的.
脯氨酸是植物蛋白质的组分之一,并可以以游离状态广泛存在于植物体中,在干旱、盐渍等胁迫条件下,许多植物体内脯氨酸大量积累,积累的脯氨酸除了作为植物细胞质内渗透调节物质外,还在稳定生物大分子结构、降低细胞酸性、解除氨毒以及作为能量库调节细胞氧化还原势等方面起重要作用[16-17].如脯氨酸预处理可以降低镉胁迫下龙葵的活性氧自由基水平,保护细胞原生质膜的完整性,从而提高对镉的耐受能力[18].本实验表明土壤加砷量30 mg kg-1以下时,脯氨酸含量与对照无统计上的差异,说明低水平的砷不影响大豆的抗逆性,而土壤加砷30 mg kg-1及其以上时,大豆叶片脯氨酸含量显著低于对照,说明土壤砷水平高达一定程度时就显著降低大豆的抗逆性,会使植物更容易受逆境的胁迫.从生长形态来看,只有在土壤加砷50 mg kg-1下,大豆才有明显的毒性症状表现[11],而从脯氨酸的含量来看,加砷30 mg kg-1下,脯氨酸的含量已显著低于对照了,而且随加砷水平的进一步增加,脯氨酸的含量差异并不显著,说明在加砷30 mg kg-1的水平下,大豆已经受到了砷毒性的损伤了,因此,本实验表明,通过生理生化指标如脯氨酸含量等,比通过形态观察更能尽早地发现植物是否受到了砷的毒性损伤.
过氧化氢酶是一类广泛存在于各种微生物和动植物体内的一类酶,能够清除植物体内H2O2以保护植物免受氧化损伤[19].本实验表明,土壤加砷降低了大豆叶片中的过氧化氢酶活性,说明土壤污染会破坏植物的抗氧化系统,从而不利于植物抵抗和修复氧化损伤.加砷处理降低了绿豆过氧化氢酶活性,从而认为砷通过诱导与氧化胁迫相关的脂质过氧化抑制绿豆根系生长[20];加砷的小麦实验也表明,当砷水平超过5 mg kg-1时,砷抑制了过氧化氢同工酶的表达[21].这些结果与本实验的结果基本一致,这说明砷通过抑制过氧化氢酶等抗氧化酶的活性,增加氧化胁迫而影响植物生长.本实验结果中,最低过氧化氢酶活性在土壤加砷50 mg kg-1的处理,而不是最高加砷水平100 mg kg-1,最高加砷处理的过氧化氢酶活性虽然显著低于对照,但是却明显有所回升,回到了跟加砷5 mg kg-1的处理无显著差异的程度,显著高于土壤加砷10、30和50 mg kg-1的处理.可能原因应该在高砷水平下,植物受到高浓度H2O2胁迫,植物为了避免更大的损伤,会形成过氧化氢酶来分解过氧化氢,尽量较少损伤,因为过氧化氢酶的功能就是分解过氧化氢,对植物起保护作用.当然这有待于进一步通过测定过氧化氢的含量、活性氧自由基的含量和与此相关其它抗氧化酶的活性来验证.
总之,砷可以通过改变叶绿素的构成和含量而影响植物光合作用,降低植物的抗逆性和抑制植物抗氧化性等方面影响植物生长.
4 结论
1)土壤加砷对大豆叶绿素的影响在不同时期表现不同,对结荚期叶绿素含量无显著影响,但是较高水平的砷降低了叶绿素a与叶绿素b的比值和叶绿素a所占叶绿素总量(ya+b)的比例,较高水平的砷增加大豆鼓粒期的叶绿素含量.
2)土壤加砷达到一定水平时降低了大豆叶片的脯氨酸含量,加砷100 mg kg-1时,脯氨酸降低了31.4%,表明高砷水平会抑制大豆的抗逆性.
3)土壤加砷使大豆过氧化氢酶活性降低了10.7%~46.6%,说明土壤砷污染会损伤植物的抗氧化系统.
4)土壤砷污染通过影响大豆的光合作用、降低抗逆性和破坏抗氧化系统来影响大豆的生长.因此可以通过测定植物生长期间的生理指标来判定植物受砷污染损害的状况.
[1] Singh N, Kumar D, Raisuddin S, et al. Genotoxic effects of arsenic: prevention by functional food-jaggery[J]. Cancer Letters,2008,268:325-330.
[2] Gunes A, Pilbeam D J, Inal A. Effect of arsenic-phosphorus interaction on arsenic-induced oxidative stress in chickpea plants[J]. Plant Soil,2009,314:211-220.
[3] Smith E, Naidu R, Alston A M. Arsenic in the soil environment: a review[J]. Advances in Agronomy,1998,64:149-195.
[4] Mateos-Naranjo E, Andrades-Moreno L, Redondo-Gómez S. Tolerance to and accumulation of arsenic in the cordgrass Spartina densiflora Brongn[J]. Bioresource Technology,2012,104:187-194.
[5] Pillai A, Sunita G, Gupta V K. A new system for the spectrophotometric determination of arsenic in environmental and biological samples[J]. Analytica Chimica Acta,2000,408:111-115.
[6] 胡省英,冉伟彦.土壤环境中砷元素的生态效应[J].物探与化探,2006,30(1):83-91.
[7] 杨兰芳,彭小兰,裴艳艳,等.土壤添加亚砷酸钠对大豆生长和植株氮、磷、钾含量的影响[J].环境科学学报,31(12):2748-2755.
[8] 邸少华,谢立勇,郝兴宇.大气CO2浓度升高对夏大豆叶片生理生化形状的影响[J].华北农学报,2012,27(2):165-169.
[9] 曹永强,宋书宏,董丽杰.大豆蛋白质和油分含量遗传研究进展[J].大豆科学,2012,31(2):316-319.
[10] 邹琦.植物生理学实验指导书[M].北京:中国农业出版社,2000:72-73,161-162,168-169.
[11] 杨兰芳,庞静,彭小兰,等.紫外分光光度法测定植物过氧化氢酶活性[J].现代农业科技,2009,20:364-366.
[12] 劳家柽.土壤农化分析手册[M].北京:中国农业出版社,1988:229-354.
[13] Zhao F J, Ma J F, Meharg A A, et al. Arsenic uptake and metabolism in plants[J]. New Phytol,2009,181:777-794.
[14] 王平荣,张帆涛,高家旭,等.高等植物叶绿素生物合成的研究进展[J].西北植物学报,2009,29(3):629-636.
[15] Päivöke A E, Simola L K. Arsenate toxicity to Pisum sativum: mineral nutrients, chlorophyll content, and phytase activity[J]. Ecotoxicology and Environmental Safety,2011,49:111-121.
[16] 王丽媛,国华,黎莉.脯氨酸代谢的研究进展[J].哈尔滨师范大学学报,2010,26(2):84-89.
[17] Szabados L, Savouré A. Proline: a multifunctional amino acid[J]. Trends in Plant Science,2010,15(2):89-97.
[18] Xu J, Yin H, Li X. Protective effects of proline against cadmium toxicity in micropropagated hyperaccumulator,SolanumnigrumL[J]. Plant Cell Rep,2009,28:325-333.
[19] 刘灵芝,钟广蓉,熊莲,等.过氧化氢酶的研究与应用进展[J].化学与生物工程,2009,26(3):15-18.
[20] Singh H P, Batish D R, Kohli R K, et al. Arsenic-induced root growth inhibition in mung bean(Phaseolus aureus Roxb) is due to oxidative stress resulting from enhanced lipid peroxidation[J]. Plant Grwoth Regul,2007,53:65-73.
[21] Li C-X, Feng S-L, Shao Y, et al. Effects of arsenic on seed germination and physiological activities of wheat seedling[J]. Journal of Environmental Science,2007,19(6):725-732.
