大强度间歇运动在肥胖症及其相关慢性病干预中的应用研究进展
2013-11-17沈友青宋涛庞秋徐国栋
沈友青宋涛庞秋徐国栋
1湖北第二师范学院体育系(湖北武汉430205)
2武汉体育学院研究生部 3江汉大学体育学院
肥胖症及其相关代谢性疾病如代谢综合征(Mets)、II型糖尿病(T2DM)、非酒精性脂肪 肝(NAFLD)、冠心病(CHD)与高血压(HPT)等发病率,无论是在欧美发达国家,还是在中国、巴西、印度等发展中国家均正以惊人的速度增长,目前已迅速成为亟待解决的全球公共健康危机[1-3]。1968年Dan’ko IuI首次提出将体育锻炼作为疾病干预手段,认为它有助于恢复机体内环境的稳定[4]。大量研究证明,体育锻炼是一种经济、有效、非药物干预手段,在肥胖症、Mets、T2DM等慢性病防治中发挥重要作用[5-7]。但目前对于慢性病干预时运动方式的选择和运动方案的设计仍存在较多争议。现有锻炼指南中推荐的较为常见、传统的干预方式为中低强度持续运动,然而在实践过程中发现该锻炼方式存在时间长、较为枯燥的特点,锻炼者没有时间参与或根本无法长时间坚持。近期研究指出,大强度间歇运动 (highintensity interval/intermittent training,HIT) 以其特定的运动方式诱导机体产生的神经内分泌和外周组织代谢适应性变化,可降低慢性病罹患风险,对健康人群和患者均具有积极效应;同时,HIT在主观感受和时间消耗上较传统持续运动方式更具优势[8,9]。然而,HIT受到多个结构要素的影响,其干预效果存在争议;同时,对于HIT作用的生物学机制仍不清楚。本文将综述HIT在肥胖症等慢性病干预研究中的最新进展,归纳和分析引起代谢适应性变化的机制;同时,分析HIT在实践应用中的医务监督问题,进一步提出研究展望。
1 大强度间歇运动的概念
大强度间歇运动(HIT)是一种由快速、重复性大强度运动和间歇采用安静或低强度运动恢复方式组成的运动形式,由运动强度、运动时间、重复次数、间歇时间及恢复方式等要素构成[8]。从现有针对人类和啮齿动物干预的文献报道来看,各要素的最佳组合形式并未形成定论且干预效果存在差异。部分研究设计如表1所示,运动强度的设定依据和各要素的设定均存在较大差异。与此同时,研究对象和研究条件不一致,也影响到各研究中HIT的干预效果。
2 大强度间歇运动在肥胖症及其相关代谢性疾病防治中的应用
近来研究发现,HIT在控制体重和体脂、改善心血管机能、增加胰岛素敏感性和促进脂质代谢等方面效果较传统中低强度持续运动方式更理想,且运动时间较传统锻炼方式明显缩短。因此,HIT在肥胖症等慢性代谢性疾病防治中具有重要意义。
2.1 肥胖症
肥胖症既是一个独立的疾病,又可以继发多种复杂症候群,主要由长期高热能物质摄取、静止少动及其它降低机体代谢率的不良生活方式引起[7]。研究者分别以不同性别和年龄阶段的肥胖症人群为研
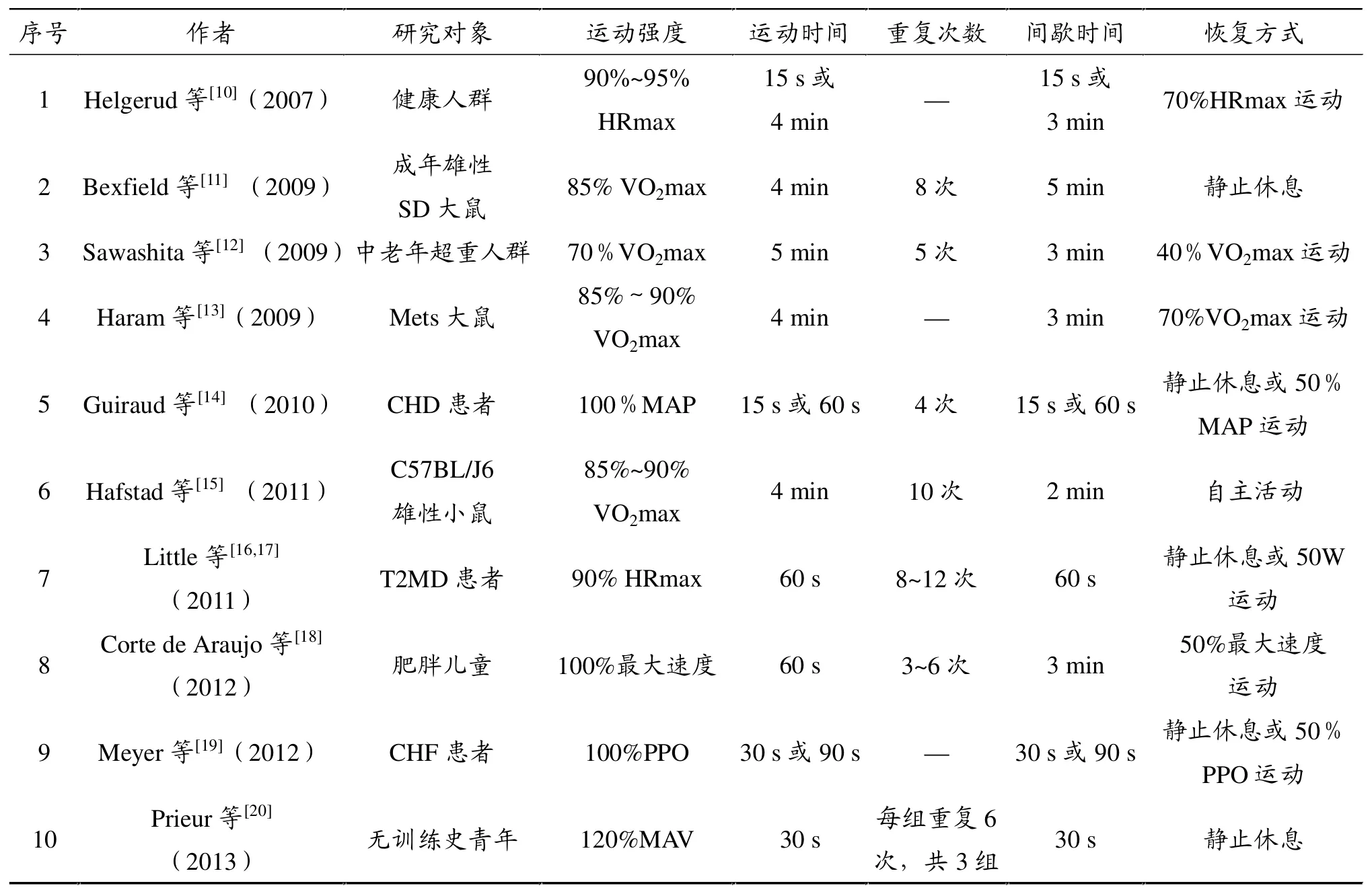
表1 HIT相关研究中各结构要素列表
究对象,采用HIT干预,认为该方式可以通过增加能量物质代谢,减少脂肪异常堆积,达到减体重和体脂的目的。Corte de Araujo等[18]研究持续运动和HIT对肥胖儿童形态和机能指标的影响,结果发现HIT和持续运动干预对VO2max、胰岛素敏感性的作用效果类似,但HIT明显降低体重和体重指数(BMI)。Tj nna等[21]对比研究HIT和多种生活方式干预(饮食、运动和心理干预)对14岁超重和肥胖青少年的影响,结果发现间歇运动方式对降低BMI、体脂%和平均动脉压(MAP),增加氧脉搏(VO2/HR)的效果较多种生活方式干预效果更明显。Whyte等[22]以超重和肥胖中青年男性为对象,进行2周HIT干预后,其胰岛素敏感性和安静时脂肪氧化率增加,收缩压和安静时糖氧化代谢率降低;同时,腰围(WC)和臀围(HC)明显减小。Gremeaux等[23]以中老年肥胖人群为研究对象,其结果与之类似。Coquart等[24]以肥胖女性人群为研究对象,结果显示间歇运动方式明显降低体重和BMI;同时,采用Borg主观体力感等级(RPE)量表评价参与者的主观疲劳感程度,发现间歇运动方式疲劳程度明显较低。目前,HIT在肥胖症啮齿动物模型干预中的研究还较少。Ribeiro等[25]以肥胖Wistar大鼠为研究对象,观察大强度间歇游泳训练和中等强度持续运动对体重、血乳酸的影响,结果显示HIT可增强有氧能力,减少大强度运动后乳酸堆积,但两种运动方式在体重控制方面的效果类似。因此,虽然各研究中研究对象、HIT运动方案不同,但普遍认为该运动方式可以改善超重或肥胖症人群及动物模型的形态学指标和机能状态,为疾病的治疗和预防提供较好的选择;同时,该运动方式带来的主观疲劳感较传统的长时间持续运动方式要低,为坚持运动锻炼提供了可行性。
2.2 心血管疾病
HPT、CHD、CHF等是肥胖症诱导的常见心血管疾病,研究认为HIT可改善机体的代谢功能;同时,在运动训练中对心肺功能有重要的促进作用,引起研究者在心血管疾病干预中的研究兴趣。Ciolac等[26]指出HIT可以有效地预防和控制HPT,主要与心肺功能、内皮细胞功能、胰岛素敏感性、交感神经活动及动脉血管弹性增加有关。Currie等[27]对比HIT和中等强度持续运动对CHD患者肱动脉血流介导的内皮舒张功能(FMD)、血管内径和血流速度等指标的影响,结果显示HIT和持续运动方式均增加患者血流调节能力,且作用效果相似;但HIT较持续运动方式的总能耗明显要低。Guiraud等[28]以稳定型CHD患者为干预对象,采用RPE量表评价发现,HIT引起的主观疲劳感程度较持续中等强度运动明显降低,且无心肌进一步损害。Hesse等[29]对社区居民中脑卒中患者进行HIT和持续运动干预,结果显示HIT对于中风后机能改善和减少跌倒次数效果更为明显。Nilsson、Freyssin等[30,31]以老年CHF患者为研究对象,观察HIT对机能状态(6 min运动距离)和生活质量的影响,结果显示HIT可明显增加患者亚极限运动能力,改善生活质量,且与机能状态呈正相关。针对冠状动脉重建术(CABG)患者的康复研究发现,HIT与持续中等强度运动短期增加VO2max的效果类似,但长期效果HIT较好[32]。 通过上述研究可以看出,HIT可以改善HPT、CHD等心血管疾病患者或高危人群的机能状态和生活质量。
2.3 II型糖尿病
胰岛素抵抗和胰岛β细胞功能异常是T2DM发病的重要环节,HIT可使机体胰岛素敏感性和胰岛β细胞功能明显增强。 Little等[16]研究发现,T2DM患者进行HIT干预2周后,血糖调节能力明显增强,表现为降低高血糖和餐后血糖浓度。同时,进行肌肉活检分析发现HIT明显增加骨骼肌代谢能力,有利于T2DM患者调控血糖水平。Gillen等[33]采用持续血糖监测法(CGM)监测24 h血糖变化,其研究结果与Little的一致。 Sriwijitkamol等[34]认为T2DM患者需通过较大的运动强度刺激达到干预效果,分析其与机体能量物质的转运和线粒体生物合成的分子生物学适应机制有关。有研究指出,当传统的耐力训练不具备减重效果时,无法纠正糖尿病前期患者葡萄糖和胰岛素代谢障碍[35]。 Terada等[9]对比研究HIT和中等强度持续运动在T2DM患者干预中的可行性和有效性,通过参与和坚持人数、主观感觉评价,以及采用糖化血红蛋白(HbA1c)和体脂百分比的变化进行分析,认为两种运动方式干预效果类似,均可有效降低患者体脂,但对HbA1c的作用较小。因此,HIT是预防和治疗T2DM的重要手段。
2.4 代谢综合征
Mets是指存在中心性肥胖、高血压、胰岛素抵抗、高脂血症与血糖调节障碍等一系列代谢调节紊乱的综合征象[14]。研究认为,运动与饮食等生活方式调节是Mets治疗的首要措施[13,36]。 Haram等[13]以大鼠Mets模型为研究对象,对比研究HIT和中等强度持续运动对各项代谢参数的影响,结果显示两种运动方式减体重和体脂的效果类似,但HIT明显增加VO2max和内皮功能,改善血压和组织代谢参数。大量研究证实,HIT可降低体重、减少内脏脂肪堆积与全身体脂含量、改善血管功能、调节糖脂代谢,因此对于预防Mets的发生和发展具有重要作用。
2.5 脂肪肝
脂肪肝尤其是非酒精性脂肪肝(NAFLD)是一种典型的营养代谢障碍性疾病,目前已发展成为最常见的肝病之一。运动干预可以增加全身组织能量代谢,从而促进肝脏中脂质的动员和利用,减少脂质在肝细胞中沉积。目前,长时间中低强度持续运动在脂肪肝的治疗研究中较为常见,而HIT在脂肪肝干预中的研究十分有限。Tsekouras等[37]研究指出HIT可以减少肝脏中极低密度脂蛋白甘油三酯(VLDL-TG)的分泌,改善血液和肝脏中脂质轮廓(脂质组成与含量)。Sene-Fiorese等[38]在高脂喂养期间进行相同运动时间的间歇运动和持续运动方式干预,结果显示间歇运动方式有助于改善脂质轮廓,降低体重和体脂,预防高脂喂养诱导的脂肪肝的形成。脂肪肝与肥胖症密切相关,脂肪肝往往伴随肥胖症治疗而得到改善和预防。
3 大强度间歇运动的干预机制分析
HIT对肥胖症及其相关慢性代谢性疾病具有积极干预作用,目前其作用机制尚不明确,现有文献主要围绕神经内分泌和外周组织代谢调节机制展开讨论。
3.1 神经内分泌代谢调节机制
神经内分泌系统在慢性病发生和运动干预中发挥重要作用,从进化论的观点来看,能量平衡的调节与神经生物应激理论有关;同时,机体的合成代谢和分解代谢必须在激素和酶的参与下完成。研究认为,肥胖症、Mets等病理生理变化与下丘脑-垂体-肾上腺轴(HPA轴)、交感肾上腺-髓质-免疫轴(SA轴)和自主神经系统(ANS)的活动密切相关[39,40]。运动干预作为一种应激源,作用于机体引起应答反应,表现为神经内分泌活动的变化。分析认为,HIT由于运动强度较高,引起机体较强的应激反应,如HPA轴激素、甲状腺素分泌增加,从而刺激脂肪分解代谢,也会导致机体静息代谢率增加。同时,由于HIT存在节奏变化的特点,可降低神经内分泌反应对持续运动所产生的耐受,有利于增加神经内分泌活动。有研究指出,HIT可以显著增加交感神经系统的兴奋性[26];Ormsbee等[40]研究认为10天HIT不足以引起自主神经系统功能、HPA轴活动、心理状态、体成分的变化。目前对于HIT与神经内分泌反应的量效关系并不清楚。在慢性病发生和运动干预过程中,神经内分泌系统相互协调和沟通,共同调节能量代谢和机体内稳态。
此外,脂肪组织被认为是机体重要的内分泌器官,脂联素是脂肪细胞分泌的特定的细胞因子和负性调节激素。研究发现Mets患者在进行HIT干预后,血液中脂联素含量增加,说明HIT促进脂肪细胞分泌水平增加[41]。脂联素可通过减少脂肪酸合成酶的基因转录,抑制肝内脂肪酸与胆固醇合成;同时,其可刺激肌肉摄取脂肪酸(FFA),并转运至线粒体参与氧化代谢,减少脂质异常沉积。因此,脂联素对于肥胖症及其相关代谢性疾病的代谢调节极为重要。
3.2 外周组织代谢调节机制
目前,针对HIT对慢性代谢性疾病的干预机制已开展了大量研究,普遍认为外周组织如脂肪组织、肝脏、骨骼肌等部位在能量代谢和稳态维持过程中发挥着重要的作用,尤其是在运动干预下各组织充分动员和利用储存的能量物质,改善组织局部和全身物质代谢。外周组织代谢紊乱与慢性代谢疾病的发生密切相关,为了维持正常生理功能,细胞内存在严格的代谢调节机制。
骨骼肌组织是糖代谢、脂肪酸氧化和胆固醇流出的重要部位,其代谢功能异常与慢性代谢性疾病的发生具有密切联系。在运动干预下,骨骼肌大量转运、动员、利用能量物质,以满足运动时和恢复期能量的消耗,从而改善或逆转慢性代谢性疾病的机能状态。 早在1993年,Criswell等[42]对比分析HIT和中等强度持续运动方式干预下,大鼠腓肠肌和比目鱼肌中β-羟基乙酰辅酶A脱氢酶(HADH)和琥珀酸脱氢酶(SDH)活性变化,两种运动方式组间无差异。但HIT组比目鱼肌中谷胱甘肽过氧化物(GPX)活性明显高于持续运动组。研究者围绕骨骼肌中各种代谢调节酶、转录调节因子或相关功能蛋白的变化展开讨论。 Tj nna 等[41]、Gibala等[8,43]分析认为HIT使骨骼肌细胞内ATP/ADP/AMP的比例发生剧烈变化以及活性氧簇 (ROS)反应性增加,激活细胞质中p38 MAPK和AMPK,诱导过氧化物酶体增殖物激活受体γ共激活因子(PGC-1α)表达上调,进一步激活代谢调节基因,增加糖和脂肪酸氧化、线粒体生物合成和Ca2+重新摄取进入肌浆网(SR)。 Little等[44]的研究结论与之一致,但目前HIT激活PGC-1α和线粒体生物合成的上游信号通路的分子机制并不完全清楚。Koshinaka等[45]研究认为,虽然HIT较低强度运动明显增加AMPK活性,但其胰岛素敏感性反而较低强度持续运动方式低,说明AMPK并不是促进运动后胰岛素敏感性增加的唯一机制。Little等[46]研究显示健康男性进行HIT干预后股直肌中柠檬酸合成酶(CS)、细胞色素C氧化酶(COX)和线粒体转录因子(Tfam)活性增加,PGC1α及线粒体生物合成激活因子SIRT1表达上调;同时,骨骼肌中糖原和葡萄糖转运蛋白4(GLUT-4)含量增加。这说明HIT可通过增加骨骼肌线粒体生物合成而促进组织中糖脂代谢。Burgomaster等[47]报道指出训练后骨骼肌糖原和PCr利用率下降,机体碳水化合物利用整体下降而脂质氧化率增加。Carnevali等[48]通过研究发现HIT明显增加骨骼肌肉碱棕榈酰转移酶(CPTI、CPTII)和CS的表达,同时脂肪酸结合蛋白(FABP)、脂蛋白酯酶(LPL)表达上调。因此HIT有效降体重和改善脂质代谢,与线粒体脂肪酸转运能力增强有关,可促进骨骼肌中脂质氧化代谢。Prieur等[20]采用近红外光谱检测技术(NIRS)连续监测HIT运动过程中锻炼人群股直肌还原血红蛋白(HHb)和血容量的变化(Hbtot),结果显示HIT改变了递增强度运动过程中HHb的代谢轮廓,组织摄取氧的能力增加。此外,有研究指出HIT能迅速刺激骨骼肌重塑,与骨骼肌纤维的转化有关,尤其是刺激I型和IIx型纤维向IIa型纤维的转化。肌纤维快速收缩时,激发物质与能量代谢通路中的多种激酶,包括AMPK、钙调蛋白激酶Ⅱ(CaMKⅡ)和丝裂原活化蛋白激酶(MAPK)[49];分析其也可能与线粒体增生和ROS释放增加有关。这些信号通路在线粒体生物合成和代谢过程中发挥关键作用。但不同的运动方式可能存在针对不同纤维类型的特定信号分子适应机制。Cocks等[50]采用定量荧光显微镜分析HIT干预后骨骼肌微血管内皮中eNOS、eNOS丝氨酸1177(eNOS-Ser1177)的磷酸化水平和毛细血管数量,结果显示HIT可降低动脉硬化程度,增加骨骼肌微血管密度和eNOS含量,同时提高胰岛素敏感性。此外,研究者根据恢复能力的变化进行了研究,Forbes等[51]利用31P-MRS技术在体检测股四头肌高能磷酸物质和细胞内PH值,建立单指数模型计算PCr恢复时,以反映组织的氧化代谢能力,结果显示HIT干预后恢复时间明显缩短,说明其为增加骨骼肌氧化能力的有效手段。虽然目前对于HIT引起骨骼肌代谢适应性变化的机制并不十分清楚,但从现有分析来看主要与HIT干预引起的糖脂代谢酶学、转录调节因子和相关功能蛋白表达变化密切相关;同时,还可能与组织利用氧的能力、线粒体增生、骨骼肌纤维类型的转化有关。
脂肪组织和肝脏是能量储存的重要器官,也是能量代谢的重要部位。Haram等[13]研究发现HIT改善Mets大鼠脂肪组织、肝脏等部位代谢率,增加组织内一氧化氮合酶(NOS)、细胞膜穴样内陷密度,且其表达存在明显的强度依赖性。Leggate等[52]采用蛋白组学方法发现HIT后脂肪组织中脂肪酸合成率下降,减少超重和肥胖人群脂肪堆积。Tsekouras等[37]指出HIT可明显减少肝脏中VLDL-TG的分泌,降低血液中VLDL-TG的含量。 Bexfield等[11]对SD大鼠进行HIT干预,肝脏白蛋白含量显著增加,分析认为HIT增加机体代谢适应性变化与肝脏白蛋白含量上升有关,有助于促进能量物质转运。此外,还有研究发现HIT可以通过增强胰岛β细胞功能,增加胰岛素敏感性[41]。目前围绕脂肪组织和肝脏开展的机制研究较少。通过对外周组织代谢调节机制分析认为,肝脏、脂肪组织、骨骼肌等部位相互协同,共同调节机体的能量代谢。HIT可以通过增加局部组织毛细血管密度和细胞内线粒体含量,上调代谢调节酶、转录调节因子和相关功能蛋白的表达,促进组织中能量物质的动员、转运和利用,维持机体能量稳态,可能是HIT干预慢性病的重要调节机制。
4 大强度间歇运动在实践应用中的医务监督
在慢性病干预过程中设计合理的HIT运动方案,在运动医务监督下进行科学锻炼,是促进健康、预防伤病发生的重要环节。现有研究中运动方案的设计存在较大差异,所以较难进行干预效果的横向比较,甚至在部分要素选择上存在一定冲突,因此不利于运动实践推广。 Ben Abderrahman等[53]通过对比HIT干预下不同恢复方式对各机能指标的影响发现,积极恢复方式可以显著增加VO2max并延长运动时间。Meyer等[19]通过对比四种不同组合形式的HIT对CHF患者的影响,认为消极恢复方式对CHF患者更有利。由此可见,在恢复手段的选择上研究结果存在较大争议。由于HIT结构要素多,较传统耐力训练方式复杂,大众锻炼人群选择合适的组合方式较难,必须在专业人员指导下完成。HIT由于运动强度高,应激反应较强,实施不当可能产生不良效应。与此同时,慢性病患者承受运动负荷和生理负荷的能力较健康人群低,在执行运动计划前必须进行身体机能评定,运动强度的安排需遵守个体化原则,即按照个体能承受的最大运动强度比例安排。同时,在计划执行期间需要进行科学指导和加强运动医务监督[54]。
5 小结与展望
HIT是一种具有较高时效性的锻炼方式,利用较短的时间可达到与传统长时间中低强度持续运动方式一样甚至更好的锻炼效果。不容忽视的是,HIT存在运动形式的变化,不会引起锻炼者明显的枯燥感,利于运动锻炼的长久坚持。大量研究证实,HIT可以预防或治疗肥胖症、T2DM、Mets等慢性代谢性疾病,主要通过神经内分泌机制与外周组织代谢调控机制发挥作用,共同调节机体整体或组织局部物质代谢和能量稳态,改善或逆转患者的机能状态,提高其健康水平。同时,HIT结构因素较多、组合方式复杂以及相对运动强度较高,在体育锻炼实践中需加强指导和运动医务监督。
在运动锻炼实践中,不同的HIT运动方案由于结构要素的变化,可能产生不同的刺激效应,但具体各要素与干预效果的量效关系仍不清楚,这给运动实践指导带来困难;同时,由于干预对象年龄、性别、疾病类型等不同,在各结构要素的安排上是否存在特定的规律,目前并无系统研究。在临床康复和运动实践中,HIT干预的应用并不十分广泛。重要的原因是,目前尚缺乏可针对不同慢性病进行大强度间歇运动干预的运动处方。因此,探索HIT各要素与干预效果的量效关系,并针对不同人群制定合适的尤其是个体化的运动处方,是HIT干预研究的重点,也是该领域亟待解决的关键问题。此外,现有机制研究中主要集中探讨骨骼肌代谢调节理论,对中枢调节机制和其它部位代谢调控研究较少,尤其是不同组织部位的交联对话机制对整体代谢调节的影响。进一步探索HIT干预的局部与整体作用的分子生物学机制,将是该领域研究的理论基点和前沿课题。
[1]Popkin BM.Is the obesity epidemic a national security issue around the globe?Curr Opin Endocrinol Diabetes Obes,2011,18(5):328-331.
[2]Popkin BM.Economists’insights into the obesity crisis.Trends Endocrinol Metab,2009,20(9):417.
[3]Malik VS,Willett WC,Hu FB.Global obesity:trends,risk factors and policy implications.Nat Rev Endocrinol,2012,9(1):13-27.
[4]Dan’ko IuI.Exercise therapy as a means of restoring homeostasis.Vopr Kurortol Lech Fiz Kult,1968,33 (2):105-108.
[5]Karelis AD.Metabolically healthy but obese individuals.The Lancet,2008,372(9646):1281-1283.
[6]Schwartz MW,Porte DJ.Diabetes,obesity,and the brain.Science,2005,307(5708):375-379.
[7]Ng SW,Popkin BM.Time use and physical activity:a shift away from movement across the globe.Obes Rev,2012,13(8):659-680.
[8]Gibala MJ,Little JP,Macdonald MJ,et al.Physiological adaptations to low-volume,high-intensity interval training in health and disease.J Physiol,2012,590 (Pt 5):1077-1084.
[9]Terada T,Friesen A,Chahal BS,et al.Feasibility and preliminary efficacy of high intensity interval training in type 2 diabetes.Diabetes Res Clin Pract,2013,99 (2):120-129.
[10]Helgerud J,Hoydal K,Wang E,et al.Aerobic highintensity intervals improve VO2max more than moderate training.Med Sci Sports Exerc,2007,39(4):665-671.
[11]Bexfield NA,Parcell AC,Nelson WB,et al.Adaptations to high-intensity intermittent exercise in rodents.J Appl Physiol,2009,107(3):749-754.
[12]Sawashita J,Onitsuka S,Gen-no H,et al.Effects of mild calorie restriction and high-intensity interval walking in middle-aged and older overweight Japanese.Exp Gerontol,2009,44(10):666-675.
[13]Haram PM,Kemi OJ,Lee SJ,et al.Aerobic interval training vs.continuous moderate exercise in the metabolic syndrome of rats artificially selected for low aerobic capacity.Cardiovasc Res,2009,81(4):723-732.
[14]Guiraud T,Juneau M,Nigam A,et al.Optimization of high intensity interval exercise in coronary heart disease.Eur J Appl Physiol,2010,108(4):733-740.
[15]Hafstad AD,Boardman NT,Lund J,et al.High intensity interval training alters substrate utilization and reduces oxygen consumption in the heart.J Appl Physiol,2011,111(5):1235-1241.
[16]Little JP,Gillen JB,Percival ME,et al.Low-volume highintensity interval training reduces hyperglycemia and increases muscle mitochondrial capacity in patients with type 2 diabetes.J Appl Physiol,2011,111 (6):1554-1560.
[17]Gillen J,Little J,Punthakee Z,et al.Acute high-intensity interval exercise reduces the postprandial glucose response and prevalence of hyperglycaemia in patients with type 2 diabetes.Diabetes Obes Metab,2012,14(6):575-577.
[18]Corte de Araujo AC,Roschel H,Picanco AR,et al.Similar health benefits of endurance and high-intensity interval training in obese children.PLoS One,2012,7(8):e42747.
[19]Meyer P,Normandin E,Gayda M,et al.High-intensity interval exercise in chronic heart failure:protocol optimization.J Card Fail,2012,18(2):126-133.
[20]Prieur F,Mucci P.Effect of high-intensity interval training on the profile of muscle deoxygenation heterogeneity during incremental exercise.Eur J Appl Physiol,2013,113(1):249-257.
[21]Tj nna AE,Stolen TO,Bye A,et al.Aerobic interval training reduces cardiovascular risk factors more than a multitreatment approach in overweight adolescents.Clin Sci(Lond),2009,116(4):317-326.
[22]Whyte L,Gill J,Cathcart A.Effect of 2 weeks of sprint interval training on health-related outcomes in sedentary overweightobese men.Metabolism,2010,59 (10):1421-1428.
[23]Gremeaux V,Drigny J,Nigam A,et al.Long-term lifestyle intervention with optimized high-intensity interval training improves body composition,cardiometabolic risk,and exercise parameters in patients with abdominal obesity.Am J Phys Med Rehabil,2012,91(11):941-950.
[24]Coquart J,Lemaire C,Dubart A,et al.Intermittent versus continuous exercise effects of perceptually lower exercise in obese women.Med Sci Sports Exerc,2008,40 (8):1546-1553.
[25]Ribeiro BL,deMello M,Gobatto C.Continuous and intermittent exercise effects of training and detraining on body fat in obese rats.Arch Latinoam Nutr,2004,54(1):58-65.
[26]Ciolac EG.High-intensity interval training and hypertension:maximizing the benefits of exercise?Am J Cardiovasc Dis,2012,2(2):102-110.
[27]Currie K,McKelvie R,Macdonald M.Flow-mediated dilation is acutely improved following high-intensity interval exercise.Med Sci Sports Exerc,2012,44(11):2057-2064.
[28]Guiraud T,Nigam A,Juneau M,et al.Acute responses to high-intensity intermittent exercise in CHD patients.Med Sci Sports Exerc,2011,43(2):211-217.
[29]Hesse S,Welz A,Werner C,et al.Comparison of an intermittent high-intensity vs continuous low-intensity physiotherapy service over 12 months in communitydwelling people with stroke:a randomized trial.Clin Rehabil,2011,25(2):146-156.
[30]Nilsson BB,Westheim A,Risberg MA.Long-term effects of a group-based high-intensity aerobic interval-training program in patients with chronic heart failure.Am J Cardiol,2008,102(9):1220-1224.
[31]Freyssin C,Verkindt C,Prieur F,et al. Cardiac rehabilitation in chronic heart failure:effect of an 8-week,high-intensity interval training versus continuous training.Arch Phys Med Rehabil,2012,93(8):1359-1364.
[32]Munk P,Staal E,Butt N,et al.High-intensity interval training may reduce instent restenosis following percutaneous coronary intervention with stent implantation A randomized controlled trial evaluating the relationship to endothelial function and inflammation.Am Heart J,2009,158(5):734-741.
[33]Gillen J,Little J,Punthakee Z,et al.Acute high-intensity interval exercise reduces the postprandial glucose response and prevalence of hyperglycaemia in patients with type 2 diabetes.Diabetes Obes Metab,2012 14(6):575-577.
[34]Sriwijitkamol A,Coletta DK,Wajcberg E,et al.Effect of acute exercise on AMPK signaling in skeletal muscle of subjects with type 2 diabetes:a time-course and doseresponse study.Diabetes,2007,56(3):836-848.
[35]Jenkins NT,Hagberg JM.Aerobic training effects on glucose tolerance in prediabetic and normoglycemic humans.Med Sci Sports Exerc,2011,43(12):2231-2240.
[36]Kessler H,Sisson S,Short K.The potential for highintensity interval training to reduce cardiometabolic disease risk.Sports Med,2012,42(6):489-509.
[37]Tsekouras YE,Magkos F,Kellas Y,et al.High-intensity interval aerobic training reduces hepatic very low-density lipoprotein-triglyceride secretion rate in men.Am J Physiol Endocrinol Metab,2008,295(4):E851-858.
[38]Sene-Fiorese M,Duarte FO,Scarmagnani FR,et al.Efficiency of intermittent exercise on adiposity and fatty liver in rats fed with high-fat diet.Obesity,2008,16(10):2217-2222.
[39]Auvinen HE,Romijn JA,Biermasz NR,et al.Effects of high fat diet on the Basal activity of the hypothalamuspituitary-adrenal axis in mice:a systematic review.Horm Metab Res,2011,43(13):899-906.
[40]Ormsbee MJ,Kinsey AW,Chong M,et al.Short-term high-intensity interval training and the physiological stress response.Med Sci Sports Exerc,2011,43 (5):905-906.
[41]Tj nna AE,Lee SJ,Rognmo O,et al.Aerobic interval training versus continuous moderate exercise as a treatment for the metabolic syndrome:a pilot study.Circulation,2008,118(4):346-354.
[42]Criswell D,Powers S,Dodd S,et al.High intensity training-induced changes in skeletal muscle antioxidant enzyme activity.Med Sci Sports Exerc,1993,25 (10):1135-1140.
[43]Gibala MJ,McGee SL,Garnham AP,et al.Brief intense interval exercise activates AMPK and p38 MAPK signaling and increases the expression of PGC-1alpha in human skeletal muscle.J Appl Physiol,2009,106 (3):929-934.
[44]Little JP,Safdar A,Bishop D,et al.An acute bout of high-intensity interval training increases the nuclear abundance of PGC-1α and activates mitochondrial biogenesis in human skeletal muscle.Am J Physiol Regul Integr Comp Physiol,2011,300(6):R1303-1310.
[45]Koshinaka K,Sano A,Howlett KF,et al.Effect of highintensity intermittent swimming on postexercise insulin sensitivity in rat epitrochlearis muscle.Metabolism,2008,57(6):749-756.
[46]Little JP,Safdar A,Wilkin GP,et al.A practical model of low-volume high-intensity interval training induces mitochondrial biogenesis in human skeletal muscle:potential mechanisms.J Physiol,2010,588(Pt 6):1011-1022.
[47]Burgomaster KA,Howarth KR,Phillips SM,et al.Similar metabolic adaptations during exercise after low volume sprint interval and traditional endurance training in humans.J Physiol,2008,586(1):151-160.
[48]Carnevali LC Jr,Eder R,Lira FS,et al.Effects of highintensity intermittent training on carnitine palmitoyl transferase activity in the gastrocnemius muscle of rats.Braz J Med Biol Res,2012,45(8):777-783.
[49]Gibala MJ.High-intensity interval training:a timeefficient strategy for health promotion?Curr Sports Med Rep,2007,6(4):211-213.
[50]Cocks M,Shaw CS,Shepherd SO,et al.High intensity interval and endurance training are equally effective in increasing muscle microvascular density and eNOS content in sedentary males.J Physiol,2013,591 (Pt 3):641-656.
[51]Forbes SC,Slade JM,Meyer RA.Short-term highintensity interval training improves phosphocreatine recovery kinetics following moderate-intensity exercise in humans.Appl Physiol Nutr Metab,2008,33 (6):1124-1131.
[52]Leggate M,Carter WG,Evans MJ,et al.Determination of inflammatory and prominent proteomic changes in plasma and adipose tissue after high-intensity intermittent training in overweight and obese males.J Appl Physiol,2012,112(8):1353-1360.
[53]Ben Abderrahman A,Zouhal H,Chamari K,et al.Effects of recovery mode (active vs.passive) on performance during a short high-intensity interval training program:a longitudinal study.Eur J Appl Physiol,2013,113 (6):1373-1383.
[54]Shiraev T,Barclay G.Evidence based exercise-Clinical benefits of high intensity interval training.Aust Fam Physician,2012,41(12):960-962.
