姜黄素对人宫颈癌细胞株Hela细胞增殖的作用的研究以及p53表达的影响*
2013-11-16姜智慧陆晓媛周健
姜智慧 陆晓媛 周健
姜黄素(Curcumin)是一种酚类化合物,提取自姜科姜黄属植物姜黄(Curcumalonga)的根茎中,是中药姜黄的主要成份。国内外的科学研究表明,姜黄素具有具有抗炎、抗氧化、保肝、保护心脏、预防血栓和抗肿瘤的多种生物学效应[1-4]。姜黄素可以调节多种肿瘤相关的细胞因子及通路达到抗肿瘤的作用,对宫颈癌细胞具有一定的细胞毒作用[5]。但是有关姜黄素对宫颈癌细胞体外作用的相关机制仍有待研究。本文主要探讨姜黄素对人类宫颈癌Hela细胞的相关作用,检测p53蛋白的表达情况,为姜黄素防治宫颈癌提供新的依据。
1 材料与方法
1.1 细胞 人宫颈癌Hela细胞株(中国医学科学院血液病研究中所惠赠)。
1.2 主要试剂 姜黄素、二甲基亚砜(DMSO)、MTT购自美国Singma公司;胎牛血清购自杭州四季青生物工程材料有限公司;DMEM高糖型购自美国Gibco公司;RT-PCR 反应试剂盒北京天根生化科技有限公司;高纯总RNA快速提取试剂盒(RTL-离心柱型)购自上海锐捷生物工程有限公司;蛋白提取试剂盒购自上海碧云天生物技术有限公司;p53抗体购自美国Bioworld Technology公司;鼠抗β-actin抗体北京中杉金桥生物技术有限公司。
1.3 细胞培养 宫颈癌Hela细胞株采用加入100 mg/L 链霉素和100 U/L 青霉素各1 ml的DMEM培养液,置于 37℃、5%CO2饱和湿度的培养箱中培养,待细胞长至体积占细胞瓶体积比约 95%时,按1:2~3比例传代。取细胞生长良好,活性大于98%的细胞进行后续试验。
1.4 姜黄素对Hela细胞增殖影响的检测 用MTT法检测姜黄素对Hela细胞增殖影响。用含有10%胎牛血清的DMEM培养液将的Hela细胞配成 1×105/ml的悬液,在96孔板中加入 100μl细胞悬液,设5个平行孔。实验组加入不同浓度的姜黄素使其最终浓度为5、10、20、30、40、50μmol/L,同时设置对照组,分别培养12、24、48 h。培养结束后加入MTT(5 mg/L)20μl继续培养4 h,小心吸出孔内上清液100 μl,每空加入DMSO150 μl,震荡使结晶充分溶解,酶标仪测定读取Hela细胞的A490值,并按下述公式计算细胞增殖抑制率,重复实验3次以上。抑制率(%)=(1-给药组 A490值/对照组A490值)×100%。
1.5 姜黄素对人宫颈癌Hela细胞细胞中p53基因 mRNA 转录水平表达的影响的检测 用RT-PCR法检测细胞中p53基因 mRNA 转录表达水平。收集姜黄素最终浓度为0、10、20、30、40 μmol/L的24 h Hela细胞为样本。用离心柱法提取总的RNA,根据紫外分光光度计260nm处的吸光度值测定RNA的纯度,并进行RNA的定量配成相同浓度的RNA,取1 μg总RNA进行逆转录,以cDNA为模板,进行PCR。引物由上海生工生物工程有限公司设计合成见表1。p53基因扩增的反应条件为:94℃预变性5 min;94℃变性30 s;58℃退火30 s;72℃延伸1 min;循环36次;72℃再延伸10 min。β-actin 反应条件为:94℃预变性5 min;94℃变性30 s;63℃退火30 s;72℃延伸1 min;循环36次;72℃再延伸10 min。PCR 产物经 1.5%琼脂糖凝胶电泳分析,凝胶成像系统保存图像,重复实验3次后,Quantity One 系统进行灰度分析。见表1。

表1 各基因PCR 反应的引物序列
1.6 姜黄素对人宫颈癌Hela细胞中p53蛋白含量表达的影响的检测 姜黄素对人宫颈癌Hela细胞细胞中p53蛋白水平表达的影响的检测用Western blotting法检测细胞中p53蛋白表达水平。收集姜黄素最终浓度为0、10、20、30、40 μmol/L的24 h三个时段Hela细胞为样本。用RIPA细胞裂解液裂解细胞,蛋白提取试剂盒提取蛋BCA法进行蛋白定量,将所有蛋白样品调至等浓度。取25 μl蛋白样品,聚丙烯酰胺凝胶电泳,经 SDS-PAGE分离后,电转移至 PVDF膜上, 常规步骤封闭、洗膜后加入1∶1 000 稀释的兔抗人p53抗体;1∶1000 稀释的鼠抗β-actin 抗体,4℃冰箱放置孵育过夜;TBST洗涤,加入1∶500 稀释的HRP 标记的山羊抗兔/小鼠 IgG,室温孵育2 h;ECL 底物化学发光显色后曝光显影,通过 Bio-rad 化学发光成像系统进行曝光分析。
1.7 统计学处理 应用SPSS 16.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,多组数据间比较采用方差分析,组间两两比较采用q检验,各变量之间的关系采用直线相关分析,以P<0.05为差异有统计学意义。
2 结果
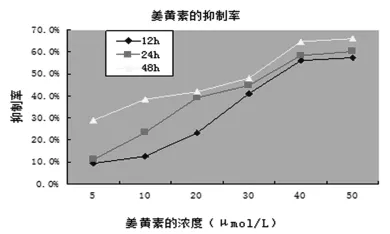
图1 不同浓度姜黄素对人类宫颈癌Hela细胞的抑制率
2.1 姜黄素对人类宫颈癌Hela细胞增殖的影响 MTT检测结果显示,于对照组相比,浓度为5 μmol/L的姜黄素对Hela细胞增殖的抑制作用不明显;浓度大于10 μmol/L时抑制作用明显;当浓度达到40 μmol/L时抑制作用最为显著;但当浓度达到50 μmol/L时抑制作用增加不明显。试验表明经不同浓度姜黄素处理不同时间后,Hela细胞的增殖均受到明显抑制,抑制率见表2,差异有统计学意义(P<0. 05)。表明姜黄素对人宫颈癌Hela细胞的增殖具有抑制作用,且呈剂量-时间依赖性。见图1。
表2 姜黄素对人宫颈癌Hela细胞的抑制率(±s)

表2 姜黄素对人宫颈癌Hela细胞的抑制率(±s)
*与对照组相比, P<0.05
组别 12 h 24 h 48 h对照组 0.030±0.001 0.029±0.040 0.110 0.022* 0.129±0.010* 0.290 0.001* 0.254±0.029* 0.396?±0.149 5 μmol/L 0.093± ±0.010*10 μmol/L 0.125± ±0.144*20 μmol/L 0.230±0.002* 0.394±0.006* 0.416±0.008*30 μmol/L 0.442±0.021* 0.455±0.013* 0.481±0.007*40 μmol/L 0.559±0.016* 0.580±0.018* 0.647±0.007*50 μmol/L 0.573±0.004* 0.583±0.011* 0.681±0.027*
2.2 姜黄素对人宫颈癌Hela细胞细胞中p53基因 mRNA 转录水平表达的影响的检测 取0、10、20、30、40 μmol/L姜黄素作用人宫颈癌Hela细胞24 h后,RT-PCR得到的p53 mRNA电泳条带见图2,条带经Quantity One 软件后发现,姜黄素作用后的Hela细胞中p53基因mRNA转录和表达水平随着药物浓度的增加和作用时间的延长而显著增加,灰度值见表3。与对照组相比,差异具有统计学意义(P<0.05)。
表3 不同浓度姜黄素作用24 h时p53 mRNA/β-actin相对灰度比值的情况(±s)

表3 不同浓度姜黄素作用24 h时p53 mRNA/β-actin相对灰度比值的情况(±s)
*与对照组相比, P<0.05
姜黄素浓度(μmol/L) p53mRNA/β-actin相对灰度比值0 0.427±0.005 10 0.479±0.004*20 0.537±0.007*30 0.605±0.006*40 0.655±0.007*

图2 不同浓度姜黄素作用24 h后p53 mRNA的表达
2.3 姜黄素对人宫颈癌Hela细胞中p53蛋白含量表达的影响的检测 取0、10、20、30、40 μmol/L姜黄素作用人宫颈癌Hela细胞作用24 h后,用Western blotting测得p53蛋白的表达随着姜黄素浓度的增加而增多,差异具有统计学意义(P<0.05),见图3。

图3 不同浓度姜黄素作用24 h后p53蛋白的表达情况
3 讨论
姜黄是是天然存在的多酚类化合物,一种常用中药,其主要成分姜黄素被用于食品行业作为食品添加剂,又因其为黄色的粉末,被染料业广泛应用。姜黄素曾经被传统的印度医生用来治疗厌食症,鼻炎、咳嗽,鼻窦炎、肝损害[6-7]。近年来,姜黄素由于抗肿瘤的活性引起了国内外学者的广泛的关注。单独应用姜黄素时发现,姜黄素有着抗肿瘤活性,同时具有抑制肿瘤转移和侵袭的作用[8-9]。姜黄素对体外培养的白血病细胞、乳腺癌细胞、大肠癌细胞、肝癌细胞和卵巢癌细胞均有抑制增殖及诱导凋亡作用[10],对表皮生长因子的促增殖作用有一定的拮抗效果[11]。还能抑制实验动物模型中多种肿瘤的发生[12],并且能缩肿瘤大小,显著减少肿瘤数目,降低肺转移及淋巴转移。试验表明姜黄素能够抑调节肿瘤发病的相关基因,对肿瘤生长的的3个阶段即:启动期,加速期,对数期都有一定的抑制作用[13]。因此,姜黄素是目前化学预防和治疗肿瘤研究的热点之一,有望成为一种具有广泛应用前景的抗癌新药。
随着化疗药物的使用,其毒副作用也不可忽视,如脱发、电解质紊乱、口腔黏膜溃疡和白细胞数降、恶心、腹泻等。同时肿瘤细胞对化疗药物的耐药性也逐渐加强,姜黄素是唯一未见任何毒副作用报道的抗肿瘤药物。姜黄素可以减少化疗药物对正常细胞的伤害,从而降低药物的毒副作用,且有一定的化疗增敏作用[14]。在联合应用姜黄素和奥沙利铂的体外试验中时发现,姜黄素在明显提高奥沙利铂抗肿瘤作用的同时,还可以降低肿瘤细胞对奥沙利铂的耐药性[15]。在肝癌细胞的体外实验中,姜黄素分别于顺铂及阿霉素联合应用,结果显示姜黄素与顺铂联合的效果较好,并且可以下调c-IAP、Bcl-xl、c-myc、NAIP 和 XIAP等细胞因子,诱导细胞凋亡[16]。姜黄素同时体内外的宫颈癌细胞具有一定的抑制及诱导凋亡的作用[17-18]。本文以人宫颈癌Hela细胞为标本,加入不同浓度姜黄素后发现,姜黄素对Hela细胞有着一定的抑制作用,且呈时间-浓度依赖性,不同组别之间两两比较,差异有统计学意义(P<0.05)。加入姜黄素后的宫颈癌Hela细胞,从正常的长梭状,逐渐缩小、变成圆形,同时核固缩,核碎裂逐渐增多。
野生型p53基因(wtp53)是重要的抑癌基因之一,位于17号染色体短臂,编码53kD核磷酸蛋白,p53蛋白通过调节相关蛋白参与细胞周期调控,阻止细胞从G期进入S期扩增,对细胞分裂及增殖起负调节作用。但是在体内外致癌因素作用下,p53可发生突变,导致wtp53丧失功能成为变异性p53。突变的p53具有致癌的特性,它失去对细胞的抗凋亡能力,对细胞的过度增殖达不到阻滞作用,这就导致细胞在致癌因素的刺激诱导下可以无限制的增殖,发展成为肿瘤。对于p53的相关研究认识后,学者们开发研究出一中抗癌新药:重组人p53腺病毒注射液。临床研究表明,单独或者联合应用重组人p53腺病毒对胃癌[19]、肝癌[70]、宫颈癌[21]、恶性腹水[22]等,有着较为明显的治疗效果。本论文主要研究不同浓度姜黄素作用下人宫颈癌Hela细胞中p53基因表达的情况的表达情况。取姜黄素浓度为0、10、20、30、40μmol/L作用24 h的Hela细胞为样本,测样本中p53mRNA的含量,结果可见随着浓度的增加p53mRNA的含量逐渐增加;Western blotting结果显示,随着姜黄素浓度的增加p53蛋白含量明显增加。可见姜黄素可能通过诱导抑癌基因p53的表达,导致p53蛋白含量的增加,促进癌细胞的凋亡,从而达到抑制宫颈癌Hela细胞的作用。
[1]Anand P, Sundaram C, Jhurani S, et al. Curcumin and cancer: An“old-age” disease with an “age-old” solution[J]. Cancer Lett, 2008,267(1): 133-164.
[2]Anand P, Thomas SG, Kunnumakkara AB, et al. Biological activities of curcumin and its analogues (congeners) made by man and Mother Nature[J]. Biochem Pharmacol, 2008, 76(11): 1590-1611.
[3]Aggarwal BB, Harikumar KB. Potential therapeutic effects of curcumin, the anti-inflammatory agent, against neurodegenerative,cardiovascular, pulmonary, metabolic, autoimmune and neoplastic diseases[J]. Int J Biochem Cell Biol, 2009,41(1):40-59.
[4]Srivastava RM, Singh S, Dubey SK, et al. Immunomodulatory and therapeutic activity of curcumin[J]. Int Immunopharmacol, 2011,11(3):331-341.
[5]35. Notarbartolo M, Poma P, Perri D, et al. Antitumor effects of curcumin, alone or in combination with cisplatin or doxorubicin, on human hepatic cancer cells. Analysis of their possible relationship to changes in NF-kB activation levels and in IAP gene expression[J].Cancer Lett,2005, 224(1): 53-65.
[6]Rahman I, Biswas SK, and Kirkham PA.Regulation of in?ammation and redox signaling by dietary polyphenols[J]. Biochem Pharmacol ,2006,72: 1439-1452.
[7]Tirkey N,Kaur G,Vij G,and Chopra K.Curcumin,a diferuloylmethane, attenuates cyclosporine-induced renal dysfunction and oxidative stress in rat kidneys [J].BMC Pharmacol ,2005, 15:20.
[8]Aggarwal BB, Kumar A. Bharti AC. Anticancer potential of cuecumin :preclinical and clinical studies[J].Anticancer Res,2003,23(1A):363-398.
[9]余俚瑶,张庆华.姜黄素抑制宫颈癌HeLa细胞增殖的机制[J].肿瘤防治研究,2011,38(8):899-902.
[10]曹泽毅.子宫颈癌治疗的变迁和思考[J].现代妇产科进展,2005,14(1):1-5.
[11]Reuter S,Eifes S,Dicato M,et a1.Modulation of anti-apoptotic and survival pathways by curcumm as a stramgy to induce apoptosis in cancel cells[J].Bioehem Pharmaeol,2008,76(11):1340-1351.
[12]许刚,黄文姜.黄素防治肿瘤的机制研究进展[J].国外医学生理病理科学与临床分册,2003,23(2):152-154.
[13]Singh S and Khar A. Biological effects of curcumin and its role in cancer chemoprevention and therapy[J]. Anticancer Agents Med Chem,2006,6: 259-270.
[14]Ajay Goel ,Bharat B, Aggarwa. Curcumin, the Golden Spice From Indian Saffron, Is a Chemosensitizer and Radiosensitizer for Tumors and Chemoprotector and Radioprotector for Normal Organs[J].Nutrition and Cancer, 2010,62(7), 919-930.
[15]Howells LM, Mitra A, and Manson MM. Comparison of oxaliplatinand curcumin-mediated antiproliferative effects in colorectal cell lines[J].Cancer ,2007,10(2):40.
[16]Notarbartolo M, Poma P, Perri D, et al. Antitumor effects of curcumin, alone or in combination with cisplatin or doxorubicin, on human hepatic cancer cells: analysis of their possible relationship to changes in NF-kB activation levels and in IAP gene expression[J].Cancer Lett ,2005,224:53-65.
[17]Zhao J, Zhao Y. Effects of curcumin on proliferation and apoptosis of human cervical carcinoma Hela cells invitro[J].Chinese Journal of Cancer Research,2004,16(3):225-228.
[18]Zhao J ,Zhao Y, Zhang Y, et al. Anti-tumor effect of curcumin on human cervical carcinoma Hela cells in vitro and in vivo [J].Chinese Journal of CancerResearch,2007,19(1):32-36.
[19]Xie YS, Zhang YH,Liu SP, et al.Synergistic gastric cancer inhibition by chemogenetherapy with recombinant humanadenovirus p53 and epirubicin: an in vitro and in vivo study[J]. Oncol Rep,2010,24(6):1613-1620 .
[20]Guan YS,La Z ,Yang L ,et al.p53 gene in treatment of hepatic carcinoma: status quo[J].WorldJ Gastroenterol,2007,13(7):985-992.
[21]王婷婷,韩春侠,郑小莉. 重组人p53腺病毒注射液联合顺铂对宫颈癌HeLa细胞增殖及VEGF表达的影响[J].徐州医学院学报,2012,32(2):120-123.
[22]阮冬梅. 重组人p53腺病毒治疗癌性恶性腹水的研究[J].中外医学研究,2011, 9(4):32-33.
