产胞外多糖极地微生物的筛选及其胞外多糖对大菱鲆免疫活力的初步研究
2013-11-12赵惠娅刘同军郑风荣林学政
赵惠娅,刘同军,郑风荣,林学政*
(1. 山东轻工业学院 食品与生物工程学院,山东 济南 250353;2. 国家海洋局第一海洋研究所 国家海洋局海洋生物活力物质重点实验室,山东 青岛 266061)
微生物多糖种类众多,包括胞内多糖、结构多糖、胞外多糖等, 目前研究的热点集中于微生物胞外多糖(exopolysaccharide,EPS)。EPS是微生物的次级代谢产物,是微生物在生长过程中分泌到细胞壁外形成与菌体分离的可溶性多糖及多糖复合物[1]。EPS在细胞外形成一层薄膜,可有效地防止外界环境变化和侵蚀者对菌体细胞的侵害,从而提高自身的防御能力[2]。南极独特的地理和气候条件,形成了一个低温、干燥、强辐射的极端环境,而在此环境中生存着大量可产胞外多糖的微生物菌群。这些极端环境中产生的微生物胞外多糖由于其独特的分子结构与物理化学性质,使其在制药、食品添加剂等方面具有广阔的市场前景[3]。
微生物多糖能够增强动物对细菌、真菌、病毒等的抵抗力,增强动物对外界不良刺激的反应,提高动物的免疫能力[4]。近年来,我国水产业发展迅速,尽管抗生素的使用可以使许多疾病得以控制,但是却对环境和水产品品质造成严重的不良影响。微生物多糖无药剂残留,且能改善动物健康状况,改善水体微生态环境,提高经济利益,因而受到人们的重视[5]。李桂峰等[6]将酵母多糖作为饲料添加剂投喂赤眼鳟后,发现其血清SOD酶活力、溶菌酶活力等均有不同程度的提高。Skov等[7]将β-1,3-葡聚糖结合到治疗Yersiniaruckeri引起的虹口病疫苗中,研究其对虹鳟鱼的免疫作用,发现在含有β-1,3-葡聚糖的鱼血浆中溶菌酶活力具有增加趋势。张路等[8]研究发现,在饲料中添加500 mg/kg肽聚糖时,可显著提高鲈鱼白细胞的吞噬指数和血清中溶菌酶活力。
极地特殊的生存环境使极地微生物在基因组成、酶学特点、代谢调节等方面具有独特的生物学机制与生理生化特性[9],其产生的胞外多糖较一般微生物多糖更具有独特的生物学活性[10]。有关极地胞外多糖在水产动物免疫系统的作用及在水产养殖上的应用目前尚未见报道,因此研究其作用具有重要意义和应用潜力。
本研究从600余株分离自南极微生物中筛选出10株产胞外多糖较高的菌株,对其进行分子鉴定与系统发育分析;并对其中4种多糖进行了大菱鲆非特异性免疫活力实验,从中筛选出2株可产生显著提高大菱鲆(Scophthalmusmaacimus)免疫活性的胞外多糖的极地菌株,以期为研发EPS免疫添加剂打下一定的基础。
1材料与方法
1.1 材 料
菌株:由国家海洋局第一海洋研究所海洋生物活性物质重点实验室菌种库提供。
大菱鲆(Psettamaxima):由威海某大菱鲆养殖场提供。
黄芪多糖:作为阳性对照,购自上海朝翔生物技术有限公司。
1.2 产胞外多糖菌株的筛选与EPS的提取
采用苯酚硫酸法进行产胞外多糖菌株的初筛[1],其标准曲线制备参考文献[11],产胞外多糖菌株的筛选过程参考文献[1]。
产胞外多糖菌株的筛选操作过程:1)取100 μL菌液接种到5 mL 2216E液体培养基中,10 ℃、150 r/min震荡培养5 d;2)1 mL 发酵液经离心后取0.5 mL上清液,加入1.5 mL 95%乙醇,4 ℃静置4 h;3)再次离心取沉淀,将沉淀溶于1 mL蒸馏水中,采取苯酚硫酸法测其多糖含量;4)根据490 nm吸光值,筛选出10株产胞外多糖较高的菌株。
根据筛选结果,对其中产胞外多糖较高的菌株的复筛参考文献[12],具体流程为:1)将发酵液以7 500 r/min离心10 min,除去菌体;2)取出上清液,加入3倍上清液体积的95%乙醇静置沉淀4 h;3)以7 500 r/min离心10 min,倒掉上清液,用去离子水溶解沉淀的多糖;4)采用Sevag法除蛋白,以7 500 r/min离心5 min; 5)取上清,加入3倍上清液体积的95%乙醇沉淀,以7 500 r/min离心10 min;6)用去离子水溶解沉淀的多糖,冷冻干燥,获得粗多糖。
1.3 分子鉴定与系统发育分析
16S rRNA基因扩增中的DNA模板的制备和PCR引物选取参照文献[13]进行。
PCR反应条件:95 ℃预变性5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,共进行30个循环;72 ℃延伸7 min;4 ℃保存。PCR产物送至南京金斯瑞生物股份有限公司进行纯化和测序。将所测定的16S rRNA基因序列同GenBank数据库已有细菌16S rRNA基因序列进行相似性比较分析。
序列比对采用BioEdit软件的多序列比对排列(Clustalw multiple alignment),系统发育分析采用Mega 4.0软件的邻接法(Neighbor-joining method)。
1.4EPS对大菱鲆的非特异性免疫实验
选择体重(100 ± 5) g、体长(12 ± 0.6) cm、体色基本一致的健康大菱鲆,随机分养于水族箱中,适应驯化1周后,开始实验。实验中采用水温15~18 ℃海水,每天早晨8:00喂食、10:00换水排污。实验时,将鱼随机分为9组,每组15尾,每组处理2个重复。
1.4.1 注射剂量与方法
用pH 7.4的灭菌PBS缓冲液配制多糖试剂,浓度为3 mg/mL。对照组肌肉注射0.1 mL PBS缓冲液、实验组肌肉注射0.1 mL多糖溶液、阳性对照组注射0.1 mL黄芪多糖。
1.4.2 血清的制备
注射3 d、5 d、7 d时,每尾鱼从尾静脉取血1 mL,4 ℃静置过夜,第二天取血清,2 000 r/min离心5 min,取上清液测定各酶活性。
1.4.3 免疫指标的测定
总超氧化物歧化酶(total super oxide dismutase, T-SOD)、碱性磷酸酶(alkaline phosphatase, AKP)、酸性磷酸酶(acd phosphatase, ACP)、过氧化氢酶(catalase, CAT)和溶菌酶(lysozyme, LSZ)活力的测定均使用南京建成生物工程研究所生产的试剂盒产品,并参照试剂盒说明书进行操作。
2 结 果
2.1 产胞外多糖菌株的筛选
将经初筛获得的10株胞外多糖高产菌株进行发酵培养,经醇沉、sevage法除蛋白后,冷冻干燥所得的粗多糖称重结果见图1。可以看出,10株菌株产生的EPS绝大多数均高于0.2 g/L,其中菌株3-3-1-2胞外粗多糖产量高达0.6 g/L。
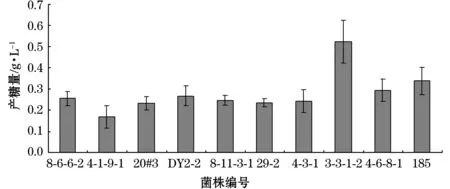
图1产胞外多糖菌株筛选Fig.1 Screening of exopolysaccharide-producing bacteria strains
2.2 分子鉴定与系统发育分析
将10株高产胞外多糖菌株的16S rRNA基因序列与GenBank数据库已有序列进行比对分析,与筛选出的菌株相似度最高的模式菌株如表1所示。将测序得到的基因序列提交至GenBank数据库,获得序列注册号为JX262364~JX262373(表1)。

表1 产胞外多糖菌株16S rRNA基因序列同源性比较结果Table 1 Homology comparison of 16S rRNA sequence of exopolysaccharide-producing bacteria strains
一般认为,16S rRNA基因序列同源性小于98%属于不同的种,同源性小于93%(95%属于不同的属[14]。由表1可知,筛选出的高产胞外多糖的菌株与GenBank数据库中16S rRNA基因序列相似度均在99%以上。除菌株4-1-9-1、4-3-1、185的16S rRNA基因序列与GenBank数据库已有细菌基因序列介于99.85%(99.92%外,其它菌株的相似度均为100%。因此,在进行系统发育分析时分别选择具有代表性的菌株进行研究,构建的高产胞外多糖菌株及其相似度最高的模式菌株的系统发育树如图2所示。

图2产胞外多糖菌株系统发育分析Fig.2 Phylogenetic analysis of exopolysaccharide-producing bacteria strains
由图2可知,筛选出的10株高产胞外多糖菌株中,除菌株4-3-1属于嗜冷杆菌属(Psychrobacter)外,其余9株均属于假交替单胞菌属(Pseudoalteromonas)。
2.3 粗多糖对大菱鲆非特异性免疫活力指标的影响
2.3.1 粗多糖对大菱鲆血清AKP活力的影响
4种极地微生物EPS与黄芪多糖对大菱鲆血清AKP活力的影响见表2。注射实验的粗多糖均可不同程度地提高大菱鲆血清AKP活力,且同一实验组AKP活力随注射时间的增加而呈下降趋势。实验第3天时,注射多糖20#3、DY2-2、3-3-1-2的实验组比对照组分别增加了39%、36%、12%;其中20#3、DY2-2实验组差异显著(P<0.05),3-3-1-2实验组差异不显著(P>0.05)。20#3、DY2-2实验组的大菱鲆血清AKP活力高于阳性对照黄芪多糖实验组。实验第5天时,注射多糖20#3实验组比PBS对照组增加了21%,比阳性对照黄芪多糖组增加了8%,但差异并不显著(P>0.05)。综合实验结果表明,多糖20#3、DY2-2对大菱鲆血清AKP活力的促进作用较强。
2.3.2 粗多糖对大菱鲆血清ACP活力的影响
4种极地微生物EPS与黄芪多糖对大菱鲆血清ACP活力的影响见表3。注射实验的粗多糖对大菱鲆血清ACP活力均有一定程度的影响,同一实验组ACP活力随着注射时间的增加呈现先增后减的趋势。实验第5天时,注射多糖20#3、DY2-2、3-3-1-2、4-6-8-1的实验组比对照组活力分别增加了20%、13%、24%、7%,其中注射多糖20#3和3-3-1-2实验组差异显著(P<0.05),其他各实验组差异不显著(P>0.05)。由多糖对大菱鲆ACP活性影响趋势可知,其最佳作用时间在第5天。实验第5天,实验组与黄芪多糖阳性实验组对比可知,对大菱鲆血清ACP活力影响效果较好实验组多糖为20#3、3-3-1-2。

表2 各组AKP酶活力(king·100 mL-1)Table 2 The AKP activity in different test groups (king·100 mL-1)
注:a为差异显著(P<0.05)

表3 各组ACP酶活力(U·100 mL-1)Table 3 The ACP activity in different test groups (U·100 mL-1)
注:a为差异显著(P<0.05)
2.3.3 粗多糖对大菱鲆血清T-SOD活力的影响
4种极地微生物EPS与黄芪多糖对大菱鲆血清T-SOD活力的影响见表4。注射实验的粗多糖均可不同程度地提高大菱鲆血清T-SOD活力,且同一实验组T-SOD活力随注射时间的增加而呈下降趋势。注射多糖20#3、DY2-2、3-3-1-2实验组第3天时的T-SOD活力比对照组增加了13%、10%、7%,第5天时的T-SOD活力比对照组增加了14%、13%、7%,其中20#3、DY2-2实验组差异极显著(P<0.01),3-3-1-2实验组差异显著(P<0.05)。第3天时,20#3、DY2-2实验组的T-SOD活力比黄芪多糖阳性实验组分别高8%、5%。综合实验结果可知,对大菱鲆血清T-SOD活力影响显著的多糖为:20#3、DY2-2。

表4 各组T-SOD酶活力(U·mL-1)Table 4 The T-SOD activity in different test groups (U·mL-1)
注:a为差异显著(P<0.05),b为差异极其显著(P<0.01)
2.3.4 粗多糖对大菱鲆血清CAT活力的影响
4种极地微生物EPS与黄芪多糖对大菱鲆血清CAT活力的影响见表5。注射实验的粗多糖均可不同程度地提高大菱鲆血清CAT活力,且同一实验组CAT活力随注射时间的增加而呈下降趋势。多糖注射3 d时,注射多糖20#3、4-6-8-1实验组比PBS对照组分别增加24%、18%,且差异显著(P<0.05);5 d时,注射实验多糖的实验组均比PBS对照组活性有所增加,其中4-6-8-1实验组差异极显著(P<0.01),注射其它多糖实验组差异显著(P<0.05)。20#3、3-3-1-2、4-6-8-1实验组在注射5 d时的CAT酶活力比黄芪多糖阳性对照组分别增加了8%、5%、13%,由实验组7 d时的CAT酶活力均比黄芪多糖阳性对照组高。综合实验结果,对大菱鲆血清CAT影响显著的胞外多糖为20#3、4-6-8-1。
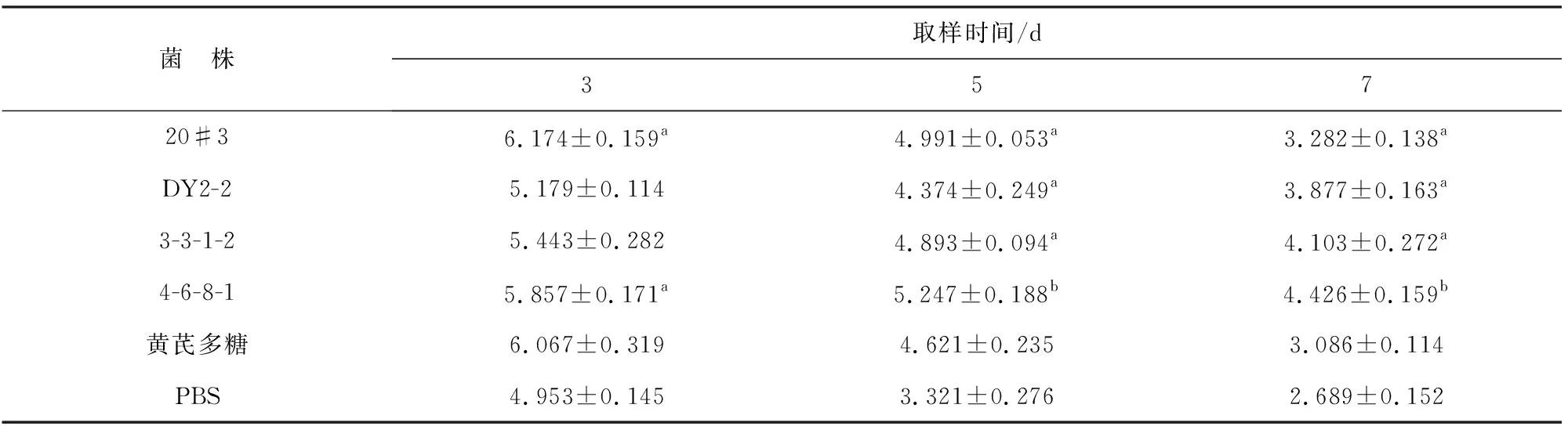
表5 各组CAT酶活力(U·mL-1)Table 5 The CAT activity in different test groups (U·mL-1)
注:a为差异显著(P<0.05),b为差异极显著(P<0.01)
2.3.5 粗多糖对大菱鲆LSZ活力的影响
4种极地微生物EPS与黄芪多糖对大菱鲆血清CAT活力的影响见表6。注射不同种类的粗多糖对大菱鲆血清LSZ活力影响不一。试验期间,所有胞外多糖对大菱鲆血清溶菌酶活力影响显著(P<0.05)。其中多糖3-3-1-2、4-6-8-1在整个试验期间其溶菌酶活力变化缓慢,与PBS对照组溶菌酶活力差异极显著(P<0.01)。实验第5、7天时,多糖3-3-1-2、4-6-8-1实验组的溶菌酶活力均比黄芪多糖阳性对照组高。综合实验结果可知,对大菱鲆血清CAT影响显著的胞外多糖为3-3-1-2、4-6-8-1。

表6 各组LSZ酶活力(μg·mL-1)Table 6 The LSZ activity in different test groups (μg·mL-1)
注:a为差异显著(P<0.05),b为差异极显著(P<0.01)
2.3.6 粗胞外多糖对大菱鲆非特异性免疫指标结果汇总
由表2~6可知,各粗多糖在不同程度上可提高大菱鲆血清中AKP、ACP、T-SOD、CAT、LSZ等酶活力。将4种胞外多糖的选取指标进行汇总,选取各指标促进效果较好的前2种EPS,结果见表7。
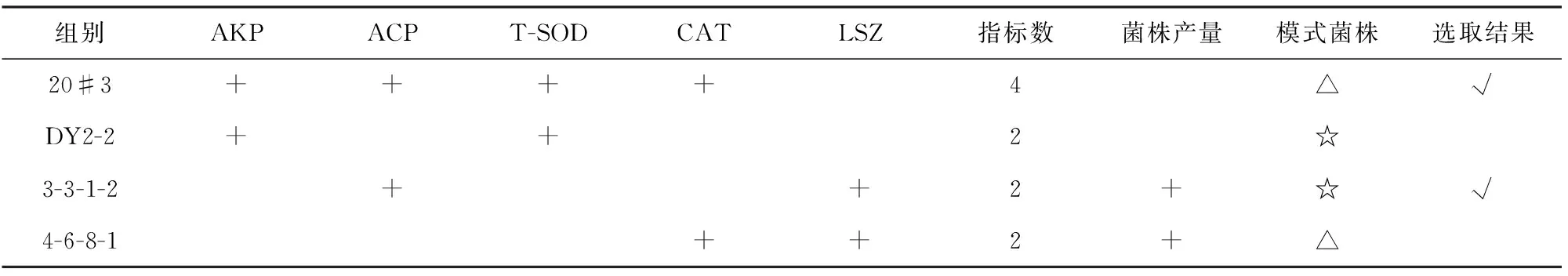
表7 粗多糖活性筛选结果汇总表Table 7 The summary table of rescreening of crude EPSs
注:+——效果差异显著;△——相同模式菌株;☆——相同模式菌株
由表7可知,在活性实验中的5个酶活指标中,菌株20#3产的EPS有4个指标较好;菌株DY2-2、3-3-1-2、4-6-8-1产的EPS均有2个指标较好,因而首先选取菌珠20#3产生的EPS进行进一步研究。此外,由于菌株4-6-8-1与菌株20#3是相同的模式菌株,因此舍去该菌株;菌株DY2-2、3-3-1-2的模式菌株相同,但是菌株3-3-1-2的EPS产量高于DY2-2,因此选取菌株3-3-1-2作为进一步研究对象。综合EPS对大菱鲆血清酶活的影响、EPS产量、菌株种属三方面因素,最终选定菌株20#3和3-3-1-2进行下一步研究。
3 讨 论
活性多糖是一种免疫增强剂,能够增强水产动物的非特异性免疫功能,提高机体抗病能力,且具有无污染、无药物残留等优点,因此日渐受到人们的重视[15]。目前采用较多的多糖免疫增强剂有β-葡聚糖、脂多糖、海藻多糖、肽聚糖等。我国众多研究者在评价免疫刺激剂对水产动物免疫系统的刺激效果时,常用的指标包含特异性免疫和非特异性免疫两方面,而一般研究者主要研究水产动物的非特异性免疫,其中非特异性免疫的指标包含AKP、ACP、T-SOD、PO等[16]。在本研究中将ACP、AKP、T-SOD、CAT、LSZ作为大菱鲆的非特异性免疫指标。研究结果初步证实,对大菱鲆注射极地微生物EPS均能不同程度地提高其非特异免疫活力,但是其促进程度存在者一定的差异。
本研究结果表明,在整个实验期间同一组大菱鲆血清AKP活力随着注射时间的增加而呈递减趋势,第3天时酶活力最高,而在第5、7天时有所降低,这与张伟妮等[17]的研究结果不同。同一实验组ACP活力随着注射时间的增加呈现先增后减的趋势,这与王庆奎等[18]的研究结果相似。极地微生物EPS可以不同程度地增加大菱鲆血清中T-SOD的活力,且增加效果明显,但随着注射时间的增加,同一实验组T-SOD的活力呈降低趋势,这与许国焕等[19]的研究结果相似。整个实验期间,大菱鲆血清CAT活力变化显著,同一实验组CAT活力随着注射时间的增长呈显著降低趋势,这与黄玉章[20]的实验结果相似。LSZ活力在整个试验期间差异显著,4种多胞外糖在较大程度上提高了大菱鲆的LSZ活力,且其作用时间较其它指标久,该实验结果与汪晓路等[21]的实验结果相似。造成这些酶活力结果差异的原因可能与选取的实验动物及多糖自身性质有关[17]。综合胞外多糖产量、种属、免疫活性活性等多重条件,最终选定最佳菌株为20#3、3-3-1-2。
目前,免疫添加剂在对虾的免疫活性方面的研究比较多。How等[22-24]在凡纳滨对虾的研究中发现,当向对虾体内注射4~6μg/g 的海藻多糖时,其血细胞中的THC、SOD、PO等活力在1~2 d 内会有不同程度的提高,6 d 时回落到对照组水平。Yeh等[22]向对虾体内注射10~50 μg/g 的叶马尾藻提取物时发现,其THC、PO等活力可持续6 d,而Cheng等[25]通过研究褐藻酸钠在对虾免疫活力方面的作用发现,其PO、O-2活力只能持续到第4天,在第6天时,各个指标均回落到对照组水平。以上结果表明,采用注射方法可在1~6 d内对机体保持免疫保护作用。本实验采用肌肉注射法并测定了极地微生物EPS对大菱鲆血清酶活的影响,实验结果表明,在注射多糖第5天时,多种酶活达到最大活力,第7天时,各指标均有不同程度的回落,这与cheng等[25]的实验结果相一致。
王淑娴等[26]在研究茯苓多糖对刺参的影响中发现注射0.3 mg茯苓多糖时,AKP和LSZ活力较高,而注射0.5 mg茯苓多糖时SOD的活力较高,可见注射多糖浓度的不同会对免疫指标的活力造成一定的影响。许第新等[16]在研究免疫多糖对克氏原螯虾的研究中发现,在注射多糖后,其血清、肌肉、肝脏等不同部位的AKP等酶活力不同,且其变化规律也具有一定的差异。由此可知,多糖对同一生物不同组织器官的影响各不相同。由于本实验只是粗筛具有免疫活性的极地微生物胞外多糖,因此只测定了单一浓度对大菱鲆血清中酶免疫指标活力的影响。
目前对适冷菌产生的胞外多糖研究也较多。Bai等[27]从南极细菌Pseudoaltermonassp.S-5中分离到一种胞外多糖PEP,通过研究其对白细胞免疫活力的影响,发现其是一种很好的天然生物反应调节剂。周维芝等[28]从南极海冰细菌Pseudoalteromonassp. Bsi20310中提取胞外多糖,发现其可以明显改善铁盐对模拟水溶性染料活力艳红X-3B废水的混凝效果。秦国奎等[29]从深海适冷菌Pseudoalteromonassp. SM9913中分离得到胞外多糖,研究发现其对于适冷菌在深海低温环境中维持细胞结构的完整和酶构象稳定方面具有重要的生态学功能。李江等[30]从南极适冷菌Pseudoalteromonassp. S-15-13中分离纯化到胞外多糖组分EPS-Ⅱ,对其研究发现胞外多糖组分EPS-Ⅱ可以抑制小鼠增殖细胞核抗原PCNA的表达,有效抑制小鼠肿瘤生长,最高抑瘤率可达45.1%。由此可见南极适冷菌产生的胞外多糖具有很好的生物学活性。目前生物活性多糖如云芝多糖、海藻多糖、葡聚糖等在罗氏沼虾、南美白对虾、虹鳟鱼等水产动物养殖中均能发挥提高免疫活力、促进生长、提高存活率的作用,且环保无公害,是一种具有很大市场潜力、用途广泛的水产动物饲料添加剂[31]。而目前国内对于极地微生物胞外多糖作为免疫添加剂的研究尚未见报道,因此研究具有特殊活性的极地菌胞外多糖具有重要意义。
4 结 论
本研究采用苯酚硫酸法和醇沉法从600余株南极微生物中筛选得到了10株产胞外多糖较高的菌株,其中菌株3-3-1-2粗胞外多糖产量达0.6 g/L。分子鉴定与系统发育分析可知,10株高产胞外多糖的极地微生物中9株属于假交替单胞菌属(Pseudoalteromonas),1株属于嗜冷杆菌属 (Psychrobacter)。根据胞外多糖粗提结果选择4种粗胞外多糖进行了大菱鲆非特异性免疫活性实验,筛选出2株可产生显著提高大菱鲆免疫活性的胞外多糖的极地菌株20#3和3-3-1-2,为极地胞外多糖作为水产动物饲料添加剂提供一定的基础资料。
参考文献(References):
[1] LIU T H, LI L L, QIAO M. Screening and identification of marine bacteria with exocellular polysaccharide[J]. Journal of Shandong Normal University(Natural Science, 2011,26(2):122-124.刘天华,李乐乐,乔梦.产胞外多糖海洋细菌的筛选及鉴定[J].山东师范大学学报(自然科学版),2011,26(2):122-124.
[2] Kumar A S, Mody K, Jha B. Bacterial exopolysaccharides-a perception[J].Journal of Basic Microbiology,2007,47:103-107.
[3] Poli A, Anzelmo G, Nicolaus B. Bacterial exopolysaccharides from extreme marine habitats: production , characterization and biological activities[J]. Mar Drugs, 2010,8(6):1779-1802.
[4] XIE L P.Immune enhancing effects of exopolysaccharides on the breeding animals[J].Animal Husbandry and Veterinary Medicine of Fujian, 2006,28(1):53-54.谢荔朋.微生物胞外多糖对养殖动物的免疫增强作用[J].福建畜牧兽医,2006,28(1):53-54.
[5] MA H Y. Probiotics and its research in the aquaculture industry[J]. Veterinary Pharmaceuticals & Feed Additives, 2005,10(3):9-10.马洪雨.微生态制剂及其在水产养殖业中的应用研究进展[J].兽药与饲料添加剂,2005,10(3):9-10.
[6] LI G F , KANG Y C, SUN J J, et al. The effects of Yeast Gluean on theSqualiobarbuscurriculusnon-specific immune response[J].Acta Scientiarum Naturlium Universitatis Sunyatseni, 2003,42(4):55-58.李桂峰,康裕财,孙际佳,等.酵母多糖对赤眼鳟非特异性免疫机能的影响[J].中山大学学报(自然科学版),2003,42(4):55-58.
[7] Skov J,Kania P W, Holten-Andersen L, et al.Immunomodulatory effects of dietary β-1,3-glucan fromEuglenagracilisin rainbow trout (Oncorhynchus mykiss) immersion vaccinated against Yersinis ruckeri[J]. Fish & shellfish Immunology,2012,33(1):111-120.
[8] ZHANG L, AI QH, MAI KS,et al.Effects of dietary peptidoglycan level on the growth and non-specific immunity of Japanese seabass,Lateolabraxjaponcus[J].Periodical of Ocean University of China, 2008,38(4):551-556.肽聚糖对鲈鱼生长和非特异性免疫力的影响[J].中国海洋大学学报,2008,38(4):551-556.
[9] ZENG Y X,CHEN B,ZOU Y,et al.Polar microorganisms, a potential source for new natural medicines-a review[J].Acta Microbiologica Sinica, 2008,48(5):695-700.曾胤新,陈波,邹扬,等.极地微生物-新天然药物的潜在来源[J].微生物学报,2008,48(5):695-700.
[10] Nichols C A, Guezennec J, Bowman J P. Bacterial exopolysaccharides from extreme marine environments with special consideration of the southern ocean, sea ice, and deep-sea hydrothermal vents: a review[J]. Mar Biotechnol(NY), 2005,7(4):253-271.
[11] ZHANG Y,LUAN X H.Screening of marine bacteria producting exopolysaccharide from sea coast[J].Modern Fisheries Information, 2010,25(4):13-17.张云,栾小惠.产胞外多糖的近海海洋细菌的筛选[J].现代渔业信息,2010,25(4):13-17.
[12] AI L Z,GUO B H,WANG Y Y,et al.Extraction of exopolysaccharides fromLactobacilluscaseiLC2W[J].Chinadairy Industry, 2008,36(7):14-18.艾连中,郭本恒,王荫榆,等.干酪乳杆菌LC2W胞外多糖的提取[J].中国乳品工业,2008,36(7):14-18.
[13] DU Z J, ZHAO Y, LI M J,et al.Screening and biodiversity analysis of agarolytic bacteria in the Qingdao coast[J].Periodocal of Ocean University of China, 2007,37(2):277-282.杜宗军,赵苑,李美菊,等.青岛近海琼胶降解细菌的筛选和多样性分析[ J].中国海洋大学学报,2007,37(2):277-282.
[14] LI F,ZENG G M,FAN C Z,et al.Comparison microbial communities during high temperature period of compoating of organic agriculture wastes and municipal domestic waste[J].Microbiology,2009,36(11):1657-1663.农业有机废物与城市生活垃圾堆肥高温期微生物种群结构比较[J].微生物学通报,2009,36(11):1657-1663.
[15] SUN C C,WANG A L, WANG S F,et al.Effects of polysaccharides on aquatic animals immune[J].Marine Science Bulletin, 2003,22(3):81-88.孙翠慈,王安利,王素芬,等.活力多糖对水产动物免疫功能的调节[J].海洋通报,2003,22(3):81-88.
[16] XU D X,YAO J, CHEN C F.Effects of polysaccharides from the cell wall of yeast onProcambarusshrimpin several immne-related activity [J].Freshwater Fisheries, 2004,34(5):56-58.许第新,姚娟,陈昌福.注射免疫多糖(酵母细胞壁)对克氏原螯虾几种免疫相关酶活性的影响[J].淡水渔业,2004,34(5):56-58.
[17] ZHANG W N, LIN X, WANG S K,et al.Effects of astragalus polysaccharide on nonspecific immunity and endocrine function in stomach and foregut of tilapia[J].Chinese Journal of Animal Nutrition, 2010,22(2):401-409.张伟妮,林旋,王寿昆,等.黄芪多糖对罗非鱼非特异性免疫和胃肠内分泌功能的影响[J].动物营养学报,2010,22(2):401-409.
[18] WANG Q K, ZHAO H Y, CHEN C X, et al. Effects of pachyman polysaccharides on nonspecific immunity of epinephelus malabaricus[J]. Aquatic Feed,2011,32(14):34-36.王庆奎, 赵海运, 陈成勋, 等.茯苓多糖对点带石斑鱼非特异性免疫力的影响[J].水产饲料,2011,32(14):34-36.
[19] XU G Z, LIANG Y G, WU Y E,et al.Immunity effects of Yeast Glucan on P. vannamei Boone[J].Feeding Industry, 2003,24(10):53-54.许国焕,良友光,吴月嫦,等.酵母葡聚糖对南美白对虾免疫功能的影响[J].水产养殖,2003,24(10):53-54.
[20] HUANG Y Z.Effects of astragalus polysaccharides on growth performance and immunity function in tilapia[D]. Fuzhou: Fujian Agriculture and Forestry University, 2009.黄玉章.黄芪多糖对奥尼罗非鱼生长性能和免疫功能的影响[D].福州:福建农林大学,2009.
[21] JIANG X L, LIU S Q, MOU H J, et al. Effects of fesungus polysaccharose on immune activities of serum and lymphoyte ofPenaeuschinensis[J].Zoological Research,1999,20(1):41-45.江晓路,刘树青,牟海津,等.真菌多糖对中国对虾血清及淋巴细胞免疫活性的影响[J].动物学研究, 1999,20(1):41-45.
[22] How W Y, Chen J C. The immunostimulatory effect of hot-water extract ofGracilariatenuistipitataon the white shrimpLitopenaeusvannameiand its resistance againstVibrioalginolyticus[J]. Fish & Shellfish Immunology,2005,8(19):127-138.
[23] Yeh S T, Lee C S, Chen J C. Administration of hot-water extract of brown seaweedSargassumduplicatumvia immersion and injection enhances the immune resistance of white shrimpLitopenaeusvannamei[J].Fish & Shellfish Immunology, 2006,3(20):332-345.
[24] Fu Y W, Hou W Y, Yeh S T, et al. The immunostimulatory effects of hot-water extract ofGelidiumamansiivia immersion, injection and dietary administration on white shrimpLitopenaeusvannameiand its resistance againstVibrioalginolyticus[J]. Fish & Shellfish Immunology,2007,7(22):673-685.
[25] Cheng W, Liu C H, Yeh S T, et al. The immunestimulatory effect of sodium alginate on the white shrimpLitopenaeusvannameiand its resistance againstVibrioalginolylicus[J]. Fish & Shellfish Immunology,2004,7(17):41-51.
[26] WANG S X, LI T B, PAN Y,et al.Efeects of pachyman polysaccharides on immune factor activity in the body cavity fluid of sea cucumber[J]. Journal of Aquaculture, 2010,1:59-61.王淑娴,李天保,樊英,等.茯苓多糖对刺参体腔液中免疫因子活性的影响[J].水产养殖,2010,1:59-61.
[27] BAI Y, ZHANG P, CHEN G, et al. Macrophage immunomodulatory activity of extracellular polysaccharide (PEP) of Antarctic bacteriumPseudoaltermonassp.S-5[J]. Int Immunopharmacol,2012,12(4):611-7.
[28] ZHOU W Z, SHEN B L, LIU S B,et al.FTIR spectrum and coagulation enhancement of exopolysaccharide secreted by an Antarctica bacterium Pseudoalteromona sp. Bsi20310[J].Spectroscopy and Spectral Analysis, 2009,29(9):2405-2408.周维芝,申博玲,刘升波,等.南极海冰细菌胞外多糖的助凝作用及红外光谱分析[J].光谱学与光谱分析,2009,29(9):2405-2408.
[29] QIN G K.Structure,ecological roles and biosynthesis gene cluster of EPS from deep-sea psychrotrophic bacteriumPseudoalteromonassp.SM9913[D]. Jinan: Shandong University, 2007. 秦国奎.深海适冷菌Pseudoalteromonassp.SM9913 分泌的胞外多糖的结构鉴定生态学功能及其生物合成基因簇的克隆与分析[D].济南:山东大学,2007.
[30] LI J, CHEN K S, LI G Y,et al.Inhibitory effects of exopolysaccharide(EPS) from an Antarctic psychrotrophsPseudoalteromonassp.S-15-13 on the sarcoma180of mice[J]. Chinese Journal of Marine Drugs, 2007,26(3):9-13.李江,陈靠山,李光友,等.南极适冷菌Pseudoalteromonassp.S-15-13胞外多糖EPS-Ⅱ对小鼠S180肉瘤抑制作用的研究[J].中国海洋药物,2007,26(3):9-13.
[31] YIN H, GE C R, CHENG Z B.The prospects of polysaccharide with biological activity in aquaculture[J].Veterinary Pharmaceutticals & FeedAdditives, 2004,9(2):16-17.殷红,葛长荣,程志斌.生物活力多糖在水产养殖业中的应用前景[J].兽药与饲料添加剂,2004,9(2):16-17.
