介入式手术机器人进展
2013-11-12李盛林沈杰言勇华陈大国
李盛林,沈杰,言勇华,陈大国
1上海交通大学机器人研究所,上海市,200240
2 解放军第四五五医院,上海市,200052
血管介入手术是指医生在数字减影血管造影机(DSA) 的导引下,操纵导管在人体血管内运动,将导管从病人穿刺部位送至靶血管,对病灶进行治疗。微创介入手术在临床中有着广泛的应用,但随着手术患者的不断增多,传统的微创介入手术也逐渐暴露出医生长期受到X射线辐射、医生培训周期长、手术准确度低等缺点[1]。这些缺点限制了血管介入手术的应用。
由于手工操作介入手术的上述缺点,利用机器人实现导丝插入成了热门的研究课题。由外科医生遥控操作的介入手术机器人可以将导丝送进人体内,在手术过程中实现对导管的推进、后退和旋转,手术完成后能将导管拉离人体等功能,大大降低了医务人员的劳动强度,也在一定程度上减少了手术对医生个人技术熟练程度的依赖,能显著提高手术成功率,减轻病人痛苦。由于介入过程医生在隔离室操作,避免了医生遭受手术时的X射线辐射[2-3]。
1 国内外研究现状
与其它手术机器人在神经外科和骨科的应用相比,血管介入手术机器人的研究起步比较晚,从二十世纪八十年代开始兴起。
1.1 介入手术中的磁导航系统
研究人员已经设计出了几种类型的血管介入手术机器人。心血管介入手术采用了立体定向磁导航系统(见图1),外科医生能够更有效地操作导丝、导管和其他磁性介入设备。在这个系统中,导管是特制的磁导管,一块非常小的磁铁被包埋在导管的尖端,这样导管的方向就能被体外的磁场所控制。当两侧的磁体旋转时,在磁场范围内可产生不同强度和方向的磁场力,使得磁导管在不同的磁矩的作用下,改变尖端的方向[4]。导丝的前进和后退由机器人控制。该系统通过磁场非接触方式定位导丝远端,操作精度高;导丝头部除了植入磁体外其它部分都十分柔软,所以没有血管穿孔的危险。立体定向磁导航系统的应用代表着心血管介入手术治疗在实现数字化中取得了重要的进步。

图1 立体定向磁导航系统Fig.1 Stereotactic magnetic navigation system
1.2 心脏介入治疗系统
以色列的海法心血管疾病研究所设计了一个适用于心脏介入治疗远程控制的机器人系统[5](见图2),该系统包括一个床边装置和操作控制单元。床边装置安装在手术台,控制导丝前进、后退和旋转运动。导丝的运动是由一对电机驱动的滚轮实现的。安装在电机后面的一对被动轮用来监视滚轮传送导丝的情况。如果滚轮设备遇到障碍或者产生打滑,滚轮运动监测装置会报告故障,同时系统将暂时停止工作。操作控制单元远离病床,由电脑触摸屏控制台和操纵杆组成。该系统用于治疗冠状动脉狭窄,对患者来说安全、可靠,对外科医生来说完全避免了X射线辐射,且大大提高了手术的精度。
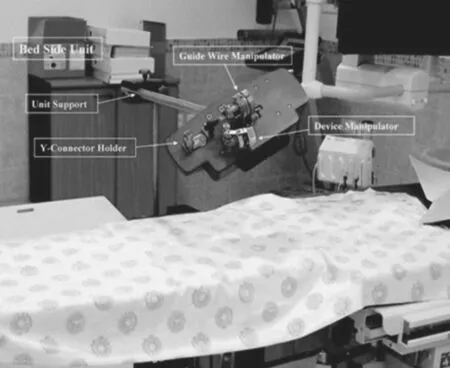
图2 远程控制心血管介入手术Fig.2 Remote control vascular interventional surgery
1.3 用于神经外科的导管机器人系统
香川大学研制了用于治疗血管神经外科的导管操作机器人系统[6](见图3)。导管操作机器人系统采用主从式结构。该系统含有用于测量导管和血管之间接触力的力传感器,接触力通过触觉显示装置传送给外科医生。触觉反馈可以保护血管免受损坏。

图3 导管机器人系统Fig.3 Catheter operating robot system
1.4 用于肿瘤化疗的介入手术机器人系统
上海交通大学设计了用于肿瘤化疗和心血管疾病的介入手术机器人。介入手术机器人模型示意图如图4所示。外科医生坐在监控室,向机器人发送控制指令,机器人根据这些指令来控制导丝和导管的运动。介入手术机器人导丝导管的夹紧距离可调,所以可以控制多种规格的导丝和导管[7]。现在大多数商业化的触觉显示设备是点显示设备,因此触觉反馈仅限于一些特定的类别,如穿刺、导管缝合等。但由于血管和导丝之间有许多接触点,所以很难检测出导丝和血管之间的所有的接触力[8]。北京航空航天大学设计了碰撞检测响应模型,它将所有的接触力都传递到头部,从而可以使用现有的触觉显示设备进行检测。
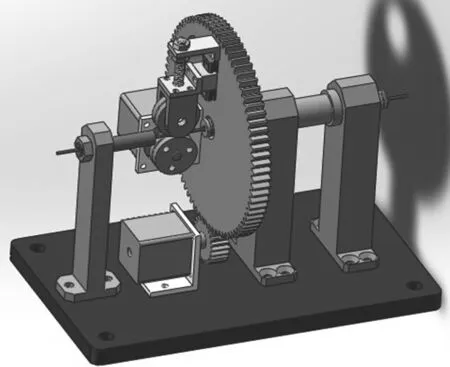
图4 血管介入手术机器人模型Fig.4 Model of vascular interventional robot
2 血管介入机器人的关键技术
介入手术机器人包括机械装置与控制系统、图像导航系统和力反馈系统等。
2.1 机械装置与控制系统
为了保护医生避免受X射线照射,介入手术机器人机械装置及控制系统通常采用主从式结构[8],如上面提到的血管介入机器人。主控制台位于远离病人的监控室,从动装置位于病床的手术台[9]。
由于介入手术高精确度的要求,一般采用步进电机来驱动机械装置。在荧光图像的指导下,外科医生在主控制台控制操纵杆,介入手术机器人检测到医生的这些动作,并复现医生的动作,从而控制导丝的轴向(前进或后退)和旋转运动[10]。轴向运动允许导丝沿血管前进或后退,当导丝要进入血管的分支时,就需要旋转运动。为了实现这些动作,机械装置和控制系统应符合下列要求[11]:
(1)介入手术机器人的机械装置需要灵活地控制导丝运动,为了平稳地移动,该机构应具有较小的惯性。
(2) 介入手术机器人可以精确地控制导丝的运动。
(3) 血管介入手术是很柔和的,导丝的运动的速度应该是可调节的,即当导丝在比较厚的血管中运动时可以比较快速地移动,当在比较薄的血管中运动时需要降低速度。
(4) 当介入手术机器人发生故障时,导丝和导管必须很容易地拆除。在这种情况下,外科医生将会进行人工手术。
(5) 介入手术机器人可以方便地进行消毒。

图5 导丝插入机构Fig.5 Device for insert wire
2.2 图像导航系统
在传统的血管介入手术,外科医生在二维数字减影血管造影(DSA)的指导下操纵导丝[12]。然而,由于血管重叠和透视,二维投影图像会丢失三维血管的重要信息[13-14]。很多时候根据几个二维投影图像并不能准确确定血管系统的分布。外科医生只有在解剖学为基础的主观经验上重建三维血管,这会延长手术时间,增加患者和医务人员接触X射线的时间。因此,需要能够集成显示导丝和血管并确保手术安全性的三维血管模型[15]。
近年来针对血管的三维血管模型进行了很多研究。磁共振血管造影(MRA)和计算机断层扫描血管造影(CTA)可用于三维血管重建。Movassaghi[16]通过二维DSA血管图像来重建三维血管图像,该方法包括三个步骤:(1)校准DSA机,从而确定投影图像的几何形状,并纠正失真图像;(2)在血管介入手术之前从不同方位采取一系列二维血管造影,然后确定血管中心线、血管直径和分叉点的特征,并在每个选定的突起构建血管层次结构;(3)根据二维血管造影图像得到的中心线和血管直径来重建三维血管图像。把投影视图之间的夹角作为函数进行定量分析来检验三维血管模型的准确性,并讨论如何确定最佳视图来最大限度地减小血管重叠和透视。
导丝的位置相当于血管中心线,对导丝的调整也被映射到重建的三维血管系统中[17]。这种方法实现了导丝和三维血管系统的综合显示。因此,外科医生可以比较容易地控制介入手术机器人的运动。
2.3 力反馈系统
在传统的微创介入手术中,医生根据图像用手来操作导丝,可以准确地感觉到导丝在血管中的受力情况,能在引导图像不够直观的情况下保证导丝的安全介入。目前研究的主从式介入手术系统中,医生脱离手术现场,借助主手手柄来实现导丝介入,不能很好地感知导丝在血管中的受力情况[18]。所以需要将导丝在介入过程中的受力情况反馈回来,作为参考信息提供给控制室内的医生,辅助其进行更加安全的导丝介入操作。
一些研究者利用固定在导丝头部微力传感器来测量血管和导丝头部之间的接触力[19]。然而,导丝和血管之间有许多接触点,很难找到合适的位置来固定测量摩擦的微力传感器。香川大学将微传感器固定到导管的一侧,仍不能完整准确的计算出导管和血管之间所有的摩擦。
力反馈要传递到医生手中,必须采用触觉接口设备[20]。商业触觉界面有很多种,但力反馈技术却没有广泛应用在临床介入手术机器人中,这限制了介入手术机器人的广泛应用。所以,构建一个能够综合各种影响血管阻力因素的模型是迫切需要解决的问题。
3 结论
介入手术机器人相比传统的介入手术具有许多优点。然而,机器人手术往往比对应的传统介入手术更昂贵,且大多缺乏力反馈的信息。介入手术机器人应该着重在以下几个方面加以改进:(1)介入手术装置应更灵敏、更紧凑、更容易控制;(2)影像导航系统应该提供更多的血管信息,从而能够更方便地进行手术,缩短手术时间;(3) 在手术过程中应该提供可靠的力反馈系统,以便外科医生能够准确、实时地接收到反馈力的信息,从而精确、安全地完成手术。
远程外科手术是一种很有前途的新领域,能够打破地域限制使更多人都能享受到最先进的医疗技术。未来的介入手术机器人系统可集成先进的成像系统和力反馈系统。术前和术中X射线图像可以提供给外科医生大量的信息,甚至可能让机器人手术系统自动执行部分选定的手术过程。
[1] UCLA.robots in surgery:No longer science fiction[J].Clark Urological Center Newsletter,2002,14:1-2.
[2] 贺志秀,钱炜,宋成利,等.介入手术中导管导向机器人技术的发展[J].介入放射学杂志,2011,20(7):584-588.
[3] 贾博,田增民,卢旺盛,等.遥操作血管介入机器人的实验研究[J].中国微侵袭神经外科杂志,2012,17(5):221-224.
[4] Da L,Zhang D,and Wang T.Overview of the vascular interventional robot[J].Int J Med Robot Comp:MRCAS,2008.4(4):289-294.
[5] Beyar R,Gruberg L,Deleanu D,et al.Remote-control percutaneous coronary interventions:concept,validation,and first-in-humans pilot clinical trial[J].J Am Coll Cardiol(JACC),2006,47(2):296-300.
[6] Wang T,Zhang D,Da L,et al.Remote-controlled vascular interventional surgery robot[J].Int J Med Robot Comp,2010,6(2):194-201.
[7] 陈大国,沈杰,言勇华.机器人辅助导管插入系统技术进展[J].中国医疗器械杂志 .2010,34(1):35-38.
[8] Liu Cheng,Fu Yili.The design and implementation of virtual hand grasp behavior process in virtual assembly[J].哈尔滨工业大学学报(英文版),2010,17(4):527-530.
[9] 沈杰,李盛林,陈大国,等.基于激光鼠标传感器的导丝遥操作系统的设计与试验[J].中国医疗器械杂志,2012,36(1):32-35.
[10]Thakur Y,Nikolov HN,Gulka IB,et al.Design and construction of a multipath vessel phantom for interventional training[J].Brit J Radio,2010,83(995):979-982.
[11]Wang J,Guo S,Kondo H,et al.A novel catheter operating system with force feedback for medical applications[J].Int J Inform Acquis,2008,5(1):83-92.
[12]Movassaghi B,Rasche V,Grass V,et al.A quantitative analysis of 3D coronary modeling from two or more projection images[J].IEEE T Med Imaging 2004,23:1517-1531.
[13]Jayender J,Azizian M,Patel RV.Autonomous image-guided robotassisted active catheter insertion[J].IEEE T Robot,2008,24(4):858-871.
[14]Lei X,Brian T,Eduard S,et al.Overview of image-guided radiation therapy[J].Med Dosim,2006,31(2):91-112.
[15]Saliba W,Cummings JE,Oh S,et al.Novel robotic catheter remote control system:feasibility and safety of transseptal puncture and endocardial catheter navigation[J].J Cardiovasc Electr,2006,17(10):1102-1105.
[16]Milickovic NB,Baltas D,Giannouli S,et al.Automatic reconstruction of catheters in CT based brace therapy treatment Planning[A].Proc EMBS[C],2000:2870-2874.
[17]Ernst S,Ouyang F,Linder C,et al.Initial experience with remote catheter ablation using a novel magnetic navigation systemmagnetic remote catheter ablation[J].Circulation,2004(109):1472-1475.
[18]Koji I,Masaki T,Takao N.Virtual endoscope system with force sensation[A].Proc IEEE ICRA[C],1999,3:1716-1721.
[19]Dargahi J,Sedaghati R,Singh H,et al.Modeling and testing of an endoscopic piezoelectric-based tactile sensor[J].Mechatronics,2007,17(8):462-467.
[20]Jan P,Joeri C,Dominiek R,et al.A micro optical force sensor for force feedback during minimally invasive robotic surgery[J].Sensors Actuat,2004,115:447-455.
