抗抑郁新化合物SIPI-C和SIPI-F对PC12细胞内游离钙离子浓度的影响
2013-11-12汪溪洁翁志洁李建其
周 慧,汪溪洁,翁志洁,李建其,马 璟
(1.上海医药工业研究院国家上海新药安全评价研究中心,上海 201203;2.上海医药工业研究院化学制药新技术中心,上海 200040)
SIPI-A~SIPI-F是根据药物作用靶点,定向设计和合成的系列新型抗抑郁化合物,属于芳烷醇哌嗪衍生物[1],6个化合物分别为同一化学结构的不同光学异构体,其结构式见图1。体外研究表明,6个化合物对去甲肾上腺素(norepinephrine,NE)、5-羟色胺(serotonin,5-HT)和多巴胺(dopamine,DA)均有较强的再摄取抑制作用,在小鼠体内表现出显著的抗抑郁作用[2]。在进行6个化合物的成药性比较研究时发现,SIPI-C和SIPI-F组有小鼠出现四肢抽搐等毒性反应(未发表的数据),推测它们可能具有神经系统的副作用,其他4个化合物未出现该毒性反应。因此,对化合物SIPI-C和SIPI-F产生神经毒性反应的机制进行研究。
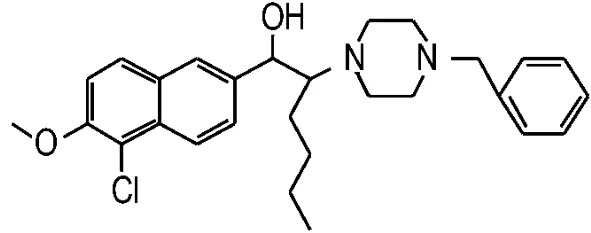
Fig.1 Core structure of SIPI-A -SIPI-F.SIPI-A is erythro form racemic;SIPI-B is(1R,2S)-optical isomer;SIPI-C is(1R,2R)-optical isomer;SIPI-D is(1S,2R)-optical isomer;SIPI-E is(1S,2S)-optical isomer;and SIPI-F is threo form racemic.
细胞内钙离子浓度的增高是许多生理病理性过程的一个关键信号,神经细胞内的钙离子超载是造成神经元损伤的主要原因之一[3]。Shimizu 等[4]发现,米帕明(imipramine)和米安色林(mianserin)等通过促进细胞内钙离子释放,浓度依赖性地增加大鼠额皮质原代培养神经元内钙离子浓度;Joshi等[5]发现,高浓度的阿米替林(amitriptyline)和地昔帕明(desipramine)可以增加神经内分泌细胞PC12细胞和人脑星形成胶质细胞瘤U-87 MG细胞内的钙离子浓度。在这两个实验中,药物引起细胞内钙离子浓度升高的剂量远高于其治疗剂量,对其药效学作用的产生意义不大。因此,米帕明、米安色林、阿米替林和地昔帕明对细胞内钙离子的作用可能与其神经系统不良反应相关。
研究发现,SIPI-C和SIPI-F抑制未分化PC12细胞中的延迟整流钾电流的 IC50分别为0.6和1.2 μmo·lL-1,在该浓度条件下,SIPI-C和SIPI-F可以使神经细胞持续去极化,从而增加神经递质的释放和神经细胞的兴奋性[6]。抑制延迟整流钾通道可以延缓动作电位的复极化过程,从而使进入细胞的游离钙离子增多。本研究应用激光共聚焦显微镜观察PC12细胞给予SIPI-C和SIPI-F后,细胞内游离钙离子浓度([Ca2+]i)的动态变化,研究这两种化合物对细胞内([Ca2+]i)的影响,以探讨其可能的神经毒性作用及机制。
1 材料与方法
1.1 药物、试剂及主要仪器
抗抑郁化合物SIPI-A,B,C和F由上海医药工业研究院提供,纯度分别为98.53%,98.36%,99.65%和99.25%。将SIPI-A,B,C和F用二甲亚砜(DMSO)溶解,配制成终浓度为10 mmol·L-1的母液,于-20℃保存,实验时超纯水稀释到所需浓度。青霉素/链霉素,硝苯地平和胶原Ⅰ型均购自Sigma公司;Hank液,D-Hank液,胰蛋白酶,DMEM/F12培养基,胎牛血清和马血清均购自Gibco公司;DMSO为国产分析纯;钙离子荧光探针(Fluo-3/AM)购自Molecular Probe公司。激光扫描共聚焦显微镜LSM-510德国Zeiss产品。
1.2 细胞培养
PC12细胞(购自中科院上海生命科学研究院细胞库),置于含有10%马血清、5%胎牛血清、青霉素100 kU·L-1和链霉素 100 mg·L-1的 DMEM/F12培养基中,接种于经胶原Ⅰ型包被的培养皿,置CO2培养箱(37℃,5%CO2)中培养过夜。
1.3 实验分组
将Hank液和D-Hank液分别作为有钙组和无钙组的细胞外液,根据细胞外液有钙或无钙以及加入药物的不同,将实验分为以下几部分:①有钙外液中,SIPI-A,B,C 和 F 10 μmol·L-1对 PC12 细胞[Ca2+]i的影响;② 有钙外液中,SIPI-C和SIPI-F 1,10 和 100 μmol·L-1对 PC12 细 胞[Ca2+]i的影响;③ 有钙外液中,同时加入硝苯地平和 SIPI-C 或SIPI-F,观察硝苯地平 10 μmol·L-1对SIPI-C和SIPI-F 10 μmo·lL-1作用的影响;④ 无钙外液中SIPI-C和 SIPI-F 10 μmol·L-1对 PC12 细胞[Ca2+]i的影响。
1.4 激光共聚焦显微镜检测[Ca2+]i的动态变化
待PC12细胞贴壁后,加入荧光离子探针Fluo-3/AM,终浓度为 10 μmol·L-1,在 37℃避光孵育40~50 min。将细胞用 Hank液(有钙组)或D-Hank液(无钙组)轻轻冲洗3次,然后加入1 ml相应细胞外液。激光扫描共聚焦显微镜采用激发光488 nm,发射光505~550 nm,连续扫描600次,扫描速率为2 s/次。各组开始连续扫描约50次后加入相应药物,继续扫描,扫描速率为2 s/次,观察荧光强度的动态变化,并用ZEISS-SP2工作软件计算出每次钙离子的荧光强度。以各时间点的荧光强度与初始荧光强度的比值作为[Ca2+]i的相对值。
2 结果
2.1 有钙细胞外液条件下SIPI-A,B,C和F对PC12细胞内游离钙离子浓度的影响
图2结果显示,给予DMSO前后的荧光强度相对值分别为0.96±0.01 和0.92±0.13,提示实验浓度的DMSO对[Ca2+]i无明显影响。给予SIPI-A 10 μmo·lL-1后的相对荧光强度降低(14±7)%(n=5,P<0.01),提示 SIPI-A 使[Ca2+]i减少。给予 SIPI-B,SIPI-C 和 SIPI-F 10 μmol·L-1后的相对荧光强度升高(27±14)%(n=5,P<0.05),(84±9)%(n=5,P<0.05)和(87±17)%(n=6,P<0.01),给药后荧光强度增加,提示 SIPI-B,SIPI-C和 SIPI-F使[Ca2+]i增加。

Fig.2 Effect of SIPI-A,B,C and F on[Ca2+]iof PC12 cells in Hank's solution.SIPI-A,B,C and F 10 μmol·L -1 were added after successive scanning for 50 times,respectively.The fluorescence intensity at each time point was compared with the basal level before SIPI-A,B,C or F stimulation.The ratio was considered the relative value of [Ca2+]i.±s,n=5 - 6.*P<0.05,**P<0.01,compared with the corresponding before dosing group.
2.2 SIPI-C和SIPI-F对PC12细胞[Ca2+]i的影响
2.2.1 有钙细胞外液
图3结果显示,与给药前相比,SIPI-C 1,10和100 μmol·L-1作用 100 s 后的相对荧光强度分别升高(10±9)%(n=8,P<0.05),(74±39)%(n=5,P<0.05)和(91±39)%(n=7,P<0.01),说明[Ca2+]i显著增加,并且随着药物浓度的增加,SIPI-C对[Ca2+]i的影响逐渐增加。与给药前相比,SIPI-F 1 μmol·L-1作用 100 s 对[Ca2+]i无显著影响,SIPI-F 10 和100 μmol·L-1作用100 s 后,相对荧光强度分别升高(55±14)%(n=6,P<0.01)和(173±10)%(n=16,P<0.01),说明[Ca2+]i显著增加,并且随着药物浓度的增加,SIPI-F对[Ca2+]i的影响逐渐增加。图4结果显示,硝苯地平10 μmol·L-1使PC12细胞荧光强度下降,给药后相对荧光强度降低(20±11)%(n=5,P<0.05),提示[Ca2+]i减少。同时给予SIPI-C和硝苯地平或SIPI-F和硝苯地平,PC12细胞荧光强度立即上升达到峰值,随后下降。给予SIPI-C和硝苯地平后的相对荧光强度升高(24±6)%(n=6,P<0.05);给予SIPI-F和硝苯地平后的相对荧光强度升高(15±14)%(n=6,P<0.05)。
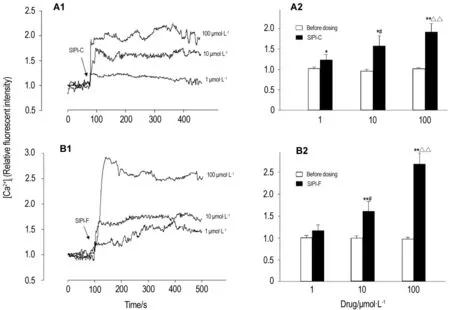
Fig.3 Effect of SIPI-C(A1,A2)and SIPI-F(B1,B2)on [Ca2+]iof PC12 cells.±s,n=5 -8.**P<0.01,compared with the corresponding before dosing group;##P<0.01,compared with 1 μmol·L-1group;△△P<0.01,compared with 10 μmo·lL-1group.
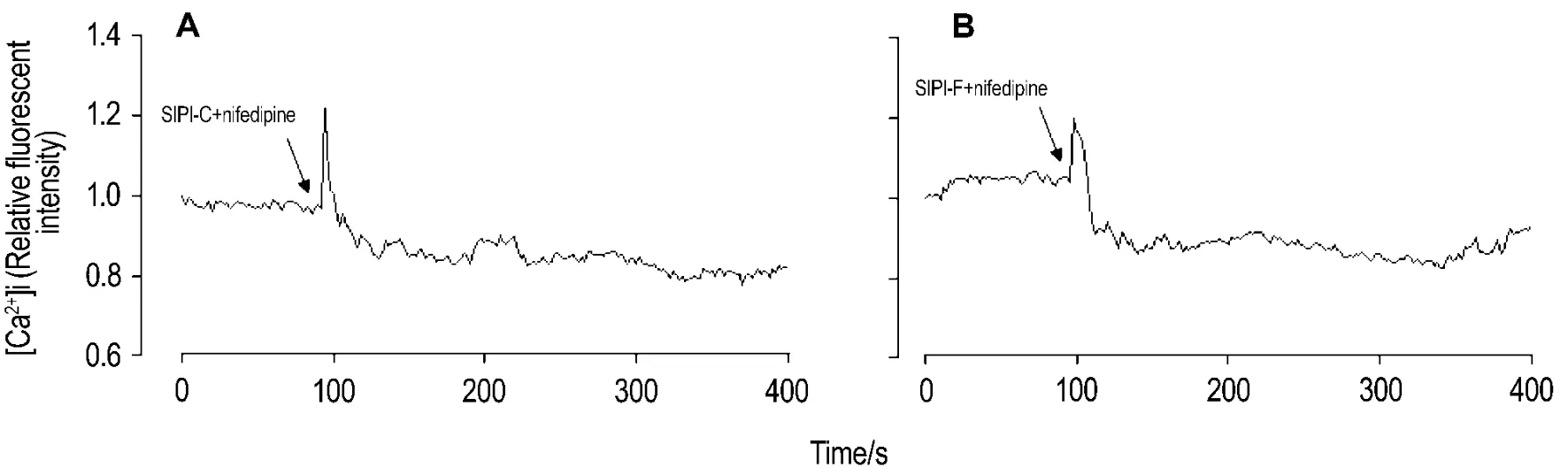
Fig.4 Effects of combination of SIPI-C(A)or SIPI-F(B)10 μ mol·L -1with nifedipine 10 μ mol·L -1on [Ca2+]iof PC12 cells.
2.2.2 无钙细胞外液
给予 SIPI-C 或 SIPI-F 10 μmol·L-1后,荧光强度立即升高达到峰值,幅度较在Hank液中明显减小(图5),给药后相对荧光强度升高(16±33)%和(18±9)%(n=5,P<0.01),随后荧光强度回到静息水平。提示在D-Hank液中,SIPI-C或SIPI-F对[Ca2+]i的影响较小。
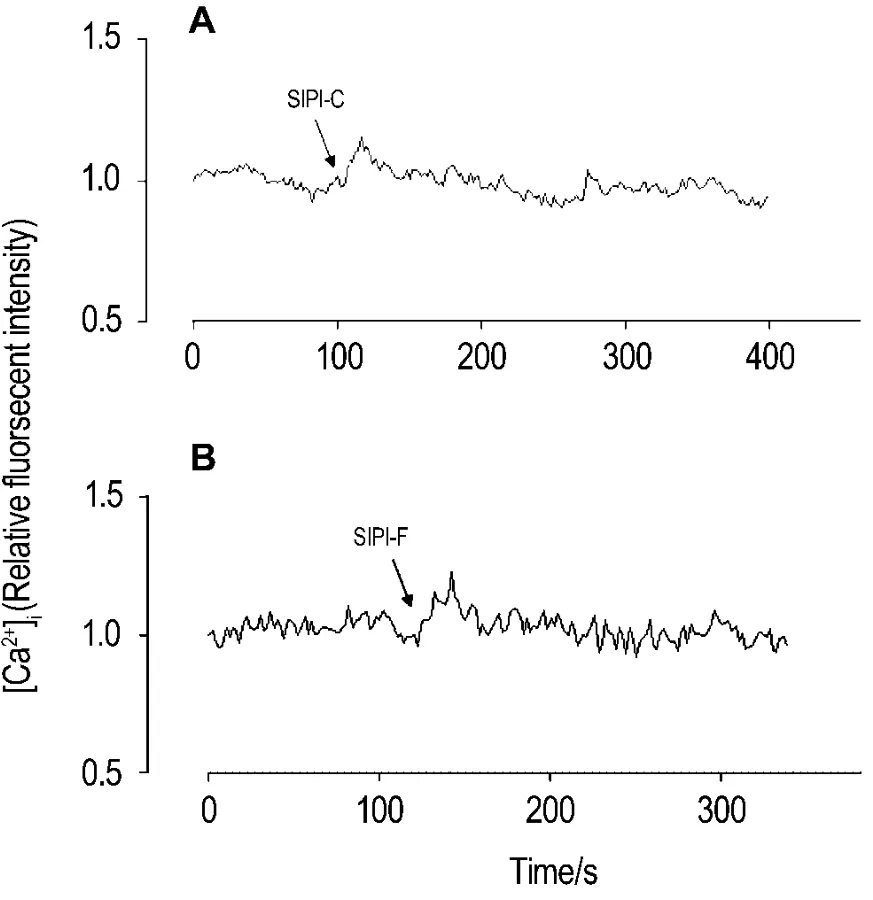
Fig.5 Effect of SIPI-C(A)and SIPI-F(B)10 μ mol·L -1 on[Ca2+]iof PC12 cells in D-Hank's solution.
3 讨论
本研究发现,在Hank液中,SIPI-C和 SIPI-F均可使[Ca2+]i增加,SIPI-A 使[Ca2+]i下降,SIPI-B使[Ca2+]i增加。因此,推测 SIPI-C和SIPI-F引起的[Ca2+]i升高可能与其神经毒性反应密切相关。因长时间的胞内钙离子急剧增多最终导致神经细胞膜的通透性增高,细胞肿胀损伤[7],神经细胞内的钙离子超载是造成神经元损伤的主要原因。
未分化PC12细胞的钙通道主要由L型钙通道组成,只表达小部分的N型钙通道[8]。有文献报道,L型钙通道参与抗抑郁药舍曲林和马普替林等引起的[Ca2+]i升高[9-10]。研究发现,硝苯地平10 μmol·L-1可以完全抑制 PC12 细胞 L 型钙离子通道[11-12]。本研究结果显示,硝苯地平 10 μmol·L-1明显抑制SIPI-C和SIPI-F引起的细胞外钙离子内流,说明L型钙离子通道在SIPI-C和SIPI-F引起的反应中发挥重要作用。同时硝苯地平未完全阻断PC12细胞[Ca2+]i增加,表明细胞膜上其他类型钙离子通道或细胞内钙库释放可能参与SIPI-C和SIPI-F引起[Ca2+]i升高。本研究发现,在D-Hank液中,给予 SIPI-C或 SIPI-F后,[Ca2+]i略有增加。与在Hank液中相比,药物作用后[Ca2+]i增加的幅度明显下降,提示细胞外钙离子内流和细胞内钙库释放可能同时作用引起[Ca2+]i升高。
小鼠急性毒性实验中(未发表的数据),SIPI-C和SIPI-F产生抽搐毒性反应的剂量分别为1600和800 mg·kg-1,根据体表面积折算相当于大鼠800和400 mg·kg-1。动物体内药代动力学研究结果显示,大鼠灌胃给予SIPI-C和SIPI-F 25 mg·kg-1后,最大血药浓度分别为 0.59 和 0.70 μmol·L-1。采用脑突触体对单胺类神经递质再摄取的方法研究发现,SIPI-C和SIPI-F抑制5-HT,NE和DA再摄取的 IC50平均值分别为 1.67 和 0.76 μmol·L-1。在本研究中,1 μmo·lL-1的SIPI-C或SIPI-F对[Ca2+]i影响较小或无影响,10 μmol·L-1的 SIPIC或SIPI-F对[Ca2+]i有明显影响,此浓度高于SIPI-C或SIPI-F的药效学剂量。因此,给予SIPI-C或SIPI-F后,[Ca2+]i的变化可能并不参与其抗抑郁作用的发挥,而与其神经系统不良反应密切相关。
前期研究发现,SIPI-C和SIPI-F抑制未分化PC12细胞中的延迟整流钾电流(半数有效抑制浓度分别为0.64 和 12.05 μmol·L-1),使神经细胞持续去极化[6]。当细胞去极化达到一定的水平时,就会激活细胞膜电压依赖性钙离子通道,从而使细胞外的钙离子向细胞内流动。细胞外钙离子进入细胞内可以引起细胞内的钙库释放,细胞内钙库主要有内质网、肌浆网以及线粒体等,分别受1,4,5-三磷酸肌醇受体系统[14]和 RyR 系统调控[15]。SIPI-C 和SIPI-F引起的细胞内钙库释放的机制尚有待于进一步研究。
综上所述,抗抑郁化合物SIPI-C和SIPI-F可以引起[Ca2+]i显著增加,最终造成神经元损伤,推测SIPI-C和SIPI-F对神经细胞内[Ca2+]i的影响可能是引起神经系统的不良反应的机制之一。
[1]He XD,Jiang D,Chen C,Chu YQ,Ding CF,Weng ZJ,et al.Non-covalent complexes of the antidepressant compound SIPI5358 with cyclodextrins[J].Acta Phys Chim Sin(物理化学学报),2010,26(10):2604-2612
[2]Li JQ,Huang LY,Dong WX,Weng ZJ,Jin H,Ni XL,et al.Synthesis and antidepressant activities of aryl alkanol piperazine derivatives[J].Chin J Med Chem(中国药物化学杂志),2006,16(5):270-276.
[3]Rothman SM,Olney JW.Excitotoxicity and the NMDA receptor-still lethal after eight years[J].Trends Neurosci,1995,18(2):57-58.
[4]Shimizu M,Nishida A,Hayakawa H,Yamawaki S.Ca2+release from inositol 1,4,5-trisphosphate-sensitive Ca2+store by antidepressant drugs in cultured neurons of rat frontal cortex[J].J Neurochem,1993,60(2):595-601.
[5]Joshi PG,Singh A,Ravichandra B.High concentrations of tricyclic antidepressants increase intracellular Ca2+in cultured neural cells[J].Neurochem Res,1999,24(3):391-398.
[6]Zhou H,Wang XJ,Weng ZJ,Ma J,Li JQ.Inhibition of(1R,2R)-SIPI5358 and SIPI5358 on delayed rectifier potassium current in undifferentiated PC12 cells[J].Chin J Pharm(中国医药工业杂志),2012,43(6):443-447.
[7]Xiong H,Liang WL,Wu XR.Pathophysiological alterations in cultured astrocytes exposed to hypoxia/reoxygenation[J].Prog Physiol Sci(生理科学进展),2000,31(3):217-221.
[8]Andrade A,de León MB,Hernández-Hernández O,Cisneros B,Felix R.Myotonic dystrophy CTG repeat expansion alters Ca2+channel functional expression in PC12 cells[J].FEBS Lett,2007,581(23):4430-4438.
[9]Huang CJ,Kuo DH,Chang KH,Shieh P,Chen FA,Fang YC,et al.Effect of the antidepressant sertraline on Ca2+fluxes in Madin-Darby canine renal tubular cells[J].Recept Signal Transduct Res,2009,29(6):342-348.
[10]Hsu SS,Chen WC,Lo YK,Cheng JS,Yeh JH,Cheng HH,et al.Effect of maprotiline on Ca2+movement in human neuroblastoma cells[J].Life Sci,2004,75(9):1105-1112.
[11]Nowycky MC,Fox AP,Tsien RW.Three types of neuronal calcium channel with different calcium agonist sensitivity[J].Nature,1985,316(6027):440-443.
[12]Grantham CJ,Main MJ,Cannell MB.Fluspirilene block of N-type calcium current in NGF-differentiated PC12 cells[J].Br J Pharmacol,1994,111(2):483-488.
[13]Fill M, Copello JA. Ryanodine receptor calcium release channels[J].Physiol Rev,2002,82(4):893-922.
[14]Foskett JK,White C,Cheung KH,Mak DO.Inositol trisphosphate receptor Ca2+release channels[J].Physiol Rev,2007,87(2):593-658.
