Toll样受体4/NF-κB信号通路参与黄芪多糖对肿瘤坏死因子α诱导的乳大鼠心肌细胞肥大的抑制作用
2013-11-12梁灵君王洪新孙雪芳喻晓春鲁美丽顾洁莹何海洋
梁灵君,王洪新,孙雪芳,喻晓春,鲁美丽,顾洁莹,何海洋
(1.辽宁医学院药物研究所心血管药物研究重点实验室,辽宁锦州 121001;2.中国中医科学院实验中心,北京 100700)
黄芪是一味药用历史悠久、临床应用广泛的传统补益类中药。黄芪多糖(Astragalus polysaccharide,APS)是从中药黄芪中分离提纯的主要有效成分之一。APS具有抗应激、抗氧化、抗自由基和降血糖等药理作用[1],对体外异丙肾上腺素[2](isoprenaline,Iso)和脂多糖[3](lipopolysaccharide,LPS)诱导的心肌肥大有一定的抑制作用。研究发现,Toll样受体4(Toll-like receptor 4,TLR4)介导的信号通路在心力衰竭、动脉粥样硬化、心肌炎、心肌重构等心血管系统疾病的发生发展中起着重要的作用[4-5]。TLR4 活化可以上调 NF-κB 的表达,进而调控多种炎性因子、黏附因子等表达[6]。TLR4/NF-κB信号转导通路的活化介导了众多炎性因子的表达,并且这些炎性因子参与了心肌损伤的反应并且在心肌肥大、心肌细胞凋亡、心肌收缩功能代偿的过程中起到重要的作用[7-8]。研究发现,肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)诱导的心肌肥大中,NF-κB[9]和 TLR4 的表达增加[10],然而 NF-κB 信号通路和 TLR4 是否参与APS对TNF-α诱导的心肌肥大的抑制,国内外尚未见报道。因此,本研究主要利用体外培养的模型,重点观察APS对TNF-α诱导的心肌肥大和炎症反应的影响,进一步研究APS抑制TNF-α诱导心肌肥大的信号转导机制。
1 材料与方法
1.1 药品和试剂
APS购自陕西森弗生物技术有限公司(批号:HQ090312),纯度为98%;白细胞介素1β(interleukin-1β,IL-1β)ELISA 试剂盒和 TNF-α 均购自R&D 公司;IκBα 阻断剂 BAY11-7082,IκBα 一抗,p65一抗和考马斯亮蓝法蛋白含量测定试剂盒购自江苏碧云天生物技术研究所;鼠抗兔二抗,二甲亚砜(DMSO)、胰蛋白酶和低糖DMEM培养基均购自Sigma公司;小牛血清购自Thermo公司;RT-PCR试剂盒、引物、标志物购自大连宝生物公司;其他试剂均为国产分析纯。
1.2 体外乳大鼠心肌细胞培养
出生1~3 d的SD大鼠乳鼠,♀♂兼用,由辽宁医学院动物实验中心提供,动物合格证号:SCXK(辽)2003-0007。在无菌条件下开胸取出心脏,D-Hank液冲洗3次后剪成约1 mm3大小的碎块,加入0.8 g·L-1胰蛋白酶消化,取消化完毕的细胞,加入体积分数为0.15的小牛血清、0.84的DMEM培养基及0.01的含双抗液(100 kU·L-1青霉素,100 mg·L-1链霉素)的培养基,吹打均匀后,采用差速贴壁的方法获得较纯的心肌细胞,然后根据实验所需要的密度接种,5%二氧化碳及95%氧气的孵箱中培养。
1.3 细胞分组及处理
常规培养心肌细胞2 d后换液,为了避免血清成分对实验结果的影响,更换为含体积分数为0.0004的小牛血清培养基。按照处理细胞共分为7组:正 常 对 照 组,TNF-α 50 μg·L-1组,BAY11-70825 μmol·L-1组,TNF-α +BAY11-7082组,TNF-α +APS 25,50 和100 mg·L-1组,加入药物作用30 min后,再加TNF-α共同作用48 h之后进行各指标的测定。
1.4 考马斯亮蓝法[11]测定细胞的总蛋白含量
取“1.3”处理的各组细胞,用D-Hank溶液冲洗 3 遍,加 0.5 ml NaOH(0.3 mol·L-1),置100℃,30 min,使细胞裂解。根据计数,每孔细胞数约为5×105个,采用考马斯亮蓝法测定细胞的总蛋白含量。
1.5 培养心肌细胞体积的测定
取“1.3”处理的各组细胞,PBS溶液快速冲洗长满细胞的培养孔3次,每孔加入0.1 g·L-1的胰酶0.3 ml,放入37℃恒温箱中孵育10 min,随后每孔加入含 0.1 g·L-1血清的培养基 0.2 ml终止消化。收集细胞注入一细胞室内(该细胞室底部是一经硅化的盖玻片,防止心肌细胞贴壁),在放大400倍的倒置显微镜下观察细胞,几乎呈球形,每组随机选取4个视野,每个视野测20个细胞,用计算机CIAS大恒细胞图像分析系统测量单个细胞的直径,然后用球的体积公式计算细胞的体积。
1.6 Western印迹法测定心肌细胞 IκBα和 p65蛋白表达
用细胞刮刀刮下“1.3”处理的各组细胞,用PBS冲洗下来,离心,弃上清,收集沉淀的细胞冷藏于 -80℃冰箱备用。测定指标时取出样品加入100 μl RIPA裂解液,用超声波破碎仪破碎细胞(冰上操作),10 s/次,共3次,在冰上放置30 min后,4℃12000×g离心30 min,提取上清液。BCA法进行蛋白浓度测定,使上样量相同条件下计算每组应吸取的样品上清的体积,补以上样缓冲液使总为80 μl,再加 100 μl溴酚蓝染液煮沸 4 min。然后各取10 μl样品以及蛋白质标准品点样。变性SDS-聚丙烯酰胺凝胶90 V恒压电泳,半干法将蛋白转移至硝酸纤维素膜,封闭,洗膜,加入1∶600稀释的兔抗大鼠 IκBα和p65一抗,4℃杂交过夜,用洗膜液漂洗后加入 1∶1000稀释的二抗,摇床上杂交1 h,然后取出用TBST冲洗3遍,每次5 min,然后加ECL显色,上机检测。以β肌动蛋白为内标,用目标条带与内标条带的积分吸光度值(integrated absorbance,IA)的比值的百分率表示p65和 IκBα的相对表达水平。
1.7 RT-PCR法检测心肌细胞ANP和TLR4基因的表达
收集细胞加入Trizol试剂1 ml裂解,收集细胞裂解液,氯仿抽提,异丙醇沉淀,回收总RNA。以质量浓度为10 g·L-1的琼脂糖凝胶电泳和紫外分光光度计A260/A280鉴定RNA纯度和浓度。取约1 μg总RNA,进行逆转录。逆转录条件:30℃10 min,42℃ 30 min 95℃ 5 min。ANP 引物:上游:GGGCTCCTTCTCCATCAC,下 游:CCCTCAGTTTGCTTTTCA(198 bp)。TLR4引物:上游:CTATCATCAGTGTATCGGTG,下游:CAGTCCTCATTCTGGCTC(186 bp)。内参 GAPDH的引物:上游:AATGCATCCTGCCACCACCAACTGC,下游:GGAGGCCATGTAGTAGGCCATGAGGTC(550 bp)。PCR反应条件:94℃ 45 s,55℃ 50 s,72℃1 min 15 s。电泳结束后,置于凝胶成像系统进行观察,用凝胶图像分析系统软件对RT-PCR产物电泳条带进行密度分析。用凝胶图像分析系统软件GENETOOLS对RT-PCR产物电泳条带进行吸光度分析,根据ANP,TLR4和GAPDH吸光度分析结果比值,计算得到ANP和TLR4的相对表达量。
1.8 ELISA法检测细胞外液IL-1β含量
试剂盒平衡于室温20~25℃待用,取出96孔反应板,分别加入50 μl标本(或对照液或标准品)于反应孔里,吸取10 μl IL-1β抗体至反应孔里,室温下孵育1 h,吸出液体,洗板3次,加50 μl显色液,室温孵育15 min,每孔加入50 μl终止液。全自动酶标仪在450 nm波长读取吸光度值,绘制标准曲线,根据各标本A450nm在标准曲线上查得相应的浓度。
1.9 统计学分析
2 结果
2.1 APS对TNF-α诱导的乳大鼠心肌细胞蛋白含量和细胞体积的影响
表1结果显示,与正常对照组相比,TNF-α模型组心肌细胞总蛋白含量增加了52.8%,细胞体积增大了66.7%(P<0.01)。与模型组相比,APS 25,50和100 mg·L-1组,细胞蛋白质含量分别减少了12.9%,20.6%和24.4%(P<0.01)。细胞体积分别减小了 20.5%,24.7%和 30.1%(P<0.01)。BAY11-7082对正常心肌细胞蛋白含量和体积无影响,但可抑制TNF-α诱导的肥大心肌细胞的蛋白含量和细胞体积,分别减少27.3%和30.3%(P<0.01)。

Tab.1 Effect of Astragalus polysaccharide(APS)on cell size and protein content of cultured myocardial cells in neonatal rats induced by tumor necrosis factor-α(TNF-α)
2.2 APS对TNF-α诱导的乳大鼠心肌细胞IκBα和p65蛋白表达的影响
图1和表2结果显示,与正常对照组相比,TNF-α组p65蛋白表达明显增加了50.5%(P<0.01),IκBα 表达明显减少了43.1%(P<0.01)。与模型组相比,APS 25,50 和100 mg·L-1组 p65 蛋白表达明显减少,差异有统计学意义(P<0.05),IκBα蛋白表达明显增加,差异有统计学意义(P<0.05),BAY11-7082对正常心肌细胞p65和IκBα蛋白表达无影响,对TNF-α诱导的肥大心肌细胞的p65蛋白表达减少了 51.5%(P<0.05),IκBα 蛋白表达增加了48.5%(P<0.05)。
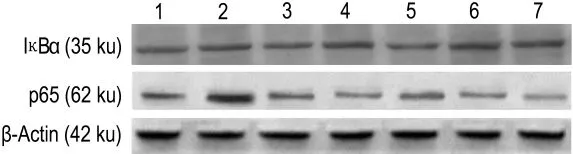
Fig.1 Effect of APS on inhibitor-κBα(IκBα)and p65 expression in cultured myocardial cells of neonatal rats induced by TNF-α by Western blotting.Lane 1:normal control group;lane 2:TNF-α 50 μg·L -1group;lane 3:BAY11-70825 μmol·L-1group;lane 4:TNF-α+BAY11-7082 group;lanes 5,6 and 7:TNF-α +APS 25,50 and 100 mg·L -1groups,respectively.
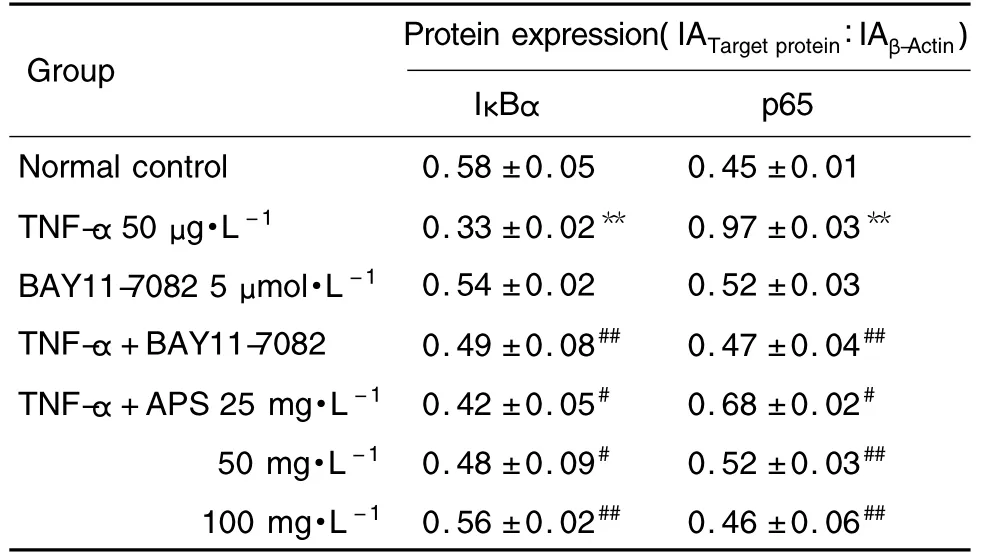
Tab.2 Effect of APS on IκBα and p65 expression in cultured myocardial cells of neonatal rats induced by TNF-α
2.3 APS对TNF-α诱导的乳大鼠心肌细胞ANP mRNA表达的影响
图2和表3结果显示,与正常对照组相比,TNF-α组ANP mRNA表达增多了60.3%(P<0.01)。与模型组相比,APS 25,50 和100 mg·L-1组 ANP mRNA明显下降,差异有统计学意义(P<0.05)。BAY11-7082对正常心肌细胞ANP mRNA无影响,但可抑制TNF-α诱导的ANP mRNA表达增加,差异有统计学意义(P<0.01),表明APS可以抑制TNF-α诱导心肌肥大ANP mRNA表达。
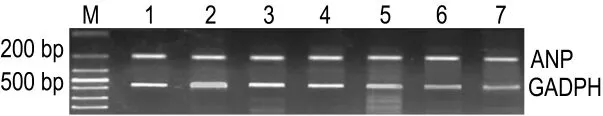
Fig.2 Effect of APS on atrial natriuretic peptide(ANP)mRNA expression in cultured myocardial cells of neonatal rats induced by TNF-α.M:marker.Lane 1:normal control group;lane 2:TNF-α 50 μg·L -1group;lane 3:BAY11-70825 μmol·L -1group;lane 4:TNF-α +BAY11-7082 group;lanes 5,6 and 7:TNF-α +APS 25,50 and 100 mg·L -1 groups,respectively.

Tab.3 Effect of APS on atrial ANP mRNA expression in cultured myocardial cells of neonatal rats induced by TNF-α
2.4 APS对TNF-α诱导的乳大鼠心肌细胞TLR4 mRNA表达的影响
图3和表4结果显示,与正常对照组相比,TNF-α组TLR4 mRNA表达增多了68.7%(P<0.01)。与模型组相比,APS 50和 100 mg·L-1组 TLR4 mRNA明显下降,差异有统计学意义(P<0.05),BAY11-7082对正常心肌细胞TLR4 mRNA表达无影响,对TNF-α诱导的肥大心肌细胞的TLR4 mRNA表达明显下降,差异有统计学意义(P<0.05)。

Fig.3 Effect of APS on Toll-like receptor 4(TLR4)expression in cultured myocardial cells of neonatal rats induced by TNF-α.M:marker.Lane 1:normal control group;lane 2:TNF-α 50 μg·L -1group;lane 3:BAY11-70825 μmol·L -1 group;lane 4:TNF-α +BAY 11-7082 group;lanes 5,6 and 7:TNF-α +APS 25 ,50 and 100 mg·L-1groups,respectively.
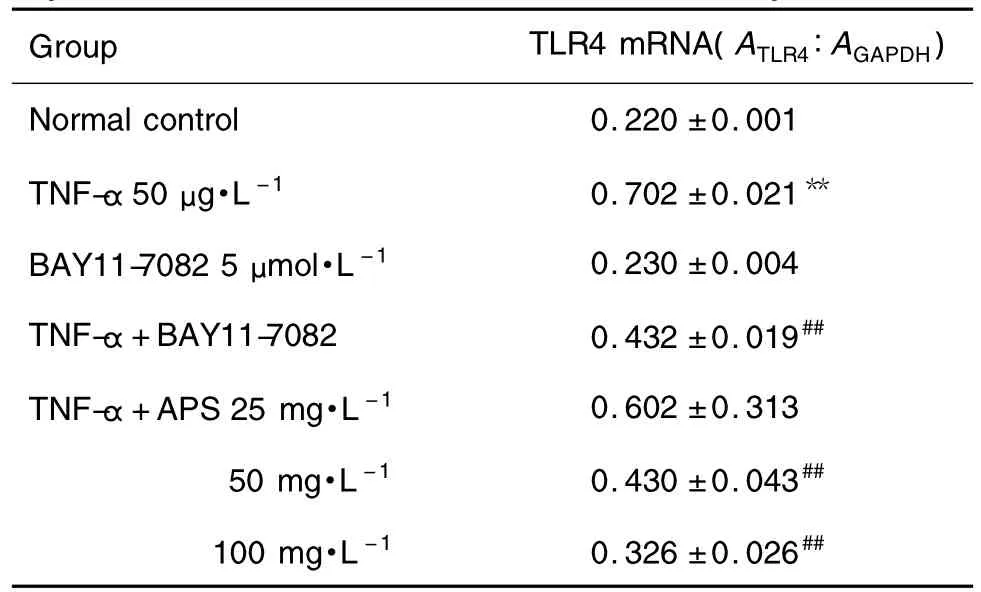
Tab.4 Effect of APS on TLR4 expression in cultured myocardial cells of neonatal rats induced by TNF-α
2.5 APS对TNF-α诱导的乳大鼠心肌细胞外液IL-1β含量的影响
表5结果显示,与正常对照组相比,TNF-α组细胞外液中IL-1β含量增加了59.0%(P<0.01);与模型组相比,APS 50 和 100 μg·ml-1组细胞外液中IL-1β含量明显减少,差异有统计学意义(P<0.05),BAY11-7082对正常细胞外液IL-1β表达无影响,对TNF-α诱导的肥大细胞外液IL-1β表达明显下降,差异有统计学意义(P<0.05)。

Tab.5 Effect of APS on interleukin-1β(IL-1β)expression in cultured myocardial cells of neonatal rats induced by TNF-α
3 讨论
心肌肥大是心脏对多种病理刺激产生的一种适应性反应,心肌肥大最终会因心脏功能失常导致心力衰竭,与心脏病的高死亡率密切相关[12]。虽然诱导心肌肥大的分子机制尚未完全明了,但最近研究显示,无论在动物模型[13]还是离体心肌细胞水平[14]上,抑制 TLR4/NF-κB 信号途径能有效抑制心肌肥大,提示TLR4/NF-κB信号通路是参与心肌肥大发生发展的一条重要的信号通路。
本研究发现,APS可以抑制 TNF-α诱导的心肌肥大,且其抑制作用与 IκBα特异性阻断剂BAY11-7082相似。同时还发现,APS不仅对TNF-α诱导的心肌肥大有抑制作用,而且还对TNF-α引起的炎性因子的表达有抑制作用。ELISA的结果显示,TNF-α能引起细胞外液中分泌的 IL-1β增多,APS能够有效抑制IL-1β炎性因子的分泌,保护心肌细胞。Western结果也显示,APS可以抑制TNF-α引起的 p65表达增加和IκBα的降解,从而抑制 NF-κB信号通路的激活,且结果与 BAY11-7082效果相似,提示 NF-κB信号通路可能参与APS对TNF-α诱导的心肌肥大的抑制作用。
TNF-α是一种具有多种生物学效应的炎性细胞因子,调节多种不同的病理过程,如肿瘤恶病质、感染性休克、自身免疫性炎症反应,也参与心血管疾病的发病[15]。TNF-α 的调控与 NF-κB[7]密切相关,细胞外刺激信号使体内 NF-κB活化,可以增强TNF-α的基因转录,促进后者的生存和表达;但是 TNF-α通过激活NF-κB信号通路,是否对TLR4的表达有影响,目前还没有清楚的报道。Shyu等[16]的体外研究结果提示 NF-κB不仅介导TLR4的下游细胞转导,而且可诱导TLR4的表达,所以TLR4和NF-κB之间也可能存在正反馈的调节。本实验RT-PCR结果显示,TNF-α能够引起TLR4的表达明显增加,表明TLR4和NF-κB之间可能真的存在正反馈的调节,但其具体具体机制尚不清楚,并且APS能够有效抑制TLR4的表达。
综上所述,APS可以抑制TNF-α诱导的心肌肥大,本研究对其机制进一步探索,发现APS可能通过抑制TLR4/NF-κB信号通路的激活,从而抑制TNF-α诱导的心肌肥大,但TLR4/NF-κB信号通路具体属何种机制抑制TNF-α的肥大效应尚需进一步研究。
[1]Shao BM,Xu W,Dai H,Tu P,Li Z,Gao XM.A study on the immune receptors for polysaccharides from the roots of Astragalus membranaceus,a Chinese medicinal herb[J].Biochem Biophys Res Commun,2004,320(4):1103-1111.
[2]Zhao SL,Wang HX,Zhou ZH,Yu XC,Lu ML,Song Y,et al.Protective effects of Astragalus polysaccharides on isoproterenol induced myocardial hypertrophy in neonatal rats[J].Chin Pharmacol Bull(中国药理学通报),2011,27(12):1682-1686.
[3]Zhou ZH,Wang HX,Zhao SL,Yu XC,Zhang J,Song Y.Protection of Astragalus polysaccharide on lipopolysaccharide-induced cardiac myocytes hypertrophy of rats[J].ChinTrad HerDrugs(中 草 药), 2012, 43(3):524-528.
[4]Timmers L, Sluijter JP, van Keulen JK,Hoefer IE,Nederhoff MG,Goumans MJ,et al.Toll-like receptor 4 mediates maladaptive left ventricular remodeling and impairs cardiac function after myocardial infarction[J].Circ Res,2008,102(2):257-264.
[5]Ha T, Li Y, Hua F, Ma J,Gao X,Kelley J,et al.Reduced cardiac hypertrophy in Toll-like receptor 4-deficient mice following pressure overload[J].Cardiovasc Res,2005,68(2):224-234.
[6]Avlas O,Fallach R,Shainberg A,Porat E,Hochhauser E.Toll-like receptor 4 stimulation initiates an inflammatory response that decreases cardiomyocyte contractility[J].Antioxid Redox Signal,2011,15(7):1895-1909.
[7]Hedayat M,Mahmoudi MJ,Rose NR,Rezaei N.Proinflammatory cytokines in heart failure:double-edged swords[J].Heart Fail Rev,2010,15(6):543-562.
[8]Frantz S,Kobzik L,Kim YD,Fukazawa R,Medzhitov R,Lee RT,et al.Toll4(TLR4)expression in cardiac myocytes in normal and failing myocardium[J].J Clin Invest,1999,104(3):271-280.
[9]Zhang C,Lin G,Wan W,Li X,Zeng B,Yang B,et al.Resveratrol,a polyphenol phytoalexin,protects cardiomyocytes against anoxia/reoxygenation injury via the TLR4/NF-κB signaling pathway[J].Int J Mol Med,2012,29(4):557-563.
[10]Higuchi Y,Otsu K,Nishida K,Hirotani S,Nakayama H,Yamaguchi O,et al.Involvement of reactive oxygen species-mediated NF-kappa B activation in TNF-alpha-induced cardiomyocyte hypertrophy[J].J Mol Cell Cardiol,2002,34(2):233-240.
[11]Marshall T,Williams KM.Determining total protein content of urine:centrifugation results in precipitation of the protein-coomassie brilliant blue dye complex[J].Clin Chem,1992,38(6):1186-1187.
[12]Rohini A,Agrawal N,Koyani CN,Singh R.Molecular targets and regulators of cardiac hypertrophy[J].Pharmacol Res,2010,61(4):269-280.
[13]Kawamura N,Kubota T,Kawano S,Monden Y,Feldman AM,Tsutsui H,et al.Blockade of NF-kappaB improves cardiac function and survival without affecting inflammation in TNF-alpha-induced cardiomyopathy[J].Cardiovasc Res,2005,66(3):520-529.
[14]Gupta S,Young D,Maitra RK,Gupta A,Popovic ZB,Yong SL,et al.Prevention of cardiac hypertrophy and heart failure by silencing of NF-kappaB[J].J Mol Biol,2008,375(3):637-649.
[15]Kleinbongard P,Schulz R,Heusch G.TNFα in myocardial ischemia/reperfusion,remodeling and heart failure[J].Heart Fail Rev,2011,16(1):49-69.
[16]Shyu KG,Wang BW,Lin CM,Chang H.Cyclic stretch enhances the expression of Toll-like receptor 4 gene in cultured cardiomyocytes via p38 MAP kinase and NF-kappaB pathway[J].J Biomed Sci,2010,17:15.
