蛇床子素通过激活过氧化物酶体增殖物激活受体α调节肝细胞内脂肪酸代谢
2013-11-12谢梅林
沈 洪,周 峰,薛 洁,谢梅林
(1.湖州师范学院医学院药理学教研室,浙江湖州 313000;2.苏州市第五人民医院药剂科,江苏苏州 215006,3.苏州大学药学院药理学系,江苏苏州 215123)
血液中的游离脂肪酸(free fatty acid,FFA)在脂肪酸转运蛋白(fatty acid transporter protein,FATP)和肝脂肪酸结合蛋白(liver fatty acid binding protein,L-FABP)作用下可被肝细胞摄取和转运。肝细胞也可以乙酰辅酶A为原料,在脂肪酸合酶(fatty acid synthase,FAS)作用下合成脂肪酸(fatty acid,FA),合成的FA又可在二脂酰甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)作用下进一步合成甘油三酯(triglycerides,TG);肝中的FA也可在肉碱软脂酰转移酶-1a(carnitine palmitoyltransferase-1a,CPT-1a)作用下促使 FA进行β氧化,使用于TG合成的FA减少。过氧化物酶体增殖物激活受体(peroxisome proliferatoractivated receptor,PPAR)α可以调控参与FA代谢的这些酶和转运体[1-5],而且 PPARα 也可通过调节固醇调节元件结合蛋白(sterol regulatory element-binding protein,SREBP),包括 SREBP-1和 SREBP-2 而抑制 FAS 的表达[6-7]。
蛇床子素(osthole)是一种香豆素类化合物,其化学名称为7-甲氧基-8-异戊烯基香豆素,广泛存在于伞形科植物蛇床子和独活等植物中。本课题组首先发现蛇床子素具有调节血脂和肝脂、明显减轻动物脂肪肝程度的作用[8-10],进一步的研究发现,蛇床子素可明显增加肝组织中PPARα/γ mRNA和蛋白的表达[11],提示蛇床子素可能通过激活肝细胞中PPARα而调节细胞中的TG和FA含量。为此本文利用PPARα选择性抑制剂,对PPARα介导的与FA代谢相关的上述这些基因的表达进行研究,以确定蛇床子素是否通过激活PPARα而发挥调节FA代谢的作用,为其将来的临床应用提供可靠的药理学依据。
1 材料与方法
1.1 药物与试剂
蛇床子素,白色粉末,纯度>98%,由西安绿泉生物技术有限公司提供。MK886,为PPARα选择性抑制剂[12],购自Cayman化学公司,纯度>99%。TG测定试剂盒,购自浙江伊利康生物技术有限公司。FFA和考马斯亮蓝蛋白测定试剂盒,购自南京建成生物工程研究所。Trizol,购自Invitrogen公司。M-MLV逆转录酶(2 ×108U·L-1),Taq 聚合酶(3 ×106U·L-1),dNTP(10 mmol·L-1)和DNA 100 bp marker,均购自Fermentas公司。琼脂糖购自 Biowest公司。RPMI 1640培养基和小牛血清,购自Gibco公司。本文所用引物均由上海生物工程科技有限公司合成,PPARα,SREBP-1/2,FAS,DGAT,CPT-1a,FATP4和L-FABP引物序列见表1。其余试剂均为分析纯。
1.2 细胞株
BRL大鼠肝细胞,由中科院上海细胞所提供。
1.3 主要仪器
二氧化碳培养箱(Heraeus公司),高速冷冻离心机(德国 Eppendorf公司),PCR仪(美国Bio-Rad公司),DYY-8B 型稳压稳流电泳仪和DYY-Ⅲ31D型电泳槽(北京市六一仪器厂),GELMate 2000型电泳系统(Toyobo Biotech公司),数码凝胶图像处理系统(GIS2008H,上海天能科技有限公司),722N型可见分光光度计(上海精密科学仪器有限公司)。
1.4 细胞分组处理
BRL大鼠肝细胞采用含10%小牛血清的RPMI 1640培养基培养,将细胞数调整为1×106ml-1后接种于6孔培养板中,每孔加2.0 ml细胞悬液,待细胞贴壁融洽后分为7组,即溶媒(0.1%DMSO)对照组,蛇床子素 12.5,25,50 和 100 μmol·L-1组,MK8861 μmol·L-1组,MK8861 μmol·L-1+蛇床子素 100 μmol·L-1组。MK886+ 蛇床子素组细胞先用 MK8861 μmol·L-1预处理2 h 后,再加入蛇床子素,在蛇床子素作用于细胞24 h后,按下述方法检测相应的指标。
1.5 比色法检测肝细胞内TG和FFA含量
收获细胞后,用PBS重复洗3次,加入PBS 500 μl后放入-80℃冰箱反复冻融3次,然后按照试剂盒说明书上提供的比色法进行测定细胞内TG和FFA的含量。
1.6 逆转录 PCR 法检测 PPARα,SREBP-1/2,FAS,DGAT,CPT-1a,FATP4 和 L-FABP mRNA表达
收获细胞后,按照试剂盒说明书上提供的方法提取总RNA,取2 μg用于逆转录至cDNA,按下列条件进行 PCR扩增:95℃变性5 min,继之95℃30 s、退火(退火温度见表1)30~45 s,72℃延伸40 s,共扩增30个循环,最后72℃延伸10 min。反应结束后用2%琼脂糖凝胶检测PCR产物,凝胶扫描图像采用Band Leader软件分析,计算与内参GAPDH的积分吸光度(integrated absorbance,IA)的比值。

Tab.1 Primers used in RT-PCR analysis
1.7 统计学分析
2 结果
2.1 蛇床子素对肝细胞内TG和FFA含量的影响
与溶媒对照组相比较,在给予蛇床子素12.5~100 μmo·lL-1作用24 h后,肝细胞内的TG和FFA水平随着蛇床子素浓度的增加均逐步降低(P<0.01)。如预先用 PPARα 抑制剂 MK8861 μmol·L-1处理 2 h 后,蛇床子素 100 μmol·L-1降低肝细胞内TG和FFA的作用则被明显减弱(P<0.01)。单用MK8861 μmol·L-1处理的肝细胞内 TG 和 FFA 水平反较溶媒对照组升高 (P<0.05,P<0.01)(表2)。
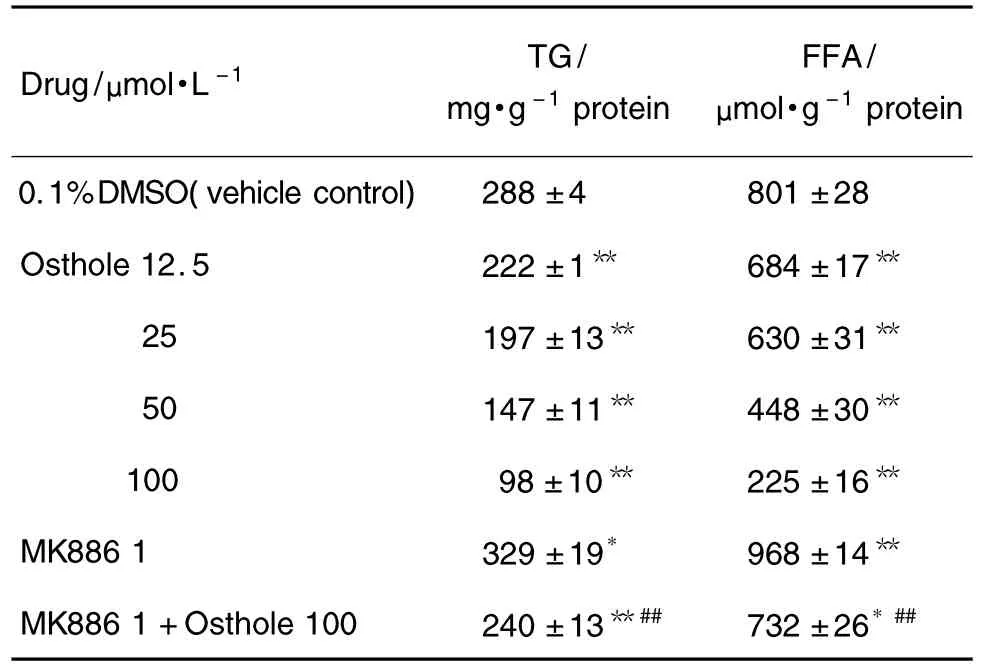
Tab.2 Effect of osthole on triglycerides(TG)and free fatty acid(FFA)contents in cultured rat hepatocytes
2.2 蛇床子素对PPARα mRNA表达的影响
结果如图1显示,与溶媒对照组相比较,在给予蛇床子素2.5~100 μmol·L-1作用 24 h 后,可见肝细胞内的PPARα mRNA表达水平随着蛇床子素浓度的增加逐步增多(P<0.01),并呈明显的剂量依赖趋势(r=0.95,P<0.05)。

Fig.1 Effect of osthole on PPARα mRNA expression in cultured rat hepatocytes.The cultured rat hepatocytes were treated with osthole for 24 h.The PPARα mRNA expression in hepatocytes was then determined by reverse transcription polymerase chain reaction.Lane 1:vehicle control;lane 2:osthole 12.5 μmol·L -1;lane 3:osthole 25 μmol·L -1;lane 4:osthole 50 μmo·lL-1;lane 5:osthole 100 μmol·L-1;M:marker.±s,n=4.**P<0.01,compared with vehicle control group.
2.3 蛇床子素对 MK886预处理的肝细胞中SREBP-1/2,FAS, DGAT,CPT-1a, FATP4 和L-FABP mRNA表达的影响
如图2~图4显示,与溶媒对照组相比较,肝细胞给予蛇床子素 100 μmol·L-1作用 24 h 后,其中的SREBP-1/2,FAS和DGAT mRNA的表达明显降低(P<0.01),而 CPT-1a,FATP4 和 L-FABP mRNA的表达明显增加(P<0.01)。若预先用PPARα 抑制剂 MK8861 μmol·L-1预处理 2 h 后,蛇床子素抑制SREBP-1/2,FAS和DGAT mRNA表达的作用则明显减弱或完全消失(P<0.01),蛇床子素增加 CPT-1a,FATP4 和 L-FABP mRNA 表达的作用也明显减弱或完全消失(P<0.01)。MK886本身对FAS和DGAT mRNA表达有促进作用(P<0.01),而对 FATP4 和 L-FABP mRNA表达有抑制作用(P<0.05或P<0.01)。
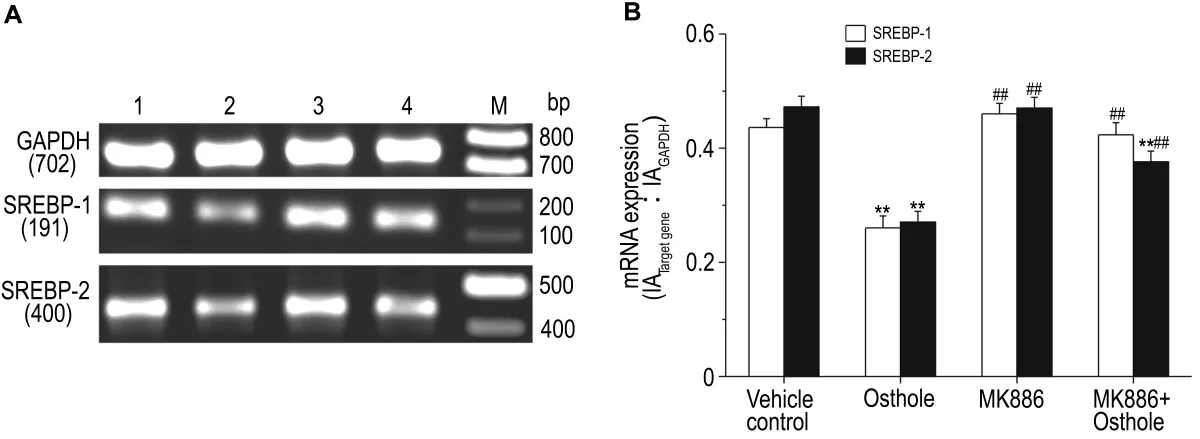
Fig.2 Effect of osthole on mRNA expressions of sterol regulatory element-binding protein-1/2(SREBP-1/2)in cultured rat hepatocytes pretreated with MK886.The hepatocytes were pretreated with MK886 for 2 h,osthole was then added and incubated with cells for 24 h.B was the semiquantitative result of A.Lane 1:vehicle control;lane 2:osthole 100 μmol·L -1;lane 3:MK8861 μmo·lL-1;lane 4:MK8861 μmol·L-1+osthole 100 μmol·L-1;M:marker.±s,n=4.**P<0.01,compared with vehicle control group;##P<0.01,compared with osthole 100 μmo·lL-1group.
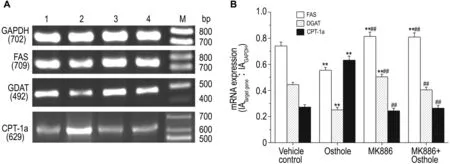
Fig.3 Effect of osthole on mRNA expressions of fatty acid synthase(FAS),diacylglycerol acyltransferase(DGAT),and carnitine palmitoyltransferase(CPT)-1a in cultured rat hepatocytes pretreated with MK886.See Fig.2 for the treatments.B was the semiquantitative result of A.Lane 1:vehicle control;lane 2:osthole 100 μmol·L -1;lane 3:MK8861 μmol·L -1;lane 4:MK8861 μmol·L -1+osthole 100 μmol·L -1;M:marker.±s,n=4.**P<0.01,compared with vehicle control group;##P<0.01,compared with osthole 100 μmol·L -1group.
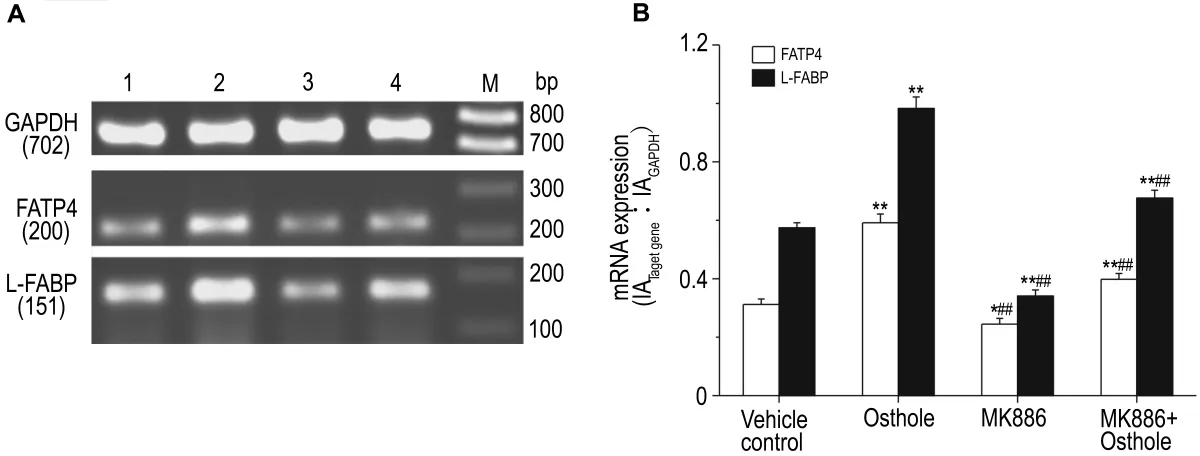
Fig.4 Effect of osthole on mRNA expressions of fatty acid transporter protein(FATP)4 and liver fatty acid binding protein(L-FABP)in cultured rat hepatocytes pretreated with MK886.See Fig.2 for the treatments.B was the semiquantitative result of A.Lane 1:vehicle control;lane 2:osthole 100 μmol·L -1;lane 3:MK8861 μmol·L -1;lane 4:MK8861 μmol·L -1+osthole 100 μmol·L -1;M:marker.±s,n=4.*P<0.05,**P<0.01,compared with vehicle control group;##P<0.01,compared with osthole 100 μmol·L -1group.
3 讨论
脂肪肝的主要病理特征是大量的TG在肝细胞内蓄积,但蓄积的TG对肝一般不会产生严重的毒性作用,反而由于TG的合成增加可降低肝内FA的蓄积而减少FA氧化所产生的活性氧自由基,从而可防止脂肪肝损伤的进一步发展[13-14],因此有学者认为FA在脂肪肝的发生和发展中起着极其重要的作用[15]。众所周知,肝中的PPARα主要参与调节肝脏的脂质代谢平衡[16]。作者先前的研究业已证明,蛇床子素可降低高脂饲养动物血及肝中的TG 和 FFA 含量[8-9,17],同时也可增加肝组织中的PPARα 表达[11],但蛇床子素 是 否通过作用于PPARα后介导相关靶基因而降低肝中的TG和FFA含量,仍尚不清楚。
本研究在体外培养的大鼠肝细胞上,发现蛇床子素可剂量依赖性地降低肝细胞中的TG和FFA含量,同时也能增加肝细胞中的PPARα mRNA表达。这一结果完全与动物体内的结果相一致[11]。为了进一步确定蛇床子素降低肝细胞内TG和FFA与激活PPARα的关系,我们观察了在用PPARα选择性抑制剂 MK886预处理情况下,蛇床子素对PPARα介导的相关靶基因的影响。结果表明,蛇床子素抑制SREBP-1/2、FAS和DGAT的mRNA表达的作用明显降低或完全消失,同样地,蛇床子素增加 CPT-1a、FATP4 和 L-FABP 的 mRNA 表达的作用也明显减弱或完全消失。这些结果提示蛇床子素降低肝中的 TG和 FFA含量,一方面与激活PPARα后抑制 SREBP-1/2及下游基因 FAS和DGAT表达作用有关,从而降低FA和TG的合成;另一方面也与激活PPARα后增加CPT-1a、FATP4和L-FABP表达作用后增强对FA的利用有关,从而使肝细胞中的FA和TG水平降低。
总之,蛇床子素降低肝中TG和FFA含量,主要可能与通过激活PPARα后随后抑制肝中FAS的表达而减少FA的合成,以及增加CPT-1a和抑制DGAT的表达后增强对FA的氧化利用有关。
[1]Kwon HJ,Hyum SH,Choung SY.Traditional Chinese Medicine improves dysfunction of peroxisome proliferatoractivated receptor alpha and microsomal triglyceride transfer protein on abnormalities in lipid metabolism in ethanolfed rats[J].Biofactors,2005,23(3):163-176.
[2]Ringseis R,Muschick A,Eder K.Dietary oxidized fat prevents ethanol-induced triacylglycerol accumulation and increases expression of PPARalpha target genes in rat liver[J].J Nutr,2007,137(1):77-83.
[3]Sun F, Xie ML, Xue J, Wang HB.Osthole regulates hepatic PPAR alpha-mediated lipogenic gene expression in alcoholic fatty liver murine[J].Phytomedicine,2010,17(8-9):669-673.
[4]Yong EL,Li J,Liu MH.Single gene contributions:genetic variants of peroxisome proliferator-activated receptor(isoforms alpha,beta/delta and gamma)and mechanisms of dyslipidemias[J].Curr Opin Lipidol,2008,19(2):106-112.
[5]Motojima K,Passilly P,Peters JM,Gonzalez FJ,Latruffe N.Expression of putative fatty acid transporter genes are regulated by peroxisome proliferator-activated receptor alpha and gamma activators in a tissue- and inducer-specific manner[J].J Biol Chem,1998,273(27):16710-16714.
[6]König B,Koch A,Spielmann J,Hilgenfeld C,Hirche F,Stangl GI,et al.Activation of PPARalpha and PPARgamma reduces triacylglycerol synthesis in rat hepatoma cells by reduction of nuclear SREBP-1[J].Eur J Pharmacol,2009,605(1-3):23-30.
[7]Knight BL,Hebbachi A,Hauton D,Brown AM,Wiggins D,Patel DD,et al.A role for PPARalpha in the control of SREBP activity and lipid synthesis in the liver[J].Biochem J,2005,389(Pt 2):413-421.
[8]Song F,Xie ML,Zhu LJ,Zhang KP,Xue J,Gu ZL.Experimental study of osthole on treatment of hyperlipidemic and alcoholic fatty liver in animals[J].World J Gastroenterol,2006,12(27):4359-4363.
[9]Zhang Y,Xie ML,Zhu LJ,Gu ZL.Therapeutic effect of osthole on hyperlipidemic fatty liver in rats[J].Acta Pharmacol Sin,2007,28(3):398-403.
[10]Sun F,Xie ML,Zhu LJ,Xue J,Gu ZL.Inhibitory effect of osthole on alcohol-induced fatty liver in mice[J].Dig Liver Dis,2009,41(2):127-133.
[11]Zhang Y,Xie ML,Xue J,Gu ZL.Osthole improves fat milk-induced fatty liver in rats:modulation of hepatic PPAR-alpha/gamma-mediated lipogenic gene expression[J].Planta Med,2007,73(8):718-724.
[12]Kehrer JP,Biswal SS,La E,Thuillier P,Datta K,Fischer SM,et al.Inhibition of peroxisome-proliferator-activated receptor(PPAR)alpha by MK886[J].Biochem J,2001,356(Pt 3):899-906.
[13]Yamaguchi K, Yang L, McCall S, Huang J, Yu XX,Pandey SK,et al.Inhibiting triglyceride synthesis improves hepatic steatosis but exacerbates liver damage and fibrosis in obese mice with nonalcoholic steatohepatitis[J].Hepatology,2007,45(6):1366-1374.
[14]Listenberger LL,Han X,Lewis SE,Cases S,Farese RV,Ory DS,et al.Triglyceride accumulation protects against fatty acid-induced lipotoxicity[J].Proc Natl Acad Sci USA,2003,100(6):3077-3082.
[15]Verna EC,Berk PD.Role of fatty acids in the pathogenesis of obesity and fatty liver:impact of bariatric surgery[J].Semin Liver Dis,2008,28(4):407-426.
[16]Reddy JK.Nonalcoholic steatosis and steatohepatitis.Ⅲ.Peroxisomal beta-oxidation,PPAR alpha,and steatohepatitis[J].Am J Physiol Gastrointest Liver Physiol,2001,281(6):G1333-G1339.
[17]Du R,Xue J,Wang HB,Zhang Y,Xie ML.Osthol ameliorates fat milk-induced fatty liver in mice by regulation of hepatic sterol regulatory element-binding protein-1c/2-mediated target gene expression[J].Eur J Pharmacol,2011,666(1-3):183-188.
