适用于黄酒生物酸化浸米的乳酸菌筛选
2013-11-09周高峰谢广发
程 斐 , 周高峰 , 谢广发 , 陆 健 , 曹 钰 *
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122;3.浙江古越龙山绍兴酒股份有限公司,浙江 绍兴 312000;4.江南大学 粮食发酵工艺及技术国家工程实验室,江苏 无锡 214122)
黄酒具有6 000多年的酿造历史,它含有21种氨基酸和多种维生素成份以及许多种人体必需的微量元素,是一种具有很高营养价值的低酒精度饮料酒[1]。在黄酒酿造中,浸米是一个重要环节,它不仅能使原料大米充分吸水膨胀便于蒸煮,更可以使米酸化,以调节发酵醪液的酸度,保障发酵的安全进行。传统黄酒酿造,浸米时间长,如传统摊饭法酿酒,浸米时间长达16~20 d。在机械化黄酒生产工艺中采用较高温度条件保温浸渍,浸米时间缩短,但仍然需要4~5 d[2]。浸米过程不当是引起黄酒发酵醪酸败的主要原因之一。而浸米的质量随米质、浸米环境等波动较大,这就导致了浸米环节的稳定性较差[3]。目前对于黄酒生产中浸米环节的研究远远少于其他酿造环节,主要集中于浸米水中微生物的认识,浸米控制经验的总结以及不同品种米浸米特性的研究[4-7]。
生物胺是生物体内产生的一类低相对分子质量含氮有机化合物的总称。过量外源生物胺的摄入会引起血管、动脉和微血管的扩大,导致生物体的不良反应。酒生产过程中,乳酸菌分泌的氨基酸脱羧酶作用于氨基酸会产生生物胺[8]。而使用既无氨基酸脱羧酶活性,又能产生抑菌物质的生产菌株,能达到控制生物胺含量的目的[9-10]。
作者采用乳酸菌的快速筛选方法,从黄酒酿造环节的样品中分离筛选出能在浸米水中快速产酸,具有较广的抑菌作用,且生物胺反应阴性的菌株,来实现生物酸化浸米,快速提高米浆水的酸度,缩短浸米时间,并抑制杂菌的生长,提高浸米过程的稳定性,且有效的降低米浆水中生物胺含量。
1 材料与方法
1.1 材料
1.1.1 样品 糯米:购于无锡小三里桥粮油市场;浸米水:绍兴古越龙山酒厂机械化酿造工艺和传统酿造工艺不同浸米时间的浸米水样品;酒药和酒曲:古越龙山酒厂提供。
1.1.2 培养基 MRS培养基,LB培养基[11],高锰酸钾-溴化钾平板[12],生物胺菌株活化培养基,液体脱羧酶培养基[13]。
1.2 方法
1.2.1 乳酸菌的分离 取不同来源的糯米,以料液比 1 kg∶1.5 L 于 30 ℃浸渍 24、48、72 h。 通过稀释分离培养的方法,涂布于MRS平板上,30℃恒温厌氧培养36 h,覆盖上KMnO4-KBr琼脂,30℃放置6 h,选取透明圈直径与菌落直径比较大的菌落[12],进行革兰氏染色、接触酶反应和葡萄糖产气实验[11],选取革兰氏阳性,接触酶反应阴性,葡萄糖产气阴性的菌株进行保藏,进行下步实验。
古越龙山酒厂取样浸米水,按上述步骤分离。
取酒药和酒曲于添加有20 mg/L制霉菌素的MRS液体培养基中富集培养后,按上述步骤分离。
1.2.2 生长和产酸实验 菌株以5%的接种量接入液体MRS培养基中,30℃培养,测培养24 h时的pH值、总酸和A600nm,每株菌3个平行。
1.2.3 浸米水产酸实验 种子液的制备:将活化的乳酸菌以5%的接种量接入MRS培养基中,30℃静置培养16 h,8 000 r/min离心10 min,弃上清,加入无菌水重悬菌种;浸米:取糯米于250 mL锥形瓶中,以料液比1 kg∶1.5 L加入水,以体积分数1%的接种量接入乳酸菌种子液,28℃培养48 h,过滤后测量浸米水的pH值和总酸,每株菌3个平行。
1.2.4 乳酸菌的抑菌实验[14-15]乳酸菌发酵液的制备:将活化的乳酸菌接入加有质量分数1%CaCO3的MRS培养基中,30℃静置培养48 h。发酵液以10 000 r/min离心10 min,取上清。
指示菌菌悬液制备:接种大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌于LB液体培养基,37℃过夜培养。用无菌水稀释成105个/mL菌悬液,4℃保存待用。
抑菌试验:取指示菌菌悬液涂布于LB平板上,放置牛津杯于平板上,在牛津杯里加入200 μL菌株发酵液,置于4℃冰箱中12 h,37℃静置培养16 h,观察抑菌圈的大小。
1.2.5 乳酸菌产生物胺能力实验 将菌株在菌株活化培养基中活化4次。然后接种于液体脱羧酶培养基,30℃培养4 d后,观察颜色变化。做3组平行,以空白培养基对照。
1.2.6 16S rRNA分子生物学鉴定 提取DNA后,进行16S rRNA扩增[16],PCR产物经琼脂糖凝胶电泳分析。由上海生物工程有限公司进行序列测定。根据测序所得的16S rRNA全序列在NCBI网站上进行Blast比对后,选取GenBank中同源乳酸菌菌株序列,构建系统发育进化树。
1.2.7 菌株生理特性研究 活化后的菌种以体积分数5%的接种量接入液体MRS培养基中,30℃培养,每隔3 h取样,测定pH值、总酸和A600nm,绘制产酸曲线和生长曲线,每组3个平行。
1.2.8 生物酸化浸米 取糯米于锥形瓶中,以料液比1 kg∶1.5 L加入水,以体积分数1%的接种量接入乳酸菌种子液 (与不接种的进行对照),28℃培养48 h,观察浸米的品质和浸米水的状态。过滤,取浸米水,测pH值和总酸以及生物胺含量[17-18]。
2 结果与分析
2.1 乳酸菌的分离
MRS平板上覆盖KMnO4-KBr琼脂后,选取(D透明圈/D菌落)数值大的菌株,纯化后得到160株乳酸菌疑似菌株。其中革兰氏阳性,接触酶反应阴性,葡萄糖产气阴性的菌株78株。
2.2 生长和产酸实验
测上述78株菌30℃培养24 h后的pH值、总酸以及A600nm值,选取酸度在18 g/L以上,A600nm值5.0以上,pH值低于3.5的菌株,共得到10株菌。
2.3 浸米水产酸实验
将10株菌进行生物酸化浸米实验,测浸米48 h的pH和总酸,结果见图1。
比较接种10株菌浸米48 h后浸米水的pH值和酸度,pH值均在3.4左右,差异性很小。酸度达到10 g/L 的有 B131、B94、B99、B142、B125、B101。
2.4 抑菌试验
采用牛津杯琼脂扩散法做抑菌试验,测量不同受试菌上抑菌圈的直径(结果为3次平行实验的平均值),结果如表1。

表1 乳酸菌发酵产物的抑菌效果Table 1 Inhibitory effect of lactic acid bacteria fermentation product
由于发酵培养基中加入质量分数1%CaCO3,能充分中和乳酸,测离心后发酵液上清的pH值,均在5.0以上,可以排除乳酸对受试菌株的抑制作用,抑菌圈大小能较好的反映出菌体产生抑菌物质的能力。B94和B101的发酵液对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌的生长均有较好的抑制作用,B125对3种受试菌株都没有抑制作用,B99、B131和B142对部分受试菌株有一定的抑制作用。
2.5 乳酸菌产生物胺能力试验
观察液体脱羧酶培养基颜色变化:菌株不产生生物胺,则培养基呈现黄色,为阴性结果。菌株产生生物胺,培养基呈现紫色或者紫红色,为阳性结果。从表2中可以看出,B101在加入组氨酸、鸟氨酸、赖氨酸、苯丙氨酸、酪氨酸的液体脱羧酶培养基中不产生物胺,其他几株菌均有生物胺产生。
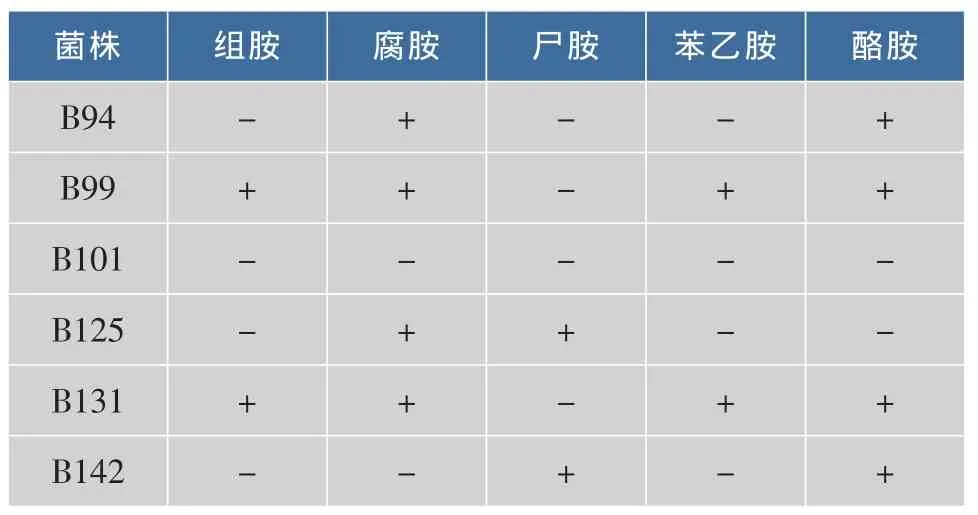
表2 测试菌产生物胺情况Table 2 Strains activity of producing BA
综合浸米水产酸、抑菌试验和生物胺产生试验,B101是一株适合生物酸化浸米菌株。
2.6 序列分析和系统发育树的构建
以通用引物进行PCR扩增,经体积分数1%琼脂糖凝胶电泳,得到约1 500 bp的扩增产物(图2)。将B101菌株的16S rRNA序列结果输入GenBank用Blast软件进行序列同源性比较,用MEGA5软件对测序结果与同源种属代表菌株的的16S rRNA采用Neighbour-Joining法构建系统发育树 (图3),B101与Lactobacillus plantarum subsp.plantarum strain ST-Ⅲ亲缘关系最近,可初步确定B101号菌株为Lactobacillus plantarum。

图2 B101的16S rRNA的PCR产物电泳图Fig.2 Electrophoresis of PCR products of 16S rRNA of B101
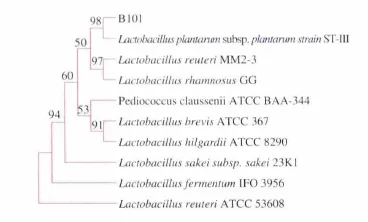
图3 B101的系统发育进化树Fig.3 Phylogenetic tree based on the complete 16S rRNA sequence of strain B101
2.7 菌株生理特性研究
将B101以体积分数5%的接种量接入MRS培养基中,每隔3 h取样,测其pH值、A600nm和总酸,绘制产酸曲线和生长曲线,结果见图4。
从图4中可以看出pH值在0~12 h迅速下降,12~21 h下降速度缓慢,21 h后保持稳定在3.6左右;0~12 h产酸速度较快,之后酸度增加较慢,到33 h后基本保持不变。B101的菌体量在培养了12 h后达到最大值,12~18 h菌体量基本不变,18h后略微降低。

图4 L.plantarum B101的pH变化、生长、产酸曲线Fig.4 Growth curves、ability of producing acid and pH changes of L.plantarum B101
生长初期,培养基中营养成分丰富,生长条件适宜,菌体迅速生长,产酸速度也较快。随着菌体的生长,营养物质被消耗,乳酸的产生,降低了生长环境的pH值,菌体的生长受到抑制,产酸速度也减缓。18 h时发酵液中的pH降低到3.7左右,受pH的影响,乳酸菌出现菌体的自溶,菌浓降低,产酸速度缓慢。
2.8 生物酸化浸米
使用B101进行生物酸化浸米。如图5所示,左为自然浸米,右为接种的生物酸化浸米。自然浸米的浸米水气味不宜,表面出现了较多的泡沫,而且出现了“白花”状物质,显微镜下观察“白花”为丝状真菌;生物酸化浸米的浸米水品质比较均一,无泡沫和“白花”出现,而且气味比较宜人。

图5 自然浸米与生物酸化浸米的比较Fig.5 Comparison of natural soaking and biological acidification soaking with LAB
由表3可以看出,生物酸化浸米浸米水pH值明显低于自然浸米,酸度明显高于自然浸米;通过平行样品中的误差分析可以看出,生物酸化浸米,各个平行间波动小,稳定性良好,而自然发酵浸米过程控制相同的发酵条件,稳定性较差。添加乳酸菌进行生物酸化浸米可以加快米浆水升酸速度,且在一定程度上解决自然发酵浸米过程中稳定性差的问题。
由表4可以看出,使用生物酸化浸米,浸米水中腐胺和尸胺的质量浓度明显降低,总的生物胺质量浓度降低了52.7%。

表3 浸米水总酸质量浓度和pH值Table 3 pH and acidity of seriflux

表4 浸米水中生物胺质量浓度Table 4 Mass concentration AB in seriflux(mg/L)
3 结语
从黄酒酿造环节的样品中分离筛选得到优良乳酸菌B101,经16S rRNA寡核苷酸碱基序列分析鉴定菌株为植物乳酸菌。此菌具有较广的抑菌作用,且生物胺反应阴性,其在生物酸化浸米过程中可以快速提高米浆水的酸度,缩短浸米时间,并抑制杂菌的生长,提高浸米过程的稳定性,且有效的降低米浆水中生物胺质量浓度,是一株极具工业生产应用价值的生物酸化菌株。
[1]方心芳.中国酒文化和中国名酒[M].北京:中国食品出版社,1989.
[2]谢广发.黄酒酿造技术[M].北京:中国轻工业出版社,2010.
[3]毛青钟,俞关松.黄酒生产中不同品种米浸米特性的研究[J].酿酒,2010,37(4):70-73.MAO Qing-zhong,YU Guang-song.Different varieties of Chinese rice wine production characteristics of rice-dip-meter[J].Liquor Making,2010,37(4):70-73.(in Chinese)
[4]汪建国,汪陆翔.大米品种和品质与黄酒酿造关系的探讨[J].中国酿造,2006,9:60-63.WANG Jian-guo,WANG Lu-xiang.Discussion on the relationship between rice and rice wine brewing[J].China Brewing,2006,9:60-63.(in Chinese)
[5]毛青钟.黄酒浸米浆水及其微生物变化和作用[J].酿酒科技,2004,3:73-76.MAO Qing-zhong.Seriflux of yellow rice wine and its microbe change and functions[J].Liquor-making Science and Technology,2004,3:73-76.(in Chinese)
[6]杨百荣.绍兴黄酒生产中米浆酸的控制[J].酿酒科技,2001,6:110-113.YANG Bai-rong.Control of serous acid in the production of Shaoxing yellow rice wine[J].Liquor-making Science and Technology,2001,6:110-113.(in Chinese)
[7]毛青钟,陈细丹.黄酒浸米浆水表面微生物的研究[J].江苏调味副食品,2009,26(3):19-21.MAO Qing-zhong,HEN Xi-dan.Research on the surfacem icroorganism in the seriflux of yellow rice wine[J].Jiangsu Condiment and Subsidiary Food,2009,26(3):19-21.(in Chinese)
[8]SIMT A Y,DU TOIT W J,DU TOIT M.Biogenic amines in wine:understanding the headache[J].South African Journal for Enology and Viticulture,2008,29(2):109-127.
[9]JOOSTEN H,NUNEZ M.Prevention of histamine formation in cheese by bacteriocin-producing lactic acid bacteria[J].Applied and Environmental Microbiology,1996,62(4):1178-1181.
[10]HERRERO-FRESNO A,MATINEZ N,SANCHEZ-LLANA E,et al.Lactobacillus casei strains isolated from cheese reduce biogenic amine accumulation in an experimental model[J].International Journal of Food Microbiology,2012,157(2):297-304.
[11]张刚.乳酸细菌:基础、技术和应用[M].北京:化学工业出版社,2007:450-451.
[12]蒋雪薇,盛灿梅,周倩,等.琼脂块法快速平板初筛米根霉L-乳酸高产菌[J].食品与机械,2010,26(3):8-10.JIANG Xue-wei,SHENG Can-mei,ZHOU Qian et al.A rapid plate selection method for L-lactic acid producing strain of rhizopus oryzae with agar block[J].Food and Machinery,2010,26(3):8-10.(in Chinese)
[13]孟甜.乳酸菌产生物胺的鉴定及食品中生物胺的检测[D].无锡:江南大学,2009.
[14]CASLA D,REQUENA T,GOMEZ R.Antimicrobial activity of lactic acid bacteria isolated from goats,milk and artisanal cheeses:characteristics of a bacteriocin produced by Lactobacillus curvatus IFPL105[J].Journal of Applied Microbiology,1996,81(1):35-41.
[15]GAO Y,JIA S,GAO Q,et al.Novel bacteriocin with a broad inhibitory spectrum produced by Lactobacillus sake C2,isolated from traditional Chinese fermented cabbage[J].Food Control,2010,21(1):76-81.
[16]张中华,管政兵,梁小刚,等.PCR-DGGE分析绍兴黄酒麦曲中细菌群落方法的建立[J].食品工业科技,2012,33(14):206-213.ZHANG Zhong-hua,GUAN Zheng-bing,LIANG Xiao-gang,et al.Establishment of PCR-DGGE for analysing the bacterial community of Shaoxing rice wine wheat Qu[J].Science and Technology of Food Industry,2012,33 (14):206-213. (in Chinese)
[17]PINEDA A,CARRASCO J,PENA-FARFAL C,et al.Preliminary evaluation of biogenic amines content in Chilean young varietal wines by HPLC[J].Food Control,2012,23(1):251-257.
[18]赵庆喜,薛长湖,徐杰,等.反相高效液相色谱-柱后衍生法分析检测鱿鱼中的生物胺[J].食品与生物技术学报,2007,26(3):14-19.ZHAO Qing-xi,XUE Chang-hu,XU Jie,et al.Determination of biogenic amines in squid by reversed phase high-performance liquid chromatography and post-column derivatization[J].Jounal of Food Science and Biotechnology,2007,26(3):14-19.(in Chinese)
