乙醇对简单节杆菌生长、生理特性和细胞结构的影响
2013-11-08刘莉娜骆健美
宁 静,刘莉娜,王 敏,骆健美
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
有机介质微生物转化技术是近年来疏水性化合物生物转化领域的研究热点.添加有机溶剂增强底物的溶解对于提高生物转化效率具有正向作用,但高浓度有机溶剂对细胞的毒害作用却成为限制其使用剂量的重要障碍[1–2].研究表明[3–5],有机溶剂积累在细胞膜上,通过影响膜的理化性质,例如,影响细胞膜作为屏障和能量传导的功能,导致胞内大分子的渗透(如RNA、磷脂和蛋白质),同时也可能改变细胞膜结构,导致微生物代谢被阻断,生长受到抑制,甚至导致细胞死亡.
甾体化合物C1,2 脱氢反应是工业上采用微生物转化法生产甾体药物的典型反应,也是生产氢化泼尼松及其同系物最有价值的反应.其中,简单节杆菌(Arthrobacter simplex)以专一性高、反应速率快等优点成为工业生产普遍使用的生产菌株.甾体化合物的全细胞生物转化反应多采用添加有机溶剂的方法促进疏水性底物的溶解[6–7].课题组在前期工作中,考察了4 种有机溶剂(乙醇、DMF、DMSO、甲醇)对简单节杆菌TCCC 11037,C1,2 脱氢反应的影响,结果表明4 种有机溶剂均能提高简单节杆菌生物转化醋酸可的松的初始转化速率和最终转化率,其中乙醇的效果最好[8].进一步分析了乙醇对菌体生长和细胞性质的影响,结果发现随着乙醇浓度的增加,菌体的生长和一些细胞性质如跨膜电位和细胞通透性均发生明显变化[9].
课题组以简单节杆菌TCCC 11037 为出发菌株,通过紫外诱变结合高浓度乙醇驯化的方法选育得到1个突变菌株TCCC 11037-UV15X1-2,通过固体平板实验,确定突变菌株TCCC 11037-UV15X1-2 对乙醇的耐受体积分数为10%,且具有较好的遗传稳定性.本文以这两个乙醇耐性差异菌株为对象,分析其在不同乙醇浓度下的生长特性.同时为了降低菌体生长过程的干扰,采用静息细胞,考察乙醇处理对细胞存活率的影响,并进一步分析了细胞糖代谢能力、细胞膜电位、细胞超显微结构和通透性的变化.该工作为深入了解简单节杆菌在有机溶剂下的细胞性质变化,进而探讨其耐性机制奠定了一定的理论基础,为选育耐受高浓度有机溶剂的C1,2 脱氢反应菌株提供科学指导.
1 材料与方法
1.1 材料
1.1.1 菌株与培养基
简单节杆菌(Arthrobacter simplex)出发菌株TCCC 11037(全文简称TCCC 11037)和突变菌株TCCC 11037-UV15X1-2(全文简称UV15X1-2),天津科技大学微生物制药研究室保存.
斜面/固体平板培养基见参考文献[10].
菌体培养基(无机盐培养基)(g/L):葡萄糖5,KH2PO40.875,K2HPO40.175,(NH4)2SO41,MgSO4·7H2,O 0.5,NaCl 0.1,CaCl2·5H2O 0.1,CuSO4·5H2O 0.04,KI 0.1,FeCl3·6H2O 0.2,MnCl2·4H2O 0.4,ZnSO40.4,(NH4)2,MoO40.2,pH 7.0~7.2.
1.1.2 主要试剂及仪器
罗丹明 123(Rh123)、二乙酸荧光素(FDA),Sigma 公司;其他试剂均为国产分析纯.
JSPM–5200 型原子力显微镜,日本日立公司;F–5301PC 型荧光分光光度计,日本岛津公司;SBA–90型生物传感仪,山东省科学院生物研究所.
1.2 方法
1.2.1 菌体生长曲线的绘制
从保存的斜面上挑取 1 环菌体接种于装有30,mL 菌体培养基的250,mL 三角瓶中,160,r/min、32,℃进行一级培养,培养36,h 菌体生长进入对数中后期(此时A600=1.8),以10%接种量将培养液转接到相同的菌体培养基中,160,r/min、32,℃进行二级培养,培养过程中每间隔一定时间取样,测定培养液的A600值,以时间(t)为横坐标,A600为纵坐标,绘制菌体生长曲线.
1.2.2 乙醇条件下菌体的生长特性
分别向上述二级培养到对数中后期的培养液中加入体积分数为 2%、6%、10%的乙醇,32,℃、160,r/min 继续培养,24,h 和72,h 后分别取样,测定菌体的A600.
1.2.3 乙醇对细胞的处理过程
收集二级培养到对数中后期的菌体细胞,用PBS缓冲溶液(pH 7.0)洗涤3 次并重悬,调节菌体浓度使A600为1.8,制备成静息细胞悬浮液.将上述菌体悬浮液分成若干等份,每份25,mL.向每份中加入乙醇,使其终体积分数为2%、6%、10%,160,r/min、32,℃振荡处理0.5,h 后,8,000,r/min 离心5,min,收集菌体,用PBS 缓冲溶液洗涤3 次并重悬,进行以下参数的测定.其中,未经乙醇处理的细胞作为对照组.
1.2.4 细胞存活率的测定
采用平板活菌计数法测定细胞的存活率[9].
1.2.5 糖活力保留值的测定
向离心收集后的菌体细胞中加入10,g/L 葡萄糖水溶液,160,r/min、32,℃条件下继续培养4,h 后,取1,mL 样品,用生物传感仪测定葡萄糖浓度.糖活力保留值(R)按照式(1)计算.

1.2.6 细胞膜电位测定
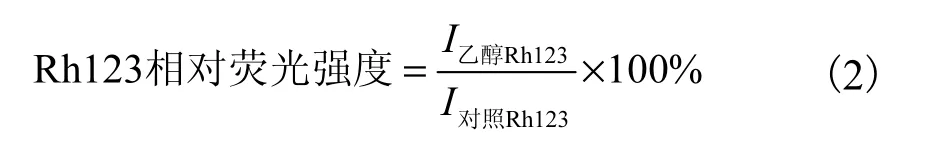
采用Rh123 荧光探针法测定细胞膜电位[11],通过测定对照组的Rh123 荧光强度(I对照Rh123)和乙醇处理后的Rh123 荧光强度(I乙醇Rh123),按照式(2)计算Rh123 的相对荧光强度.
1.2.7 细胞超显微结构的观察
菌体细胞经无菌水洗涤2 次,按照文献[8]的方法制备样品并观察.
1.2.8 细胞通透性的测定
采用FDA 荧光探针法[11]测定细胞膜对胞外小分子物质FDA 的通透性.通过测定对照组的FDA 荧光强度(I对照FDA)和乙醇处理后的FDA 荧光强度(I乙醇FDA),按照式(3)计算FDA 的相对荧光强度.

同时,通过测定蛋白质和核酸的泄漏量[12]来反映细胞膜对胞内大分子物质的通透性.
2 结果与讨论
2.1 耐性差异菌株菌体的生长特性
图1 表示的是两个菌株在菌体培养基中的生长曲线.由图1 可知,出发菌株TCCCC 11037 和突变菌株UV15X1-2 的生长规律基本一致:0~12,h 为延滞期,12~36,h 为对数期,36,h 之后进入稳定期.但两个菌株的生长速率与A600却不尽相同,在对数生长期(12~36,h),突变菌株UV15X1-2 的生长速率明显高于出发菌株TCCCC 11037,分别为0.183,h-1和0.161,h-1.此外,培养72,h 后,突变菌株UV15X1-2和出发菌株TCCC 11037 的A600均达到了最大值,分别为0.796 和0.675,前者比后者增加了17.9%,说明在不添加乙醇的无机盐培养基中进行生长,突变菌株UV15X1-2 能够比出发菌株TCCC 11037 表现出更好的生长特性.

图1 出发菌株TCCC 11037 和突变菌株UV15X1-2 的生长曲线Fig.1 Growing curves of TCCC 11037 and UV15X1-2
在两个菌株生长的对数中后期(36,h)加入不同体积分数的乙醇(2%、6%、10%),此时菌体生长趋于稳定,细胞的形态和组成比较一致.继续振荡培养24,h 和72,h 后取样测定菌体的A600值,结果如图2所示.

图2 不同乙醇体积分数下出发菌株TCCC 11037 和突变菌株UV15X1-2的生长Fig.2 Growth of TCCC 11037 and UV15X1-2 in the presence of different ethanol concentrations
由图2 可知,当乙醇体积分数从0%增加到2%时,随着培养时间的延长,出发菌株的A600值没有明显变化,大概在0.671~0.679 之间波动.而突变菌株UV15X1-2 的A600值均有所增加,其在24,h 和72,h的A600值比出发菌株对应时间下的A600值分别提高了15.4%和29.4%.之后,出发菌株TCCC 11037 和突变菌株UV15X1-2 的生长都随着乙醇体积分数的增加受到抑制.但突变菌株UV15X1-2 在不同时间下的A600值均明显高于对应时间下出发菌株TCCC 11037 的A600值,且随着时间的延长,两者差异的幅度有所增加.尤其在乙醇体积分数为6%和10%下培养72,h 后,突变菌株UV15X1-2 的A600值比出发菌株TCCC 11037 分别提高了56.0%和81.7%.
此外,在2%、6%、10%乙醇下,随着培养时间的延长(24~72,h),出发菌株TCCC 11037 的A600值呈下降趋势,而突变菌株UV15X1-2 的A600值随着培养时间的延长表现出增加的趋势,说明突变菌株UV15X1-2 经过一段较长时间的适应,表现出继续生长的趋势,突变菌株UV15X1-2 在乙醇压力下仍具有一定的生长能力.综合图1 和图2 的结果可知,在乙醇体积分数0~10%的范围内,突变菌株UV15X1-2比出发菌株TCCC 11037 表现出更好的生长特性.
2.2 乙醇处理对耐性差异菌株细胞存活的影响
为考察出发菌株 TCCC 11037 和突变菌株UV15X1-2 的乙醇耐受能力,分别制备静息细胞,向其中加入不同体积分数的乙醇,处理30,min 后观察细胞的存活情况,结果如图3所示.由图3 可知,当乙醇体积分数由0%增加到2%时,突变菌株UV15X1-2的存活率为100.0%,没有变化,而出发菌株TCCC 11037 的存活率下降为96.4%.当乙醇体积分数增大到6%时,突变菌株UV15X1-2 的存活率仍保持在95.0%左右,而出发菌株TCCC 11037 的存活率则快速下降到75.8%.继续增大乙醇体积分数到10%,两个菌株的存活率均表现出明显下降的趋势,其中突变菌株UV15X1-2 的存活率为75.7%,比出发菌株高出18.3%.由此可见,突变株UV15X1-2 比出发菌株TCCC 11037 具有更高的乙醇耐受性能.

图3 乙醇对出发菌株TCCC 11037和突变菌株UV15X1-2细胞存活的影响Fig.3 Effect of ethanol on the cell survival of TCCC 11037,and UV15X1-2
2.3 乙醇处理对耐性差异菌株糖代谢能力的影响
图4 表示的是不同体积分数乙醇处理对耐性差异菌株糖代谢能力的影响.

图4 乙醇对出发菌株TCCC 11037和突变菌株UV15X1-2细胞糖代谢能力的影响Fig.4 Effect of ethanol on the sugar metabolic activities of TCCC 11037 and UV15X1-2
从图4 可知,随着乙醇体积分数的增大,两个菌株的细胞糖代谢活力保留值均表现出下降的趋势.当乙醇体积分数不超过2%时,出发菌株TCCC 11037 和突变菌株UV15X1-2 的细胞糖代谢保留值之间没有明显差异,分别为92.0%和93.8%;继续增大乙醇体积分数,出发菌株TCCC 11037 的糖代谢活力保留值表现出更为快速的下降趋势;当乙醇体积分数增加到10%时,突变菌株UV15X1-2 的糖代谢活力保留值为77.2%,而出发菌株TCCC 11037 的糖代谢活力保留值仅为60.6%.由此可见,高浓度乙醇条件下,与突变菌株UV15X1-2 相比,出发菌株TCCC 11037 的糖代谢能力受到了更为严重影响(糖代谢活力保留值下降更明显),这种影响直接决定了微生物在有机溶剂压力下的存活情况.
2.4 乙醇处理对耐性差异菌株细胞膜电位的影响
关于有机溶剂对细胞的毒害作用,目前普遍接受的观点是有机溶剂在细胞膜上积累,影响细胞膜的基本功能,主要包括细胞膜作为能量传导(膜电位)和屏障作用(通透性)的功能[13].Rh123 是一种可透过细胞膜的阳离子荧光染料,其在正常细胞中能够依赖跨膜电位进入细胞基质,能特异地吸附于细胞内膜上和细胞质中,发出黄绿色荧光;而当细胞膜完整性被破坏时,细胞膜通透性增大,引起线粒体跨膜电位崩溃,Rh123 重新释放出细胞,荧光强度会下降[11].图5 表示的是乙醇处理对菌体细胞膜电位的影响.

图5 乙醇对出发菌株TCCC 11037和突变菌株UV15X1-2细胞膜电位的影响Fig.5 Effect of ethanol on the membrane potential of TCCC 11037 and UV15X1-2
由图5 可以看到,当乙醇体积分数从0%增大到10%,两个菌株的Rh123 相对荧光强度均不断减少,即两个菌株的细胞膜电位随着乙醇体积分数的增加均表现出不断下降的趋势.当乙醇体积分数为10%时,出发菌株TCCC 11037 和突变菌株UV15X1-2 的细胞膜电位最低,分别为64.4%和72.4%.同时,在不同的乙醇体积分数下,突变菌株UV15X1-2 的细胞膜电位均高于出发菌株TCCC 11037.结合图4 的实验结果可知,乙醇的加入影响了细胞的代谢能力和细胞膜作为能量传导的功能.与突变菌株UV15X1-2 相比,高浓度乙醇对出发菌株TCCC 11037 的影响更为明显,这可能是两个菌株在乙醇压力下细胞存活情况产生差异的重要原因.
2.5 乙醇处理对耐性差异菌株细胞超显微结构的影响
文献[14]报道,有机溶剂能够插入细胞膜脂双分子层,使细胞的结构受到影响.因此,通过原子力显微镜对两个菌株在不同乙醇体积分数下的超显微结构进行观察,结果如图6 所示.

图6 不同乙醇体积分数下出发菌株TCCC 11037 和突变菌株UV15X1-2的超显微结构Fig.6 AFM images of TCCC 11037 and UV15X1-2 in the presence of different ethanol concentrations
由图6 可知:对于出发菌株TCCC 11037,在没有乙醇的条件下,细胞形态较规则,近似短杆状,细胞表面光滑,结构完整;随着乙醇浓度的增加,形态逐渐变得不规则,细胞表面开始有凹陷,表面结构出现破损.当乙醇体积分数为6%时,细胞的超显微结构观察到较为明显的破坏,观察到有胞浆流出(见图6(a)箭头所示);当乙醇体积分数增加至10%时,细胞表面变得不平整,胞浆大量流出,细胞完整性遭到破坏,这时细胞的存活率、糖代谢能力、细胞膜电位分别下降了 24.2%、28.1%、16.5%.对于突变菌株UV15X1-2,在没有乙醇的条件下,细胞形态与出发菌株TCCC 11037 相同.当乙醇体积分数为6%时,菌体表面仍较为平整,保持良好的完整性;当乙醇体积分数为10%时,观察到菌体细胞内有少量胞浆流出(见图6(b)箭头所示),这与该条件下观察到的细胞存活率和各种生理特性开始下降的结果是一致的.
2.6 乙醇处理对耐性差异菌株细胞通透性的影响
简单节杆菌作为C1,2 脱氢反应菌株,其细胞通透性是一个重要的生理特性.这一方面是因为细胞通透性影响营养物质的吸收或其他物质(代谢产物、离子、酶等)的跨细胞转运,对微生物在有机溶剂压力条件下的生长与存活至关重要[15].更重要的是,细胞通透性对于疏水性底物的跨膜扩散以及产物的排出具有重要意义,将直接影响转化反应的效率[16].
简单节杆菌C1,2 脱氢反应的底物——醋酸可的松属于疏水性的小分子化合物,其进入细胞的方式属于自由扩散,对于物质自由扩散进入细胞的难易程度,细胞膜的通透特性是一个非常关键的因素.因此,本文通过测定两个菌株对疏水性化合物二乙酸荧光素FDA 的通透性和细胞内大分子物质(蛋白质和核酸)的泄漏量对细胞的通透性进行综合表征.
FDA 是一种不带电荷、物理特性与甾体类化合物相类似的亲脂性分子.其进入细胞后可被胞内酯酶水解得到荧光素而被截留在细胞内,FDA 荧光强度增大,表明细胞损伤,通透性增加,但细胞又未死亡[11].不同乙醇体积分数处理对菌体细胞FDA 通透性的影响如图7 所示.

图7 不同乙醇体积分数下出发菌株TCCC 11037 和突变菌株UV15X1-2的FDA相对荧光强度Fig.7 Effect of ethanol on the FDA relative fluorescence intensity of TCCC 11037 and UV15X1-2
由图7 可知:当乙醇体积分数由0%增加到2%时,两个菌株的FDA 相对荧光强度基本相同,且表现为增加的趋势,说明经过该体积分数的乙醇处理能增加细胞对疏水性小分子物质的通透性.继续增大乙醇体积分数,突变菌株UV15X1-2 的FDA 相对荧光强度继续增大,在乙醇体积分数为6%时达到最高,为112.3%.之后,继续增大乙醇体积分数到10%时,FDA 相对荧光强度下降为90.7%,分析可能原因是高浓度乙醇抑制了胞内酯酶的活性,这一现象与文献报道的结论一致[17].对于出发菌株TCCC 11037,乙醇体积分数从2%增加到10%时,细胞的FDA 相对荧光强度不断下降,当乙醇体积分数为10%时,FDA相对荧光强度为78.9%.
图8 表示的是经过乙醇处理细胞蛋白质和核酸泄露的变化.由图8 可知:当乙醇体积分数为2%时,两个菌株细胞内大分子物质(蛋白质、核酸)没有观察到明显泄露.继续增大乙醇浓度,两个菌株的蛋白质和核酸泄漏量明显增加.与突变菌株UV15X1-2 相比,出发菌株TCCC 11037 表现出更为明显的蛋白质和核酸的泄露.

图8 乙醇处理对出发菌株 TCCC 11037 和突变菌株UV15X1-2细胞蛋白质和核酸泄漏的影响Fig.8 Effect of ethanol on the protein and nucleic acid leakage of TCCC 11037 and UV15X1-2
由图7 和图8 可知,乙醇处理能够提高细胞的通透性.但这种通透性对于疏水性化合物生物转化反应能否产生影响还有待于进一步研究,目前已有很多通过增强细胞通透性提高甾体生物转化效率的报道.Korycka-Machala 等[18]研究表明,聚阳离子(例如鱼精蛋白、聚乙烯亚胺)通过增加分枝杆菌细胞壁对疏水性化合物的渗透,β–谷甾醇的转化率提高了3倍;Avramova 等[19]通过制备静息细胞,研究了表面活性剂Tween 80 对Rhodococcus sp.细胞的9,α–羟基化反应的影响,结果表明:采用Tween 80 处理细胞30,min,可有效提高雄甾–4–烯–3,17–二酮(AD)的转化效率.
3 结论
(1)突变菌株 UV15X1-2 与出发菌株 TCCC 11037 相比,在添加了0%~10%体积分数乙醇的菌体培养基中,表现出更好的生长特性.
(2)通过制备静息细胞,确定了0%~10%体积分数的乙醇对细胞存活率的影响.结果表明,突变菌株UV15X1-2 比出发菌株TCCC 11037 表现出更好的乙醇耐受性.在6%体积分数乙醇下,出发菌株TCCC 11037 的糖代谢能力和细胞膜电位明显下降,细胞完整性遭到严重破坏;而突变菌株UV15X1-2 在乙醇体积分数为10%时才发生糖代谢活力和细胞膜电位下降,细胞完整性破坏的现象.这些细胞生理特性的变化与菌体细胞的存活息息相关.
(3)通过测定胞外物质FDA 向细胞内的扩散和胞内蛋白质和核酸向细胞外的泄漏,考察了乙醇处理对细胞通透性的影响.结果表明,与突变菌株UV15X1-2 相比,乙醇对出发菌株TCCC 11037 细胞通透性的影响更加明显,这可能也是该菌株在高浓度乙醇处理下细胞存活率明显下降的重要原因.
[1]Heipieper H J,Neumann G,Cornelissen S,et al.Solventtolerant bacteria for biotransformations in two-phase fermentation systems[J].Applied Microbiology and Biotechnology,2007,74(5):961-973.
[2]Torres S,Pandey A,Castro G R.Organic solvent adaptation of Gram positive bacteria:Applications and biotechnological potentials[J].Biotechnology Advances,2011,29(4):442-452.
[3]Segura A,Duque E,Mosqueda G,et al.Multiple responses of gram-negative bacteria to organic solvents[J].Environmental Microbiology,1999,1(3):191-198.
[4]王鑫昕,王少华,李维,等.细菌的有机溶剂耐受机制[J].生物工程学报,2009,25(5):641-649.
[5]Isken S,de Bont J A.Bacteria tolerant to organic solvents[J].Extremophiles,1998,2(3):229-238.
[6]Bie S T,Du L X,Zhang L M,et al.Bioconversion of methyl-testosterone in a biphasic system[J].Process Biochemistry,2005,40(10):33-39.
[7]李福,王普,李荣贵.有机溶剂/水两液相体系中甾体激素的生物转化[J].生物技术,2004,14(3):76-79.
[8]骆健美,宋妍,王建锋,等.基于细胞性质分析不同有机溶剂对简单节杆菌C1,2 脱氢反应的影响[J].化学与生物工程,2012,29(5):49-53.
[9]王建锋,骆健美,宋妍,等.乙醇对简单节杆菌TCCC 11037 生长和细胞性质的影响[J].化学与生物工程,2011,28(3):66-69.
[10]Zhang L T,Wang M,Shen Y B,et al.Improvement of steroid biotransformation with hydroxypropyl-β-cyclodextrin induced complexation[J].Applied Biochemistry and Biotechnology,2009,159:642-659.
[11]卢群,丘泰球,杨红.Rh123、FDA 荧光法测定超声作用对大肠杆菌细胞膜的影响[J].广东药学院学报,2006,22(2):179-184.
[12]Woo I S,Rhee I K,Park H D.Differential damage in bacterial cells by microwave radiation on the basis of cell wall structure[J].Applied and Environmental Microbiology,2000,66(5):2243-2247.
[13]王永乐,王敏,申雁冰,等.有机溶剂对大肠杆菌细胞膜的影响[J].天津科技大学学报,2008,23(4):41-43.
[14]Schaer-Zammaretti P,Ubbink J.Imaging of lactic acid bacteria with AFM elasticity and adhesion maps and their relationship to biological and structural data[J].Ultramicroscopy,2003,97(1/2/3/4):199-208.
[15]Zahir Z,Seed K D,Dennis J J,et al.Isolation and characterization of novel organic solvent tolerant bacteria [J].Extremophiles,2006,10(2):129-138.
[16]Korycka-Machała M,Ziólkowski A,Rumijowska-Galewicz A,et al.Polycations increase the permeability of Mycobacterium vaccae cell envelopes to hydrophobic compounds[J].Microbiology,2001,147(10):2769-2781.
[17]Shen Y B,Wang M,Zhang L T,et al.Effects of hydroxypropyl-β-cyclodextrin on cell growth,activity,and integrity of steroid-transforming Arthrobacter simplex and Mycobacterium sp.[J].Applied Microbiology and Biotechnology,2011,90(6):1995-2003.
[18]Korycka-Machalam M,Rumijowska-Galewicz A,Dziadek J.The effect of ethambutol on mycobacterial cell wall permeability to hydrophobic compounds[J].Polish Journal of Microbiology,2005,54(1):5-11.
[19]Avramova T,Spassova D,Mutafov S,et al.Effect of Tween 80 on 9α-steroid hydroxylating activity and ultrastructural characteristics of Rhodococcus sp.cells[J].World Journal of Microbiology and Biotechnology,2010,26(6):1009-1014.
