超声处理对鲢鱼肉肌原纤维蛋白性质的影响
2013-11-08胡爱军卢秀丽孙军燕
胡爱军,卢秀丽,郑 捷,卢 静,孙军燕
(天津科技大学食品工程与生物技术学院,食品营养与安全教育部重点实验室,天津 300457)
在淡水鱼中,鲢鱼的产量非常高,是世界上捕捞量最大的十大类鱼种之一.鲢鱼具有易饲养、成长快、成本低等特点,但由于其肉薄、刺多,而且土腥味重,不及其他淡水鱼的口味,消费者对鲜销的鲢鱼可接受程度并不高.因此,如何对淡水鱼,尤其是对低价淡水鱼如鲢鱼进行深加工,已成为亟待解决的问题[1].
蛋白质是食品的重要成分,不但可以提高食品的营养价值、给机体提供必需的氨基酸,而且蛋白质在决定食品的结构、形态、色、香、味等方面也起到重要作用,这些主要取决于各种蛋白质不同的功能性质[2].蛋白质的功能性质也对食品或食品成分在制备、加工或保藏中的理化性质起重要作用[3].鲢鱼肌原纤维蛋白是鱼肉的重要组成部分,也是鱼肉中最主要的蛋白,蛋白质的性质主要是由肌原纤维蛋白所决定.但不少天然蛋白质的功能性质尚不突出,不能满足现代食品开发与加工的需要,通常通过改性的办法来提高蛋白质的功能性质.蛋白质经改性后,其功能性质得到了显著地提高,一方面拓宽了蛋白质的应用领域,另一方面可以作为一些昂贵原材料的替代品,因此在食品工业中具有广阔的应用前景[4].目前常用的蛋白质改性技术有物理改性、化学改性、酶法改性和基因工程改性等.超声波技术具有作用时间短、操作简单、易控制及能耗较低等优点.
到目前为止,还没有系统地研究超声处理鲢鱼肉肌原纤维蛋白后其性质的文献.本文在前期研究超声处理对鲢鱼肉蛋白结构和性质影响[5–6]的基础上,进一步研究超声处理对鲢鱼肉肌原纤维蛋白性质的影响,为超声技术的应用、鱼肉蛋白及蛋白食品的开发利用提供理论及技术参考.
1 材料与方法
1.1 材料
1.1.1 原料
鲢鱼,天津金元宝滨海农贸市场.
1.1.2 试剂与仪器
盐酸,分析纯,北京化工厂;氢氧化钠,分析纯,天津市化学试剂一厂;氯化钠,分析纯,天津市化学试剂一厂;Tris,分析纯,天津市博迪化工有限公司;考马斯亮蓝G-250,天津市科密欧化学试剂开发区中心.
电子天平,深圳华恒仪器有限公司;凯氏定氮仪,天津玻璃仪器厂;pH 计,上海理达仪器厂;MODULYOD–230 型冷冻干燥机,美国热电公司;752 型紫外可见分光光度计,上海菁华科技仪器有限公司;D66–101–1 型电热鼓风干燥箱,天津市天宇实验仪器有限公司;TDZ5–WS 多管架自动平衡离心机,湘仪离心机仪器有限公司;HW·SY21–K 型电热恒温水浴锅,北京市永光明医疗仪器厂;SRH–S300型均质机,上海世赫机电设备有限公司;三频超声波装置,宁波新芝生物科技有限公司.
1.2 实验方法
1.2.1 鲢鱼肉肌原纤维蛋白的提取
鲜活鲢鱼宰杀后,去头、尾、鳞、皮、内脏,用冰水洗净,手工剔取白色鱼肉,绞碎,取一定质量鱼糜与4 倍体积的磷酸盐缓冲液(pH 7.5)混合,匀浆,3,400,r/min 离心15,min,弃去上清液,所得沉淀再加入上述磷酸盐缓冲液匀浆、离心,重复3~4 次.将最后的沉淀取出,用一定离子强度的NaCl 溶液(pH 7.5)溶解,于4,℃静置一定时间后,纱布初滤,滤液经离心后得到上清液即为肌原纤维蛋白溶液;再将其透析、冻干即得肌原纤维蛋白粉.
1.2.2 超声处理鲢鱼肉肌原纤维蛋白
取一定质量的肌原纤维蛋白粉溶于0.5,mol/L、pH 7.5 的NaCl 溶液中,分别在不同频率超声条件下超声0、5、10、15、20、25,min 后取出备用.
1.2.3 鲢鱼肌原纤维蛋白溶解度的测定
取一定量的肌原纤维蛋白粉溶解在含有40,mmol/L Tris-HCl(pH 7.5)的0.5,mol/L NaCl 溶液中,使蛋白质的最终质量浓度为1,mg/mL,均质,3,400,r/min 离心15,min,取上清液.蛋白质的质量浓度用考马斯亮蓝法测定[7].
溶解度=(上清液蛋白质质量/样品总蛋白质质量)×100%
1.2.4 鲢鱼肌原纤维蛋白起泡性及泡沫稳定性的测定
取一定量的肌原纤维蛋白粉溶解在含有40,mmol/L Tris-HCl(pH 7.5)的 0.5,mol/L NaCl 溶液中均质1,min,记录均质停止时泡沫和蛋白溶液的总体积,静置30,min 后再记录泡沫和蛋白溶液的总体积.
起泡性=(泡沫的初体积/蛋白溶液的总体积)×100%
泡沫稳定性=(静置30,min 后的泡沫体积/泡沫初体积)×100%
1.2.5 鲢鱼肌原纤维蛋白乳化性及乳化稳定性的测定
取一定量的肌原纤维蛋白粉溶解在含有40,mmol/L Tris-HCl(pH 7.5)的0.5,mol/L NaCl 溶液中均质1,min,1,800,r/min 离心5,min,分别测量离心管中的液体总高度和乳化层高度.将上述离心管置于 60,℃水浴锅中加热 30,min,冷却至室温后,1,800,r/min 离心5,min,分别测量仍保持乳化状态的液层高度和液体总高度.
乳化性=(乳化层高度/液体总高度)×100%
乳化稳定性=(仍保持乳化状态的液层高度/液体总高度)×100%
1.2.6 鲢鱼肌原纤维蛋白热稳定性的测定
参照Fujiwara 等[8]的方法,取一定量的肌原纤维蛋白粉溶解在含有40,mmol/L Tris-HCl(pH 7.5)的0.5,mol/L NaCl 溶液中,然后均质,3,400,r/min 离心15,min,取上清液63,℃水浴加热30,min,冰水中冷却后再离心,分别测定热处理前后上清液中蛋白质的含量.
热稳定性=(热处理后上清液中蛋白质含量/热处理前上清液中蛋白质含量)×100%.
2 结果与分析
2.1 超声对鲢鱼肌原纤维蛋白溶解度的影响
将配制好的肌原纤维蛋白溶液分别用不同频率(25、40、80,kHz)超声处理0、5、10、15、20、25,min后,测定肌原纤维蛋白的溶解度,其结果如图1所示.
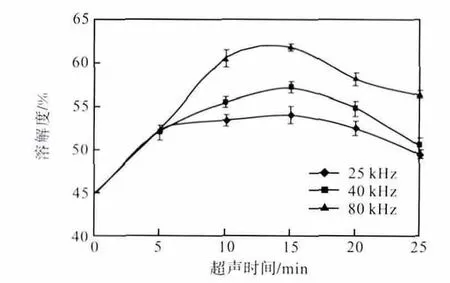
图1 超声对鲢鱼肌原纤维蛋白溶解度的影响Fig.1 Effects of ultrasonic on the solubility of the myofibrillar protein of silver carp
在不同频率超声作用下,随着超声时间的增加,不同处理条件下的肌原纤维蛋白溶解度均先增加后减少.当超声时间为15,min 时,不同处理条件下的蛋白溶解度均达到最高,其中80,kHz 作用下的蛋白溶解度最好,比未经超声处理的蛋白溶解度提高了37.59%.可能的原因是:随着超声时间和超声频率的增加,超声处理使蛋白分子展开,结构变得疏松,溶解度增加;但超声时间进一步增加,会使蛋白发生变性和聚集,因而使溶解度降低.
2.2 超声对鲢鱼肌原纤维蛋白起泡性及泡沫稳定性的影响
将配制好的肌原纤维蛋白溶液分别用不同频率(25、40、80,kHz)超声处理0、5、10、15、20、25,min后,测定肌原纤维蛋白的起泡性和泡沫稳定性,其结果如图2、图3 所示.
在不同频率超声作用下,随着超声时间的延长,鲢鱼肌原纤维蛋白起泡性和泡沫稳定性先增加后减少.80,kHz 的起泡性和泡沫稳定性比未经超声处理组提高了59.16%和56.09%,而经25,kHz 处理的蛋白起泡性和泡沫稳定性变化较小,仅提高了7.29%和8.40%.这可能是因为超声处理先增大了蛋白的溶解度,后减小了蛋白的溶解度.蛋白溶解度大,有利于在气–水界面展开,易形成泡沫.超声使蛋白分子伸展,适度伸展的蛋白分子间能够形成更为稳定的网络结构和界面膜,增强了泡沫稳定性.随着超声时间的增加或频率增大,蛋白溶解度降低,分子间相互作用形成了稳定网络结构和界面膜遭到破坏,产生的泡沫界面膜易破裂,因而起泡性和泡沫稳定性降低.

图2 超声对鲢鱼肌原纤维蛋白起泡性的影响Fig.2 Effects of ultrasonic on the foaming activity of the myofibrillar protein of silver carp

图3 超声对鲢鱼肌原纤维蛋白泡沫稳定性的影响Fig.3 Effects of ultrasonic on the foaming stability of the myofibrillar protein of silver carp
2.3 超声对鲢鱼肌原纤维蛋白乳化性及乳化稳定性的影响
将配制好的肌原纤维蛋白溶液分别用不同频率(25、40、80,kHz)超声处理0、5、10、15、20、25,min后,测定肌原纤维蛋白的乳化性及乳化稳定性,其结果如图4、图5 所示.
不同频率超声作用下的肌原纤维蛋白的乳化性和乳化稳定性随时间的延长先增加后减小.其中80,kHz 作用下的蛋白在15,min 时乳化性和乳化稳定性均达到最高,比未经超声处理的蛋白分别提高了51.11%和53.84%.原因可能是随着超声时间和频率的增加,使蛋白质的分子展开,结构变得疏松,疏水基团朝向脂质而极性部分朝向水相,当蛋白聚集于油–水界面,使其表面张力降低,促进形成油–水乳化液,因此可以防止油滴的集结和乳化状态的破坏,提高了乳化性和乳化稳定性.但随着超声作用进一步增强,高能量的机械振荡会使原来分散的蛋白空间结构发生改变,蛋白变性程度增大,使其乳化性和乳化稳定性降低.
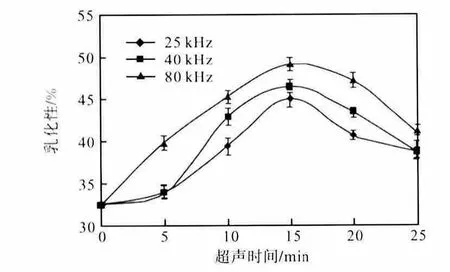
图4 超声对鲢鱼肌原纤维蛋白乳化性的影响Fig.4 Effects of ultrasonic on the emulsifying activity of the myofibrillar protein of silver carp

图5 超声对鲢鱼肌原纤维蛋白乳化稳定性的影响Fig.5 Effects of ultrasonic on the emulsifying stability of the myofibrillar protein of silver carp
2.4 超声对鲢鱼肌原纤维蛋白热稳定性的影响
将配制好的肌原纤维蛋白溶液分别用不同频率(25、40、80,kHz)超声处理0、5、10、15、20、25,min后,测定肌原纤维蛋白的热稳定性,其结果如图6所示.
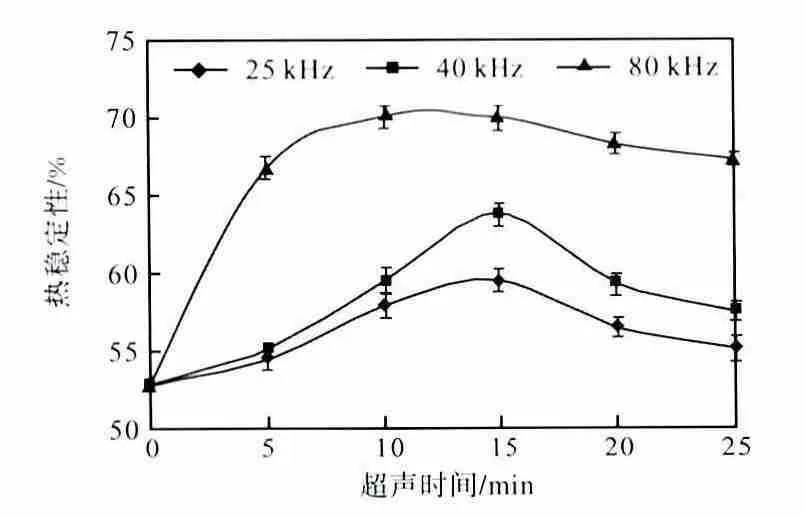
图6 超声对鲢鱼肌原纤维蛋白热稳定性的影响Fig.6 Effects of ultrasonic on the thermal stability of the myofibrillar protein of silver carp
不同频率超声作用下的肌原纤维蛋白的热稳定性随时间的延长先增大后减小.其中80,kHz 作用10,min 时的蛋白热稳定性达到最高,比未经超声处理的蛋白热稳定性提高了32.59%.超声波作用使蛋白分子发生了机械性振荡,可能破坏了蛋白分子的空间结构,使蛋白分子展开,内部疏水基团暴露,提高了静电斥力,使蛋白热稳定性提高.随着超声作用进一步增强,蛋白变性程度增大,聚集沉淀,热稳定性降低.
3 结论
经超声处理的鲢鱼肉肌原纤维蛋白的溶解度、起泡性及泡沫稳定性、乳化性及乳化稳定性、热稳定性在一定条件下都有不同程度的提高,超声时间和频率均对鲢鱼肉肌原纤维蛋白的性质有一定的影响.其原因可能是超声作用改变了蛋白的空间结构,进而使蛋白的性质发生改变.
[1]张爱荣.糖基化反应改善鲢鱼肉肌原纤维蛋白功能特性的研究[D].北京:中国农业大学,2005.
[2]戴瑞彤,杨龙江.肉蛋白质的功能特性及其在肉品加工中的作用[J].肉类工业,2000(11):17-19.
[3]Remignon H,Molette C,Babile R,et al.Current advances in proteomic analysis and its use for the resolution of poultry meat quality problems [J].World's Poultry Science Journal,2006,62(1):123-129.
[4]莫文敏,曾庆孝.蛋白质改性研究进展[J].食品科学,2000,21(6):6-10.
[5]胡爱军,陈琼希,郑捷,等.超声波处理对鲢鱼鱼肉蛋白性质的影响[J].食品工业,2012(2):47-49.
[6]胡爱军,卢秀丽,郑捷,等.超声处理对鲢鱼鱼肉蛋白结构的影响[J].现代食品科技,2012,28(8):894-897.
[7]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[8]Fujiwara K,Oosawa T,Saeki H.Improved thermal stability and emulsifying properties of carp myofibrillar proteins by conjugation with dextran[J].Journal of Agricultural and Food Chemistry,1998,46(4):1257-1261.
