制备方法对NiCoPrLa类水滑石衍生复合氧化物的催化性能影响
2013-11-04邓明海彭楠楠王一君高新航
李 凝,梁 亮,邓明海,彭楠楠,王一君,高新航
(1.广东石油化工学院化学工程与环境工程学院,广东 茂名 525000;2.桂林理工大学化学与生物工程学院,广西 桂林 541004)
水滑石和类水滑石是一类具有特殊结构的层状新型材料,由带正电荷的层板和层板间的水分子与带负电荷的阴离子组成,层板主要由二价、三价的金属离子和OH-组成,层板之间依靠氢键缔合,因而又称为双金属氢氧化物,水滑石和类水滑石的阴离子能被其它的阴离子所置换而制备出新的插层产物,该产物称为柱撑水滑石[1-2]。并在催化剂及催化剂载体,离子交换剂等领域有着广泛的应用[3-4],有关类水滑石或其衍生复合氧化物在乙醇水蒸气重整制氢反应中报道很少。水滑石的制备方法对其晶粒尺寸,晶相纯度和表面性能有一定的影响[5],并同时影响其衍生复合氧化物催化剂的稳定性和活性[6-7],因此选择适宜的制备方法,对水滑石及其衍生复合氧化物的结构及性能产生不同的影响。本文采用低过饱和度法(PLS)、高过饱和度法(PHS)和水热法分别合成了NiCoLaPr 类水滑石,考察了制备方法对NiCoLaPr类水滑石的晶相结构、衍生复合氧化物的表面性能及其在乙醇水蒸气催化重整制氢反应中的催化活性、选择性和抗积炭性能的影响。
1 实验方法
1.1 不同NiCoLaPr类水滑石的制备
按照一定量分别称取Ni(NO3)3·6H2O、Co(NO3)3·6H2O、La(NO3)3·nH2O 和Pr(NO3)3·6H2O,溶于去离子水中配制成混合溶液,即A溶液。按照摩尔浓度[OH-]=2[M2+]+2[M3+],[CO32-]=0.5[M3+],配制适量的0.5 mol/L的NaOH 溶液,称取适量的无水Na2CO3加入到NaOH 溶液配制成混合碱溶液,即B 溶液。在80℃快速搅拌的条件下,用恒流泵将B溶液逐滴均匀的滴加到A 溶液中,直到溶液的pH 值到9为止,80℃下继续搅拌30min后,老化10h过滤洗涤,然后将其放入红外干燥箱120℃干燥20h即得类水滑石,试样标记为LS。
按照上述方法分别配置A 溶液和B溶液后,将溶液A 和B同时倒入烧瓶中强烈搅拌约2h,老化10h 过滤洗涤,然后将其放入红外干燥箱120℃干燥20h,试样标记为HS。
按照上述方法分别配置A 溶液和B溶液后,在80℃快速搅拌的条件下,用恒流泵将B 溶液逐滴均匀的滴加到A 溶液中,直到溶液的pH 值到9为止,80℃继续搅拌30min后,倒入水热釜中150℃下水热处理10h,冷却后洗涤,然后将其放入红外干燥箱120℃干燥20h,试样标记为S。
将LS、HS和S在550℃条件下焙烧5h,分别得不同方法制备的类水滑石衍生复合氧化物,分别标记为:LSY、HYS和SY。
1.2 催化剂的表征
XRD 采用荷兰PANalytical B.V.公司X′Pert PRO X 衍射仪进行测试。实验条件:铜靶,管电压45kV,管电流55 mA,扫描速率1(°)/min,扫描范围2θ=5°~80°,λ=0.154nm。
H2-TPR、C2H5OH-TPD、TPO 在天津先权公司生产的TP-5000 多用吸附仪上进行。在H2-TPR实验中,称取40~60目的试样0.1g装入石英管内,N2(20mL/min)200℃吹扫30min,降至50℃后通入H2/N2混合气(V(H2)∶V(N2)为1∶10,总流量20mL/min),基线平稳后以10℃/min速率从50℃升温至750℃。在TPD实验中,称取40~60目的试样0.1g装入石英管内,通入H2从常温以20℃/min的速率升温到700℃,氢气气氛下700℃保持1h后降到室温,切换N2(20mL/min)吹扫至基线平稳,用Ar气带C2H5OH 进行脉冲吸附至峰面积变化平稳为止,N2吹扫至基线平稳后,以10℃/min速率从30℃升温至550℃,记录C2H5OH-TPD曲线。将在乙醇水蒸气催化重整制氢反应50h后的催化剂于H2氛围下降至300℃吹扫30min后降至室温,将H2切换为O2/N2混合气(O2体积分数5%,总流量为20mL/min),基线平稳后以10℃/min速率从50℃升温至900℃,记录TPO曲线。
1.3 催化剂的活性评价装置
催化剂的评价在天津先权公司公司生产的WFSM-3060催化剂评价装置中进行。称取0.2 g催化剂,装入石英反应管中,通入H2,750℃还原1h,待温度冷却至室温,切换成N2,同时启动高压恒流泵,通入乙醇水溶液(m(H2O)∶m(C2H5OH)=3∶1),乙醇水溶液汽化温度为200℃,整个反应系统压强保持为常压,350~550℃反应。DGC-6890气相色谱仪在线分析尾气中的气体,TCD 检测器,TDX 柱,反应产物中的液体用上海精密仪器公司生产的GC112A 型气相色谱仪进行分析,FID 离子火焰检测器,OV-101(30mm×30mm)毛细管柱,检测温度150℃,进样温度为150℃,程序升温。
1.4 实验计算方法
乙醇水蒸气催化重整制氢的乙醇转化率、产物的选择性计算方式如下:

式中:F—摩尔流速,X—乙醇的转化率,S—产物的选择性,n 表示乙醇中的C 原子与产物中含碳组分中的C 原子之比。产物经色谱分析采用面积归一法进行定量计算,组分的摩尔分数计算如下:
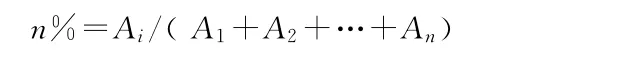
式中:n%—组分i的摩尔含量,Ai—组分i的峰面积,n—检测出的组分数。
2 结果结果与讨论
2.1 制备方法对NiCoPrLa类水滑石结构影响
图1是不同制备方法制备的NiCoPrLa类水滑石的XRD。

图1 不同方法制备的类水滑石的XRD谱
由图1可见:不同方法制备的NiCoPrLa类水滑石均在d003(2θ=11.15°)、d006(2θ=22.63°)出现水滑石的特征衍射峰。低过饱和共沉淀法和高过饱和共沉淀法制备水滑石试样的特征衍射峰峰形弥散,结晶度较差;水热法制备的NiCoPrLa类水滑石试样的衍射特征峰峰形尖锐、强度较强,因为在水热环境中水滑石的晶体结构有所增加,提高了纯度和结晶度[7-8]。但是由于Pr3+、La3+离子半径较大而无法完全取代水滑石中三价离子的位置[9],未能进入类水滑石骨架的Pr3+和La3+以氢氧化物的形式存在,故在2θ=15.8°和48.8°出现La(OH)3的特征衍射峰,2θ=15.8°出现Pr(OH)3的特征衍射峰,2θ=19.1°和38.1°出现Co(OH)2的特征衍射峰,2θ =19.1°出现Ni(OH)2的特征衍射峰。
2.2 制备方法对衍生复合氧化物的结构影响
图2是类水滑石的衍生复合氧化物的XRD谱。

图2 不同方法制备类水滑石的衍生复合氧化物的XRD谱
由图2可见:NiCoPrLa类水滑石在550℃焙烧后均形成了钙钛矿型复合氧化物,在2θ=33.02°、47.69°、59.12°出现明显的LaNiO3、LaCoO3和PrNiO3的特征衍射峰。同时在2θ=30.50°、36.20°、62.68°出现了NiO 的特征衍射峰,在2θ=31.34°、36.54°、65.19°出现Co3O4特征衍射峰,在2θ=29.66°、229.80°和44.75°分 别 出 现PrO2、Pr6O11和La2O3特征衍射峰。未进入类水滑石结构的金属物种在焙烧后主要以金属氧化物的形式存在,形成的类水滑石焙烧后主要以钙钛矿复合氧化物的形式存在,SY 试样的钙钛矿型复合氧化物特征衍射峰强度较强,而LSY和HSY 的钙钛矿型复合氧化物衍射峰较弱,表明水热处理的类水滑石前驱体有利于形成结晶完整的钙钛矿复合氧化物。同时SY 试样中NiO 和Co3O4出现的衍射峰比LSY和HSY的要弥散,说明水热法制备的类水滑石试样焙烧后金属氧化物晶粒相对小,Ni、Co物种在钙钛矿复合氧化物中有较好的分散性能并与其它氧化物形成较强的相互作用。
2.3 制备方法对类水滑石的衍生复合氧化物还原性能影响
图3是不同方法制备的NiCoLaPr类水滑石衍生复合氧化物的H2-TPR谱。

图3 不同方法制备类水滑石的衍生复合氧化物的TPR谱
由图3 可 见:SY、LSY 和HSY 的H2-TPR谱图均出现了4个还原峰,但峰面积和峰温存在一定的差异。SY 在344℃、418℃、581℃和678℃出现还原峰,344℃出现的还原峰归属于Co3O4中Co3+还原为Co2+;418℃出现的还原峰是一个混合峰,归属于Co2+还原为单质Co,NiO中Ni2+还原为单质Ni;钙钛矿型化合物还原峰出现在581℃和678℃。SY 在344℃与 其他两个试样在310℃和313℃还原峰面积较小,钙钛矿型复合氧化物在574~581℃和674~688℃出现的还原峰面积,SY 的试样还原峰面积较大,说明水热法制备的试样形成较好的钙钛矿型复合氧化物,使活性组分均匀的分散在氧化物的表面,提高了还原性能。同时SY 的H2-TPR谱图中的NiO、Co3O4物种还原峰温度偏高,这是由于在水热处理过程中提高了类水滑石的离子间作用力和晶格的规整性,焙烧后NiO、Co3O4物种与衍生复合氧化物之间的相互作用得到了加强,使还原温度提高。
2.4 制备方法对类水滑石的衍生复合氧化物C2H5OH 吸附性能影响
图4是不同方法制备的类水滑石衍生复合氧化物的C2H5OH-TPD谱。
由图4可见:3个试样均出现了2个脱附峰,在210~223℃有一个低温脱附峰,该峰应归属于H2的脱附峰,在此过程中主要是由于乙醇吸附在钙钛矿型复合氧化物和氧化物的表面上发生脱氢反应[10]。在311~320℃产生的高温脱附峰,该峰应归属于混合脱附峰,是CO、CO2和CH4的叠加峰,在此过程反应较复杂,CH3CHO进行分解反应产生了CO和CH4[11],部 分 CH4和C2H5OH 也进行分解反应以及C2H5OH 的脱水反应[12,13]。水热法制备的试样H2的脱附峰面积较大,峰温较低,说明水热法制备的试样对C2H5OH 的解离吸附是有利的,在乙醇水蒸气催化重整制氢气中能够有着较好的催化活性和选择性。
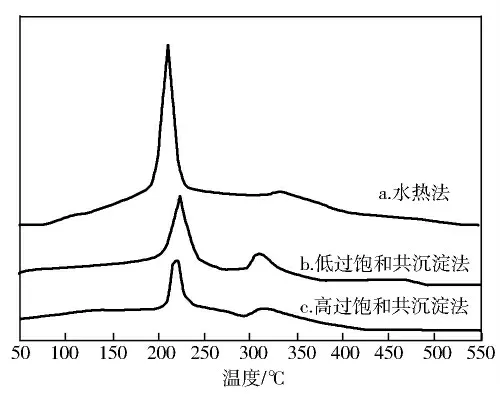
图4 不同方法制备的类水滑石衍生复合氧化物的C2H5OH-TPD谱
2.5 水热法制备的类水滑石的衍生复合氧化物的活性和选择性影响
水热法制备的类水滑石衍生复合氧化物的活性和选择性见图5。由图5可见:H2、CH4、CO 和CO2的选择性随反应温度的变化较复杂,这是C2H5OH 水蒸气催化重整制H2反应过程中副反应较多。当温度达到450℃时C2H5OH 的转化率为100%,H2、CH4、CO 和CO2的等气相产物选择性随着反应温度出现上下波动现象,因为乙醇水蒸气重整反应是一个较为复杂反应过程,除了CH3CH2OH +3H2O—→2CO2+6H2和CH3CH2OH+H2O—→4H2+2CO 主要反应外,还存在较多的副反应,随着温度的升高,副反应程度也会增强[14],产氢和耗氢同时进行,导致H2、CH4、CO 和CO2的选择性波动。
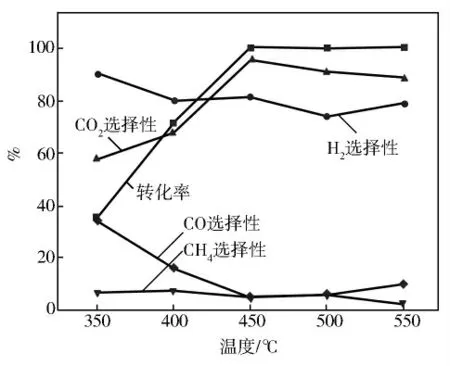
图5 温度对反应活性和选择性的影响
2.6 制备方法对类水滑石的衍生复合氧化物的表面积炭性能影响
图6是在C2H5OH 水蒸气催化重整制H2反应50h后的不同方法制备的试样催化剂TPO谱。

图6 不同方法制备的类水滑石衍生复合氧化物的TPO谱
由图6可见:不同方法催化剂的TPO谱图中均出现一个CO2的生成峰,表明不同方法制备的试样在催化C2H5OH 水蒸气催化重整制H2反应过程中,在催化剂表面均出现了一种炭物种,水热法制备的试样CO2的生成峰面积明显小于其他两种方法制备的试样,表明水热法制备的试样能够有效抑制碳的生成,经过催化C2H5OH 水蒸气催化重整制H2反应50h,没有发现明显的失活,表现出了较好的抗炭性能。
3 结论
利用低过饱和度法、高过饱和度法和水热法分别合成了NiCoLaPr类水滑石。水热法制备的NiCoLaPr类水滑石结晶度较高、晶体结构较完整相,其衍生复合氧化物在乙醇水蒸气重整中表现出较高的活性、H2选择性和抗积炭性,在450℃时C2H5OH 的转化率为100%,H2、CO2和CO选择性分别为80.56%,95.35%和4.56%。
[1]Goh K H,Lim T T,Dong Z l.Application of layered double hydroxides for removal of oxyanions:A review[J].Water Research,2008,42(6-7):1343-1368.
[2]Zhang Fazhi,Xiang Xu,Li Feng,et al.Layered Double Hydroxides as Catalytic Materials:Recent Devel`opment[J].Catal Surv Asia,2008,12:253-265.
[3]杜以波,Evans D G,孙鹏,等.阴离子型层柱材料研究进展[J].化学通报,2000,5:20-23.
[4]Hoyo C Del.Layered double hydroxides and human health:An overview[J].Applied Clay Science,2007,36,103-121.
[5]杨小丽,李树晓,赵振波.类水滑石CuNiAl的制备、表征及其催化剂性能的研究[J].2010,8:25-30
[6]Othmana M R,Helwania,Martunusa,et al.Synthetic hydrotalcites from different routes and their application as catalysts and gas adsorbents:a review[J].Appl Organo-metal Chem,2009,23:335-346.
[7]Unni Olsbyel,Duncan Akporiaye,Erling Rytter,et al.On the stability of mixed M2+/M3+oxides[J].Applied Catalysis A:General,2002,224(1):39-49.
[8]Yang Zuoyin,Zhou Hongwei,Zhang Jingchang,et al.Relationship between Al/Mg Ratio and the Stability of Singlelayer Hydrotalcite[J].Acta Physico-Chimica Sinica,2007,23(6):795-800.
[9]李连生,惠建斌,刘新生,等.稀土类水滑石的合成与表征(Ⅰ)[J].高等学校化学学报,1993,14(8):1048-1050.
[10]Fatsikostas A N,Verykios X E.Reaction network of Steam Reforming of Ethanol over Ni-Based Catalysts[J].Journal of Catal,2004,225(2):439-452.
[11]de Lima S M,da Cruz Ivna O,Jacobs G,et al.Steam reforming,partial oxidation,and oxidative steam reforming of ethanol over Pt/CeZrO2catalyst[J].Journal of Catalysis,2008,257(2):356-368.
[12]de Lima S M,Silva A M,Graham U M,et al.Ethanol decomposition and steam reforming of ethanol over CeZrO2and Pt/CeZrO2catayst:Reaction mechanisin and deactivation[J].2009,352:95-113.
[13]de Mello L F,Noronha F B,Schmal M.NO reduction with ethanol on Pd-Mo/Al2O3catalysts[J].2003(220):358-371
[14]Fish Tik I,Alexander A,Dat Ta R,et al.A thermodynamic analysis of hydrogen production by steam reforming of ethanol via response reactions[J].J Hydrogen Energy,2000,25(1):31-45.
