香椿子正丁醇提取物对脑缺血再灌注小鼠的神经保护作用及其机制研究
2013-11-02马迪陈超吴薇游艳潘宜云盛梦婷朱峰何治
马迪,陈超,吴薇,游艳,潘宜云,盛梦婷,朱峰,何治
随着当今世界人口老龄化的日益严重,缺血性脑血管疾病的发病率日趋增高,迫切需要寻找新的有效药物[1]。《东北药植志》记载:香椿子性温、味辛苦、无毒,入肝、肺经,具祛风、散寒、止痛之功效[2]。在三峡地区民间,有人在库区采集香椿子并用其泡水或煎服用来治疗脑血栓、脑栓塞等血栓性疾病,尤其对脑梗死偏瘫患者的恢复治疗有较好疗效。本课题组前期已经对香椿子挥发油成分[3]治疗血栓栓塞性疾病的作用进行了初步研究,发现香椿子提取物具有较好的抗凝血、抑制血栓形成和提高纤溶活性等作用。另外,我们前期研究表明,香椿子提取物能有效降低心肌梗死模型大鼠心肌梗死面积,且该效应与香椿子提取物抑制氧化应激及血栓形成有关[4-5]。本课题拟在前期研究基础上,进一步探讨香椿子正丁醇提取物(n-Butanol extract,n-BuE)的抗脑缺血作用,并探讨其可能的作用机制。
1 材料与方法
1.1 主要试剂及仪器 n-BuE的制备由三峡大学医学院国家中医药管理局中药药理三级实验室完成,用2% Tween 80作为溶剂溶解,配制成所需浓度。Tween80购自天津市大茂化学试剂厂;阿司匹林购自河北常山生化药业有限公司;硝普钠购自悦康药业集团有限公司;水合氯醛购自天津科密欧化学试剂有限公司;丙二醛(MDA)、一氧化氮(NO)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化物歧化酶(SOD)、BCA蛋白定量试剂盒均购自南京建成生物工程有限公司。
1.2 实验动物及分组 清洁级雄性昆明种小鼠42只,体重18~27g,由华中科技大学实验动物中心提供(动物合格证号:00015672)。按照随机数字表法分为6组,每组7只:①假手术组;②缺血再灌注组;③溶媒组(2% Tween80);④n-BuE低剂量治疗组[28mg/(kg.d)];⑤n-BuE高剂量治疗组[42mg/(kg.d)];⑥阳性对照组[阿司匹林14mg/(kg.d)]。
1.3 模型制备及给药 缺血再灌注(I-R)模型制作方法:术前12h禁食不禁水,水合氯醛(10%水合氯醛按0.035ml/10g体重)腹腔注射麻醉后,将小鼠仰卧固定于手术台上;消毒后沿颈正中切口,分离双侧颈总动脉(CCA),无创动脉夹结扎阻断CCA;20min后再灌注10min,如此反复2次,第1次缺血前腹腔注射硝普钠[2.5mg/(kg.d)]。术中保持动物肛温37±0.5℃。给药方法均为灌胃,溶媒组小鼠灌服7ml/kg剂量的2% Tween80,n-BuE低、高剂量治疗组小鼠分别灌服相应剂量的n-BuE,阳性对照组灌服相应剂量的阿司匹林;每天给药1次,连续给药7d,各组行脑缺血再灌注手术。
1.4 脑组织含水量测定 术后6h用10%水合氯醛(0.035ml/10g)重新麻醉大鼠,断头取脑,去除小脑和低位脑干、嗅球,立即称湿重,然后将脑组织烘干(105℃,24h),再次称重,按照干湿重法求出脑组织含水量。脑组织含水量按如下公式计算:脑组织含水量(%)=(脑湿重-脑干重)/脑湿重×100%。
1.5 血脑屏障通透性测定 小鼠脑缺血/再灌注损伤后血脑屏障的通透性可用脑组织中伊文思蓝(EB)的含量来评价。手术6h后,小鼠尾静脉注射2%EB(3ml/kg)。30min后小鼠用10%水合氯醛[350mg/(kg.d)]腹膜内注射麻醉,开胸,用生理盐水0.25L/kg灌注升主动脉,断头取脑,称湿重后放入装有0.5ml 1mol/L KOH溶液的容器中,37℃过夜,用1mol/L H3PO4溶液0.75ml中和碱性,然后加入2.25ml丙酮,于3500g离心3次,每次15min。取上清液于λ=620nm测定吸光度(A)值。根据以上工作条件制作标准曲线。根据标准曲线计算每1g脑组织中EB的含量。
1.6 MDA、NO含量及SOD、GSH-Px活力测定 术后6h用10%水合氯醛 (0.035ml/10g)重新麻醉大鼠,断头取脑,将左右皮层与海马分离,去除小脑和低位脑干、嗅球,其余操作均按照南京建成试剂盒说明书进行。
1.7 统计学处理 采用SPSS 12.0软件进行统计分析。所有数据以x±s表示。多组间均数比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 n-BuE对脑缺血再灌注小鼠脑组织含水量和血脑屏障通透性的影响 与假手术组比较,缺血再灌注组脑组织含水量、伊文思蓝含量均明显升高(P<0.01)。溶媒组与缺血再灌注组比较,脑组织含水量、伊文思蓝含量的差异无统计学意义,说明用于溶解n-BuE的溶媒不影响药物的治疗效果。与缺血再灌注组比较,阳性对照组的脑组织含水量、伊文思蓝含量明显降低(P<0.05或P<0.01),而阿司匹林已被证实对实验性小鼠脑缺血模型有神经保护作用,说明本实验所用模型稳定可靠。与缺血再灌注组比较,n-BuE[28mg/(kg.d),42mg/(kg.d)]治疗组的脑组织含水量、伊文思蓝含量明显降低(P<0.05或P<0.01,表1)。
2.2 n-BuE对脑缺血再灌注小鼠皮层和海马MDA、NO含量及SOD、GSH-Px活力的影响 与假手术组比较,缺血再灌注组海马组织MDA、NO含量明显增加(P<0.01),且海马组织SOD活性、GSH-Px活力明显增强(P<0.01)。溶媒组与缺血再灌注组比较,海马组织MDA、NO含量及SOD活性、GSH-Px活力差异无统计学意义(P<0.05),说明用于溶解n-BuE的溶媒不影响药物的治疗效果。与缺血再灌注组比较,阳性对照组海马组织的MDA、NO含量明显降低(P<0.01),且海马组织SOD活性、GPX-Px活力明显抑制(P<0.01),说明本实验所用模型稳定可靠。与缺血再灌注组比较,n-BuE[28mg/(kg.d),42mg/(kg.d)]治疗组海马组织MDA、NO含量明显减少(P<0.05或P<0.01),且SOD活性、GPX-Px活力明显抑制(P<0.01,表2)。
表1 n-BuE对脑I-R小鼠脑组织含水量和血脑屏障通透性的影响 , n=7)Tab. 1 Effects of n-BuE of Chinese toon seeds on the water extent of brain and the permeability of the blood brain barrier, n=7)
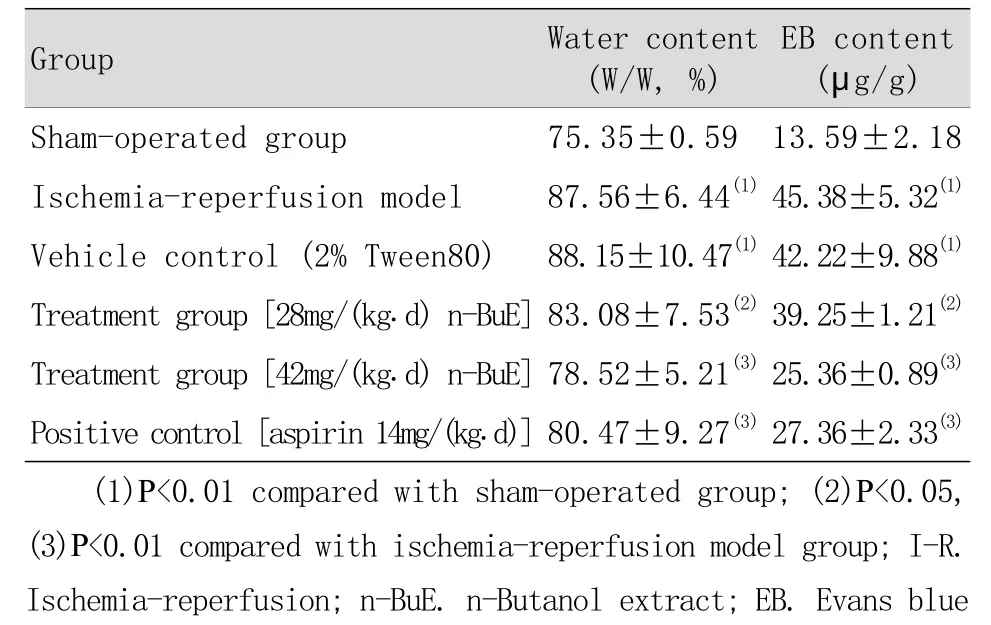
表1 n-BuE对脑I-R小鼠脑组织含水量和血脑屏障通透性的影响 , n=7)Tab. 1 Effects of n-BuE of Chinese toon seeds on the water extent of brain and the permeability of the blood brain barrier, n=7)
EB content(μg/g)Sham-operated group 75.35±0.59 13.59±2.18 Ischemia-reperfusion model 87.56±6.44(1)45.38±5.32(1)Vehicle control (2% Tween80) 88.15±10.47(1)42.22±9.88(1)Treatment group [28mg/(kg.d) n-BuE]83.08±7.53(2)39.25±1.21(2)Treatment group [42mg/(kg.d) n-BuE]78.52±5.21(3)25.36±0.89(3)Positive control [aspirin 14mg/(kg.d)]80.47±9.27(3)27.36±2.33(3)(1)P<0.01 compared with sham-operated group; (2)P<0.05,(3)P<0.01 compared with ischemia-reperfusion model group; I-R.Ischemia-reperfusion; n-BuE. n-Butanol extract; EB. Evans blue
3 讨 论
缺血性脑血管疾病常导致血脑屏障受损和破坏,从而伴发脑水肿,本实验结果显示n-BuE可降低脑缺血再灌注小鼠脑组织含水量和血脑屏障通透性,对脑缺血再灌注小鼠发挥神经保护作用。脑缺血时的病理损害涉及的病理生理变化较复杂,包括多个方面,氧自由基损害[6]是目前广泛认可的机制之一。缺血性脑损伤后,自由基生成增多,脂质过氧化产物MDA水平急剧增加,并伴随SOD、GSHPx活力的升高。SOD、GSH-Px是机体对抗自由基引起组织细胞破坏的主要防御工具。轻微的脑缺血损伤可引起SOD、GSH-Px基因表达的增加,并对随后更为严重的缺血性脑损伤起到保护作用[5],本实验中抗氧化酶活力的提升可能是损伤后自由基堆积,反馈引起SOD、GSH-Px基因表达增加,继而导致抗氧化酶活力代偿性升高。我们前期工作表明香椿子提取物在心肌缺血再灌注组织中表现出很强的抗氧化作用,并且可有效降低心肌梗死模型大鼠的心肌梗死面积[4,7-8]。本实验结果亦表明n-BuE能降低缺血大鼠脑内MDA含量,抑制SOD、GSH-Px活力升高,对脑缺血再灌注小鼠表现出良好的抗氧化作用,推测n-BuE的抗氧化作用可能是其发挥神经保护作用的机制之一。
表2 n-BuE对脑I-R小鼠海马MDA、NO含量及SOD、GSH-Px活力的影响(s, n=7)Tab. 2 Effects of n-BuE of Chinese toon seeds on the contents of MDA and NO, and the activity of SOD and GSH-Px n=7)
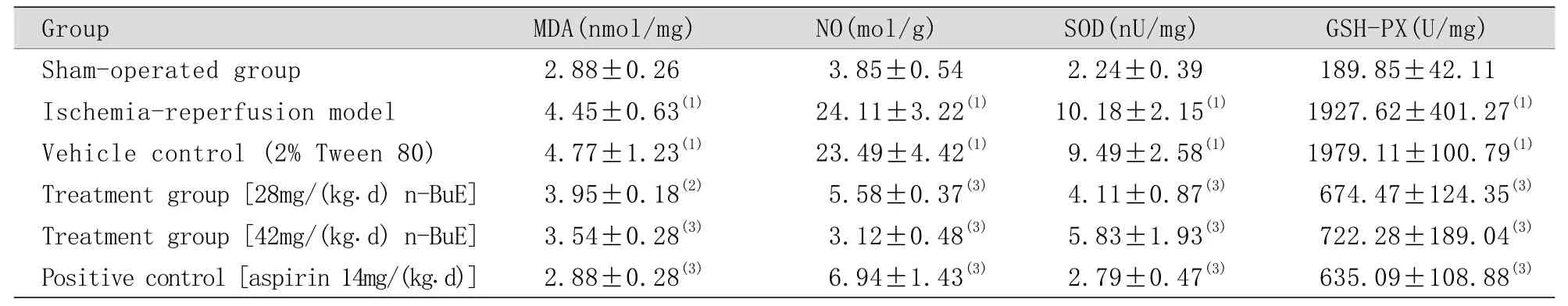
表2 n-BuE对脑I-R小鼠海马MDA、NO含量及SOD、GSH-Px活力的影响(s, n=7)Tab. 2 Effects of n-BuE of Chinese toon seeds on the contents of MDA and NO, and the activity of SOD and GSH-Px n=7)
(1)P<0.01 compared with sham-operated group; (2)P<0.05, (3)P<0.01 compared with ischemia-reperfusion model group; I-R. Ischemiareperfusion; n-BuE. n-Butanol extract
Group MDA(nmol/mg) NO(mol/g) SOD(nU/mg) GSH-PX(U/mg)Sham-operated group 2.88±0.26 3.85±0.54 2.24±0.39 189.85±42.11 Ischemia-reperfusion model 4.45±0.63(1) 24.11±3.22(1) 10.18±2.15(1) 1927.62±401.27(1)Vehicle control (2% Tween 80) 4.77±1.23(1) 23.49±4.42(1) 9.49±2.58(1) 1979.11±100.79(1)Treatment group [28mg/(kg.d) n-BuE]3.95±0.18(2) 5.58±0.37(3) 4.11±0.87(3) 674.47±124.35(3)Treatment group [42mg/(kg.d) n-BuE]3.54±0.28(3) 3.12±0.48(3) 5.83±1.93(3) 722.28±189.04(3)Positive control [aspirin 14mg/(kg.d)]2.88±0.28(3) 6.94±1.43(3) 2.79±0.47(3) 635.09±108.88(3)
NO在脑缺血中的作用日益受到关注,它在脑缺血的不同时期发挥的作用不同,作用机制亦很复杂。NO的生物合成是通过3种不同的一氧化氮合成酶(NOS)催化生成的。3种同工酶包括内皮型(endothelial NOS,eNOS),主要分布在血管内皮细胞;神经元型(neuronal NOS,nNOS),主要分布在神经元和神经胶质细胞内;诱导型(inducible NOS,iNOS),主要分布在巨噬细胞、白细胞等细胞内。其中eNOS和nNOS为结构型NOS(cNOS),主要参与生理功能的调节[9]。目前观点倾向于在局灶性脑缺血中eNOS合成的NO具有神经保护作用,iNOS合成的NO具有神经毒性作用,主要参与迟发性神经元损伤,nNOS合成的NO的作用存在争论,但主要认为其参与了早期的缺血性神经元损伤[10]。本实验结果表明脑缺血再灌注小鼠脑缺血6h后,NO含量增加,而n-BuE可有效降低NO含量,故推测此作用亦是其对脑缺血再灌注小鼠发挥神经保护作用的机制之一。
总之,n-BuE在脑缺血再灌注小鼠可发挥抗氧化作用并调节NO含量,从而发挥出一定的神经保护作用。除此之外,亦有可能有其他机制参与,尚需进一步的研究来阐明n-BuE的神经保护作用机制,为寻找新的治疗脑缺血的药物提供理论依据。
[1]Gibson LM, Brazzelli M, Thomas BM, et al. A systematic review of clinical trials of pharmacological interventions for acute ischaemic stroke (1955-2008) that were completed, but not published in full[R]. Trials, 2010, 11: 43-43.
[2]Liu SE. Medicinal plants of northeast China[M]. Beijing:Science Press, 1959.
[3]Chen C, Sun LF. A Drug for therapy of thrombus obliterans disease and its preparation[P]. Chinese Patent, Patency:CN100998651A, 2007, 07, 18.
[4]Li HY, Chen C. Protective effects of total polyphenols extracted from Toona sinensis on myocardial ischemia/reperfusioninduced injury in rats[J]. Chin J Exp Tradit Med Form, 2011,17(1): 117-119. [李红月, 陈超. 香椿子总多酚对心肌缺血再灌注大鼠的保护作用[J]. 中国实验方剂学杂志, 2011, 17(1):117-119.]
[5]Li HY, Chen C. Interventional effects of pretreatment with total polyphenols extracted from Toona sinensis on the injury induced by myocardial ischemia-reperfusion in rats[J]. Med J Chin PLA,2011, 36(1): 58-60. [李红月, 陈超. 香椿子总多酚预处理对大鼠心肌缺血再灌注损伤的干预作用观察[J]. 解放军医学杂志, 2011, 36(1): 58-60.]
[6]Zhao YP, Qin J, Sun SL. Effects of memantine on expression of Caspase-3 and MDA in rats after ischemia-reperfusion[J]. J Zhengzhou Univ(Med Sci), 2011, 46(5): 748-751. [赵彦坡, 秦洁, 孙石磊. 美金刚对大鼠脑缺血再灌注后Caspase-3表达及丙二醛含量的影响[J]. 郑州大学学报(医学版), 2011, 46(5):748-751.]
[7]Xing SS, Chen C. Study on the antioxidation of polyphenols from the seeds of toona sinensis (A. Juss) roem in vitro[J]. J Anhui Agri Sci, 2010, 38(14): 7285-7287.
[8]Kato H, Kogure K, Araki T, et al. Immunohistochemical localization of superoxide dismutase in the hippocampus following ischemia in a gerbil model of ischemia tolerance[J]. J Cereb Blood Flow Metab, 1995, 15(1): 60-70.
[9]Juan PB, Angeles A. Roles of nitric oxide in brain hypoxiaischemia[J]. Biochem Biophys Acta, 1999, 1411(2-3): 415-436.
[10]Mark SW, Dava G, Shruti S. A nitric oxide donor reduces brain injury and enhances recovery of cerebral blood flow after hypoxia-ischemia in the newborn rat[J]. Neurosci Lett, 2007,415(2): 124-129.
