麦冬提取物的降糖作用及其抗胰岛素抵抗的机制研究
2013-11-02宁萌潘亮谢文利金鑫
宁萌,潘亮,谢文利,金鑫
2型糖尿病(T2DM)占糖尿病患者的90%[1],胰岛功能衰退和胰岛素抵抗(insulin resistance,IR)是其病理生理学基础。目前,T2DM的治疗主要是通过促进β细胞分泌胰岛素或改善靶组织对胰岛素的敏感性进行的,常用药物包括胰岛素及其类似物、磺酰脲类、双胍类、噻唑烷二酮和抗糖尿病中药类等。麦冬为一种常用滋阴中药,药理作用广泛,临床上用于糖尿病辅助治疗效果显著,还可降低糖尿病模型动物的血糖[2]。但文献报道多为复方制剂或粗提物,成分复杂,具体药物成分不清且作用机制不详。本研究选择麦冬的主要成分麦冬多糖(ophiopogonpolysaccharide,OPSR)和麦冬皂苷(ophiopogonin,OPG)为研究对象,以3T3-L1诱导的脂肪细胞建立葡萄糖消耗模型,初步筛选出具有降糖和增加胰岛素敏感性的提取物,观察其对脂肪细胞瘦素、脂联素、抵抗素表达水平的影响,探讨胰岛素增敏相关机制,并应用T2DM模型大鼠进一步验证其治疗效果。
1 材料与方法
1.1 主要材料 3T3-L1前脂肪细胞由同济大学提供。雄性Wistar大鼠,190±10g,由军事医学科学院动物中心提供,动物合格证号SCXK-(军)-2007-004。OPSR(平均分子量5600,纯度90%)、OPG(纯度90%)由本实验室提取。葡萄糖测定试剂盒购自中生北控生物科技股份有限公司。链脲佐菌素(streptozotocin,STZ)、胰岛素(insulin,INS)、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)为美国Sigma公司产品。DMEM高糖培养基为美国Invitrogen公司产品,瘦素抗体、脂联素抗体、抵抗素抗体、β-actin抗体为美国Abcam公司产品。
1.2 3T3-L1脂肪细胞的诱导分化及鉴定 参照文献[3]的方法进行。3T3-L1前脂肪细胞用含10%胎牛血清、100U/ml青霉素、0.1mg/ml链霉素的DMEM完全培养液在37℃、5% CO2、饱和湿度条件下培养,待细胞融合时,更换培养基为含有终浓度10μg/ml INS、1μmol/L地塞米松和0.5mmol/L IBMX的DMEM培养液,培养48h,更换含10μg/ml INS的DMEM培养液继续培养48h,最后以DMEM完全培养液继续培养6d。3T3-Ll细胞诱导分化10d后,加入油红O染液,30min后于显微镜下观察。
1.3 葡萄糖消耗脂肪细胞模型的建立及麦冬提取物的筛选 将分化良好的脂肪细胞分为空白对照组,阳性对照INS组(10mg/L),OPSR组(50、5、0.5mg/L)、OPG组(50、5、0.5mg/L),OPSR(50、5、0.5mg/L)+INS组(10mg/L),OPG(50、5、0.5mg/L)+INS组(10mg/L),共13组,每组设3个复孔。按每孔200μl的量加入含提取物培养基,48h后,吸取细胞培养上清150μl,用葡萄糖检测试剂盒测定培养液中葡萄糖的浓度,计算INS和样品葡萄糖消耗率,用葡萄糖消耗比值计算样品的降糖活性。葡萄糖消耗率(%)=(空白孔葡萄糖浓度-给药孔葡萄糖浓度)/空白孔葡萄糖浓度×100%;葡萄糖消耗比值(%)=(样品孔葡萄糖消耗率/INS孔葡萄糖消耗率)×100%。
1.4 Western blotting检测OPSR对IR脂肪细胞瘦素、脂联素、抵抗素蛋白表达的影响 将分化好的3T3-L1脂肪细胞接种在培养瓶中,加入含1μmol/L地塞米松培养液,温育48h后构建脂肪细胞IR模型[4]。将细胞分为模型对照组,阳性对照罗格列酮(rosiglitazone,RTZ,1×10-6mol/L)组,OPSR低、中、高浓度(1×10-7、1×10-6、1×10-5mol/L)组。加入含OPSR培养液,孵育48h,然后加入INS,使其终浓度为100nmol/L,继续孵育30min。提取各组细胞总蛋白,BCA法蛋白定量,SDSPAGE电泳,经转膜、洗膜、封闭后,在封闭袋中分别加入瘦素、脂联素、抵抗素、β-actin一抗,4℃过夜,漂洗后加入HRP标记的二抗,室温孵育2h,漂洗后ECL发光、显影、定影。以目的蛋白条带与内参条带灰度值的比值作为指标,再将此指标与模型对照组作对比(Folds of control),比较各组之间相对蛋白表达量的差异。
1.5 大鼠T2DM模型的建立及OPSR的治疗作用检测 参照文献[5]方法建立大鼠T2DM模型。大鼠喂以高糖高脂饲料(饲料组成:10%猪油,20%蔗糖,2.5%胆固醇,1%胆酸盐,66.5%常规饲料),以诱导出IR。高糖高脂饮食1个月后,模型组腹腔注射25mg/kg STZ,对照组仅注射枸橼酸缓冲液,STZ注射1周后,测定空腹血糖(fasting blood glucose,FBG)和空腹胰岛素(fasting insulin,FINs),计算胰岛素抵抗稳态评估模型(homeostasis model assessment of insulin resistance,HOMA-IR),用以评价外周胰岛素的抵抗程度。HOMA-IR=(FBG×FINs)/22.5[6]。将符合标准(FBG大于140mg/dl,胰岛素敏感性降低)的大鼠确定为T2DM大鼠。将50只T2DM大鼠随机分为模型组、RTZ(2mg/kg)组及OPSR高、中、低剂量(200、100、50mg/kg)组。另选择10只正常大鼠为作正常对照组。给予OPSR和RTZ灌胃,1次/d,模型组和正常对照组给予生理盐水,连续4周后,测定体重(body weight,BW)及外周血FBG、FINs、甘油三酯(triglyeride,TG)水平。
1.6 统计学处理 应用SPSS 13.0软件进行分析,数据以表示,多组间比较采用单因素方差分析(One-way ANOVA),进一步两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结 果
2.1 3T3-Ll脂肪细胞诱导分化及油红O染色鉴定3T3-Ll前脂肪细胞在诱导分化前表现为成纤维细胞样,胞质中无脂滴,诱导分化10d后,前脂肪细胞变圆、变亮,细胞质中可见大量脂肪滴聚集,经油红O染色后呈鲜红色,视野中90%以上3T3-Ll细胞呈这种脂肪细胞表型(图1)。
2.2 葡萄糖消耗脂肪细胞模型筛选麦冬提取物结果 0.5、5、50mg/L OPSR可不同程度促进脂肪细胞葡萄糖消耗,呈剂量依赖性关系,葡萄糖消耗比值分别为32.27%、75.14%、90.47%,而OPG作用很弱,在50mg/L时葡萄糖消耗比值仅为8.49%。0.5、5、50mg/L OPSR+INS的葡萄糖消耗比值分别为127.37%、113.44%、101.61%,表明OPSR与INS联合使用具有协同作用,能够增加脂肪细胞对INS的敏感性,而OPG作用很弱(图2)。

图1 3T3-L1脂肪细胞诱导分化及油红O染色结果Fig.1 3T3-L1 cells and induced adipocytes stained by oil red O
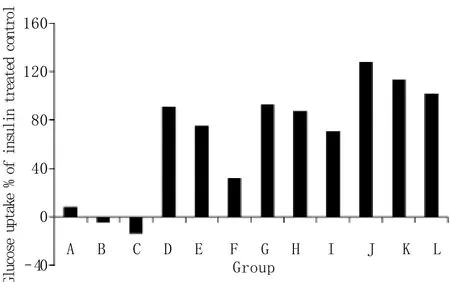
图2 OPSR和OPG作用于3T3-L1细胞后葡萄糖消耗比值Fig.2 Relative value of glucose uptake of 3T3-L1 adipocytes treated with OPSR and OPG
2.3 3T3-L1脂肪细胞瘦素、脂联素、抵抗素蛋白表达水平 各组瘦素、脂联素、抵抗素蛋白表达量与对照组的倍数比(Folds of control)分别为:STZ组1.12±0.06、1.11±0.02、0.88±0.04;OPSR低浓度组1.01±0.01、1.04±0.01、0.97±0.02;OPSR中浓度组1.04±0.01、1.08±0.02、0.93±0.02;OPSR高浓度组1.07±0.01、1.14±0.04、0.88±0.02。与对照组比较,其他各实验组瘦素、脂联素蛋白表达量明显提高且差异有统计学意义(P<0.05),STZ组、OPSR中浓度组和OPSR高浓度组抵抗素蛋白表达量显著降低(P<0.05,图3)。
2.4 OPSR对T2DM大鼠体重及血液生化指标的影响 与正常大鼠比较,经高糖高脂饮食结合小剂量STZ注射,模型组大鼠出现多食、多饮、多尿、体重减轻等糖尿病临床表现,TG和FBG明显升高(P<0.01),FINs没有明显改变,但HOMA-IR显著升高(P<0.01),出现明显IR。说明T2DM病理模型建立成功。治疗4周后,与模型组比较,OPSR高剂量组和RTZ组大鼠体重明显增加,TG、FBG、HOMA-IR显著降低(P<0.05或P<0.01),IR明显改善(表1)。
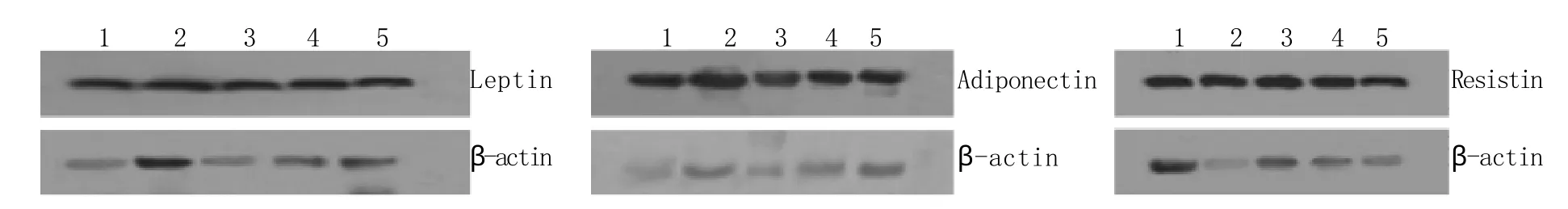
图3 各组3T3-L1脂肪细胞的瘦素、脂联素、抵抗素蛋白表达Fig.3 Expression of leptin, adiponectin and resistin protein of 3T3-L1 cells in different groups
表1 OPSR对T2DM大鼠BW、TG、FBG和FINs的影响(x±s, n=10)Tab.1 Effect of OPSR on BW, TG, FBG, FINs and HOMA-IR in T2DM rats n=10)
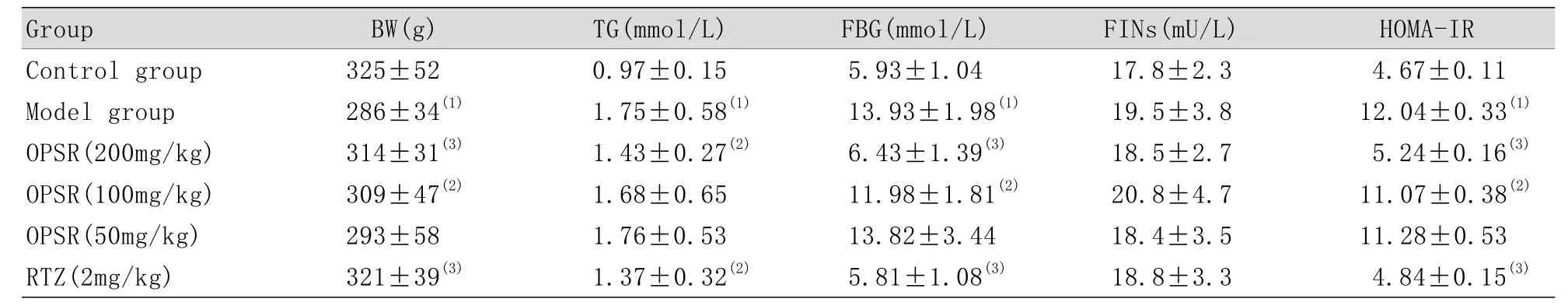
表1 OPSR对T2DM大鼠BW、TG、FBG和FINs的影响(x±s, n=10)Tab.1 Effect of OPSR on BW, TG, FBG, FINs and HOMA-IR in T2DM rats n=10)
(1)P<0.01 compared with control group; (2)P<0.05, (3)P<0.01 compared with model group
Group BW(g) TG(mmol/L) FBG(mmol/L) FINs(mU/L) HOMA-IR Control group 325±52 0.97±0.15 5.93±1.04 17.8±2.3 4.67±0.11 Model group 286±34(1) 1.75±0.58(1) 13.93±1.98(1) 19.5±3.8 12.04±0.33(1)OPSR(200mg/kg) 314±31(3) 1.43±0.27(2) 6.43±1.39(3) 18.5±2.7 5.24±0.16(3)OPSR(100mg/kg) 309±47(2) 1.68±0.65 11.98±1.81(2) 20.8±4.7 11.07±0.38(2)OPSR(50mg/kg) 293±58 1.76±0.53 13.82±3.44 18.4±3.5 11.28±0.53 RTZ(2mg/kg) 321±39(3) 1.37±0.32(2) 5.81±1.08(3) 18.8±3.3 4.84±0.15(3)
3 讨 论
IR是T2DM发病的始动因素,是机体对于胰岛素效应性降低的一种状态,表现为胰岛素效应器官(肝脏、骨骼肌和脂肪)对胰岛素的敏感性降低,其中脂肪组织是IR的始发部位。研究改善IR的药物对于治疗T2DM具有重要意义。Hong等[7]研究显示麦冬水提物能明显促进3T3-L1脂肪细胞基础葡萄糖摄入和胰岛素刺激下的葡萄糖摄入,表明麦冬水提物增加脂肪组织摄取葡萄糖的作用与其增加胰岛素的敏感性有关。但麦冬水提物成分复杂,物质基础不清,具体何种成分在此过程中起主要作用需要进一步研究。本实验建立了3T3-L1诱导的脂肪细胞葡萄糖消耗和IR模型,结合大鼠T2DM模型,从细胞、分子和动物整体水平全面研究了麦冬主要有效成分OPSR、OPG在降糖和增加胰岛素敏感性中的作用及其机制。
本研究结果显示,OPSR可促进3T3-L1诱导的脂肪细胞利用葡萄糖,增加胰岛素的敏感性,而OPG作用不明显,初步推测Hong等[7]研究中麦冬水提物促进3T3-L1脂肪细胞葡萄糖摄入和增加胰岛素敏感性的主要有效成分是OPSR。但是高昌琨等[8]报道OPG对四氧嘧啶、肾上腺素及葡萄糖所致的小鼠高血糖均有明显降糖效果,说明单纯以脂肪细胞为研究对象还不能完全排除OPG的降糖作用,还需要进一步探讨其对胰岛素效应器官骨骼肌和肝脏的作用,并对动物实验进行重复研究。T2DM大鼠模型实验结果显示,OPSR能够降低T2DM大鼠BW、FBG、TG、FINs和HOMA-IR,说明OPSR可以通过改善IR治疗T2DM及其引起的代谢综合征。脂肪组织产生并释放多种脂肪细胞因子,这些脂肪细胞因子分为两大类:一类是具有减弱胰岛素生理功能的细胞因子,如抵抗素、TNF-α等,它们可以诱发和增强IR,从而降低胰岛素敏感性;另一类是具有增强胰岛素生理功能的细胞因子,如脂联素[9]等,它们可以改善IR,从而增强细胞对胰岛素的敏感性。本实验结果显示,OPSR能够剂量依赖性地提高胰岛素抵抗3T3-L1脂肪细胞瘦素、脂联素蛋白表达量,而降低抵抗素蛋白表达量,说明OPSR降糖作用与IR脂肪细胞分泌的脂肪因子有关,可以通过促进脂肪细胞高表达瘦素、脂联素以及抑制脂肪细胞表达抵抗素等脂肪因子而增强脂肪细胞胰岛素敏感性,进而促进对葡萄糖的摄取和利用。
[1]Gong YP, Li CL. The application and special considerations of glucose-lowering medications in elderly patients with type 2 diabetes[J]. Chin J Pract Inter Med, 2011, 31(8): 581-583. [龚燕平, 李春霖. 老年2型糖尿病不同降糖药物应用及特点[J].中国实用内科杂志, 2011, 31(8): 581-583.]
[2]Kako M, Miura T, Usami M, et al. Hypoglycemic effect of the rhizomes of ophiopogonis tuber in normal and diabetic mice[J].Biol Pharm Bull, 1995, 18(5): 785-787.
[3]Cho KW, Zhou Y, Sheng L, et al. Lipocalin-13 regulates glucose metabolism by both insulin-dependent and insulin-independent mechanisms[J]. Mol Cell Biol, 2011, 31(3): 450-457.
[4]Ng Y, Ramm G, James DE. Dissecting the mechanism of insulin resistance using a novel heterodimerization strategy to activate Akt[J]. J Biol Chem, 2010, 285(8): 5232-5239.
[5]Li JW, Guo ZX. Effects of telmisartan on the expression of NADPH oxidase subunits in the myocardium of type 2 diabetic rats[J]. Med J Chin PLA, 2011, 36(10):1037-1040. [李佳伟,郭志新. 替米沙坦对2型糖尿病大鼠心肌NADPH氧化酶亚单位表达的影响[J]. 解放军医学杂志, 2011, 36(10): 1037-1040.]
[6]Musen G, Jacobson AM, Bolo NR, et al. Resting-state brain functional connectivity is altered in type 2 diabetes[J]. Diabetes,2012, 61(9): 2375-2379.
[7]Hong SJ, Fong JC, Hwang JH. Effects of crude drugs on glucose uptake in 3T3-L1 adipocytes[J]. Kaohsiung J Med Sci, 2000,16(9): 445-451.
[8]Gao CK, Gao J, Xu XX. Effect of tatal saponins of ophiopogon on experimental hyperglycemias mice[J]. Chin J Exper Trad Med Formu, 2007, 13(5): 33-34. [高昌琨, 高建, 徐先祥. 麦冬总皂苷对实验性高血糖小鼠的降糖作用[J]. 中国实验方剂学杂志, 2007, 13(5): 33-34.]
[9]Schipper HS, Rakhshandehroo M, de Graaf SF V, et al. Natural killer T cells in adipose tissue prevent insulin resistance[J]. J Clin Invest, 2012, 122(9): 3343-3354.
