重视战创伤急性凝血功能障碍的早期诊断与治疗
2013-11-02黎介寿李幼生
黎介寿,李幼生
创伤患者常伴随大量失血。难以控制的出血是创伤早期死亡的主要原因,约占创伤患者死因的40%[1],而并发凝血功能障碍的患者需要更多的输血,同时由于器官损伤、感染并发症及救治时间延长,伤死率增加约4倍[2]。传统观点认为创伤导致的凝血功能障碍(trauma-induced coagulopathy,TIC)与失血复苏后凝血因子和血小板的稀释及功能障碍,以及后期的低温和酸中毒有关。近年来研究发现创伤后早期即可出现凝血功能障碍,25%~35%的患者在到达急诊室时就存在凝血功能障碍[3]。这种凝血功能障碍发生于凝血因子消耗与液体复苏前,也不存在酸中毒及低温,因此将其称为急性创伤性凝血功能障碍(acute traumatic coagulopathy,ATC)。传统的出凝血检测手段难以反映凝血过程的全貌,不能提示TIC特别是ATC的发生机制,对临床治疗创伤患者的凝血功能障碍指导价值有限,而黏弹性止血试验(viscoelastic haemostatic assays,VHA)技术的发展促进了创伤患者凝血功能障碍的治疗,即早期目标导向凝血治疗(early goal-directed coagulation therapy,EGCT)。
1 重新认识ATC的发生机制
数十年来,输血与复苏技术成功救治了大批战伤与平时创伤患者的生命,但直至20世纪80年代,大量液体与红细胞复苏对凝血功能的影响仍很少受到关注。1983年Stone提出了损伤控制性外科的理念,使相关研究者进一步认识到凝血功能障碍、低温、代谢性酸中毒构成了创伤患者的致命三联征,随后加强了对TIC的研究。长期以来TIC一直被视为三峰模式,即创伤后即刻的高凝状态很快转为低凝状态,到终末阶段再次出现高凝状态。长期以来凝血因子消耗(出血及消耗)、稀释(继发于大量液体复苏)及功能障碍(酸中毒与低温)被认为是TIC的始动因素,但近期研究显示这些因素的作用被夸大了[4]。2003年两个独立的研究同时发现TIC出现在复苏前,如仅有低灌注即可观察到TIC,而此时并未出现凝血因子消耗。由直升机运送至伦敦皇家医院(Royal London Hospital)的1000例严重创伤患者,到达医院时有24.4%存在凝血功能障碍,存在ATC的患者伤死率更高(19.3% vs 6.3%)[5]。MacLeod等[6]基于20 000例创伤患者的回顾性研究亦发现,28%的患者在到达医院前表现为凝血功能障碍,存在ATC者的伤死率是无ATC者的4倍(46.0% vs 10.9%)。Floccard等[4]发现即使在事故现场(即创伤后25min内),已有56%的患者出现凝血异常。Brohi等[7]随后证实创伤严重评分(>15)与组织低灌注(剩余碱>6mmol/L)是导致ATC的关键因素,而组织损伤与低灌注是导致ATC的必需条件。这种创伤后早期的凝血功能障碍与传统意义上的TIC发生机制并不完全相同,其驱动因素为组织损伤、休克及全身低灌注,属于促凝血因子、抗凝因子、血小板、内皮组织和纤维蛋白溶解失衡所致的内源性凝血功能障碍。因此,这种创伤后早期的凝血功能障碍被称为ATC或内源性急性凝血障碍(endogenous acute coagulopathy)。随后的研究证实ATC是由蛋白质C激活介导的,蛋白质C是一种丝氨酸蛋白酶,正常情况下其主要功能是维持低流量状态下微循环血栓形成的平衡。蛋白质C的激活需要血栓调节蛋白、内皮细胞蛋白C受体(EPCR)、凝血酶等参与,一旦被激活,即可通过两条途径影响凝血功能:一是直接途径,即激活的蛋白质C通过酶水解直接清除或抑制凝血因子Ⅴa、Ⅶa活性,从而阻止血凝块的形成;二是间接途径,即通过广泛的血管内皮细胞损伤促进血栓调节蛋白和EPCR聚积[8-9]。
尽管血小板在凝血过程中具有重要作用,但到目前为止关于血小板在ATC中的作用认识尚浅。Wohlauer等[10]发现创伤后30min内患者二磷酸腺苷对血小板功能的抑制作用远高于正常人(86.1% vs 4.2%),而花生四烯酸体外刺激血小板活化的能力在创伤早期与正常人比较亦受到严重影响(44.9% vs 0.5%)。综合目前研究认为,创伤患者在输液与输血前即出现了早期血小板功能障碍。
2 积极应用凝血功能诊断新技术
传统凝血试验(standard coagulation tests,SCT)检测内容包括凝血酶原时间(PT)、凝血酶时间(TT)、国际标准化比率(INR)、凝血酶原时间指数(PTR)及活化部分凝血活酶时间(APTT)等,但并不能准确地描述凝血的复杂本质,其中PT、APTT、TT等检测都是基于孤立的、静态的单个点的凝血检测方法,更不能反映血小板功能。SCT采用离心后的血浆,反映的是最初的纤维蛋白形成,而此时生成的凝血酶仅占整个凝血过程的5%。纤溶亢进被认为是创伤死亡的一个潜在因素,SCT对此没有任何诊断价值。对创伤患者而言,SCT另一重大缺陷就是测试时间长(平均78~88min),难以在床旁完成。
早期临床检测VHA常采用血栓弹力图分析仪(thrombelastography,TEG)、旋转式血栓弹力测定法(thromboelastometry,以前称为rotational thrombelastometry/-graphy,ROTEM)等,近年来计算机技术的发展使VHA设备小型化、快速化,在临床得到迅速应用。与SCT方法相比,VHA的优点表现为[11-13]:①检测时间短,省略了离心、分离的步骤,能在30min内检测出凝血状态及血小板功能;②可反映患者实际体温下的凝血状态,而SCT是在37℃状态下进行检测,不能反映出低体温对凝血功能的影响;③能够检测纤维蛋白溶解及血小板功能,严重创伤患者20%以上表现为纤溶亢进;④能够检测内在凝血因子缺乏导致的凝血异常。总之,与SCT相比,VHA能够反映创伤患者凝血状态的全貌,鉴别凝血功能障碍的原因,更有助于早期诊断凝血功能障碍(特别是纤溶亢进),指导输血治疗[13]。美军曾在伊拉克与阿富汗战场上使用并比较SCT和TEG检测结果对使用血液制品的指导价值,尽管SCT也能够鉴别患者的低凝状态,但结果不能指导血液制品的使用,而TEG检测结果对血液制品使用(特别是血小板输注)具有更好的指导价值[14]。
3 重视EGCT
从20世纪70年代的基于全血复苏,到大容量晶体、携氧复苏,再到当代的基于血浆的复苏,特别是当前损伤控制外科(DCS)理论在创伤救治中的广泛应用,复苏时凝血功能障碍的预防与治疗逐渐受到重视,其中最具有代表性的新理论是EGCT。EGCT是早期目标导向液体治疗理论与VHA技术的完美结合。VHA检测所需时间十分短暂,为快速诊断与个体化治疗提供了可能,并可通过动态检测连续评估治疗效果及进一步优化治疗方案,并尽可能减少治疗副作用。这一“诊断性、导向性治疗”理念的雏形是根据VHA结果指导成分输血[15],随后发展为目标导向止血复苏[16],最后形成EGCT[17]。
使用血液制品的第一个目的是维持血红蛋白(Hb)水平。美国麻醉医师学会要求创伤患者Hb维持在60~100g/L,欧洲为70~90g/L,为了达到Hb的预定目标,失血患者不可避免地要接受输血,而需要大量输血的患者多数在入院24h内得不到足够的新鲜冷冻血浆(FFP)和血小板浓集液(PC),而创伤后早期输注大量FFP和PC能显著提高严重创伤患者的生存率。输入FFP的量与时机是近年来争议颇多的话题,主要集中在FFP与红细胞(RBC)的最佳输注比例方面。2007年Borgman等[18]首次报道创伤患者接受大量输血时,接受高FFP:RBC比(1:1.4)输注的患者伤死率(19%)低于接受中(1:2.5)、低(1:8)比例输注者(分别为34%、65%)。平时创伤患者的回顾性研究结果表明,较高的FFP:RBC比例(>1:1)能有效降低手术率以及24h和30d内的伤死率,进一步延伸研究发现提高血小板(PC):RBC比例同样能够提高生存率[19]。综合目前最新研究结果表明,以血浆为基础的复苏能够明显改善创伤患者的凝血功能障碍。但对大量输血时高FFP:RBC比尚有争议,其焦点集中在是高FFP:RBC比提高了患者生存率还是患者生存时间较长而接受了更多的FFP输注。Kashuk等[14]发现FFP:RBC之比为1:2时创伤患者生存率最高,而进一步提高FFP:RBC之比反而会增加伤死率。Davenpor 等[20]同样证实最佳FFP:RBC之比为1:2。Simmons等[21]报道在伊拉克战争中采用FFP:RBC比更高的临床治疗指南,也未证实过多的FFP输注不能提高生存率。因此,尽管很多研究都支持在创伤早期积极应用FFP,但最佳FFP:RBC比仍无定论,特别是不同程度及不同原因的创伤可能直接影响最佳FFP与RBC之比。
血小板是血凝块质量的决定性因素,为凝血因子发挥作用提供了基础。研究显示,TEG结果能够更好地指导创伤患者的血小板输注,且能够提高生存率[22]。纤维蛋白原在创伤早期即可降至非常危险的低水平,欧洲治疗指南推荐创伤患者纤维蛋白原不低于1.5~2.0g/L,低于此浓度应使用浓缩纤维蛋白原(3~4g)或冷沉淀(50mg/kg或15~20U)[22]。
ⅩⅢ因子的主要作用是加强纤维蛋白凝块强度,保护其免于被纤溶系统消除。重组Ⅶ因子(rFⅦa)于1999年首次应用于创伤出血患者,此后被广泛用于临床大量输血患者,后来被证实能够逆转几乎所有凝血因子缺乏导致的凝血功能障碍。近年来有部分研究认为rFⅦa不能改善凝血功能障碍,可能与使用rFⅦa的方法不合理有关。血液稀释、酸中毒及低温可影响rFⅦa活性,如pH值从7.4降至7.0,则rFⅦa活性降低60%~90%,rFⅦa给予时间亦影响其使用效果与患者预后,到达医院后2h内应用rFⅦa可明显改善创伤患者的预后。究竟应在输入多少RBC后应用rFⅦa尚有争议,多数认为应该遵守“10U原则”,即输注10U RBC就应使用rFⅦa[23]。
美国丹佛医疗中心根据TEG检测结果设计的EGCT流程图(图1)强调根据VHA检测结果进行目标导向凝血功能障碍治疗,通过快速补充足量的FFP,使FFP与浓缩红细胞的最终比例达到1:2~1:3。EGCT通过比较r-TEG的轨迹而准确、逐步地纠正凝血功能障碍。Schöchl等[24]比较了以FFP为基础与以凝血因子浓度为目标的导向治疗的结果,在急诊与手术期间前者输注6U FFP,后者给予6g纤维蛋白原及1200U 凝血酶原复合物,避免输注RBC的比例分别为3%、29%,避免输注血小板的比例分别为56%、91%,两组死亡率无明显差异(10.0% vs 7.5%),提示采用TEG指导目标导向凝血治疗能够明显降低创伤患者暴露于异体血的风险。
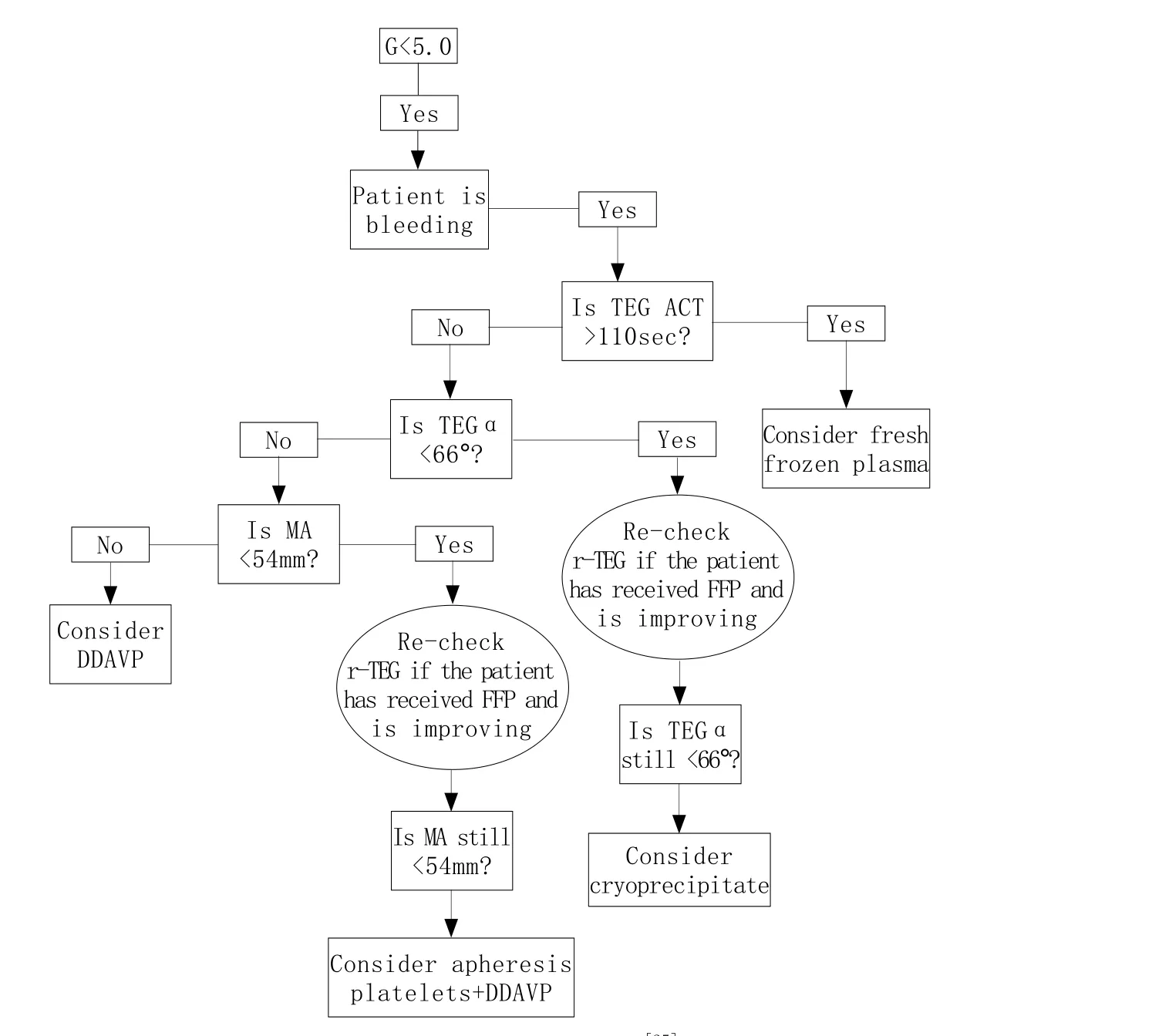
图1 丹佛中心EGCT流程图[25]Fig. 1 The algorithm of early goal-directed coagulation therapy used at Denver Health Medical Center
4 结 论
近年来对EGCT的研究表明其优点主要表现为[3]:①通过对可鉴别的凝血功能异常进行特异的目标导向治疗,减少输血量;②通过更有效地恢复生理性自体调节,及早纠正凝血功能异常;③纠正凝血功能障碍后,止血改善,急性失血期的生存率提高;④减少了液体输注量,减轻了免疫炎症反应失衡及后续的系列并发症如急性呼吸窘迫综合征(ARDS)、多器官功能衰竭(MOF)等;⑤对ATC有了更深刻的认识;⑥有助于制定更合理的、个体化的TIC治疗方案。
[1]Evans JA, van Wessem KJ, McDougall D, et al. Epidemiology of traumatic deaths: comprehensive population-based assessment[J]. World J Surg, 2010, 34(1): 158-163.
[2]Maegele M, Lefering R, Yucel N, et al. Early coagulopathy in multiple injury: an analysis from the German Trauma Registry on 8724 patients[J]. Injury, 2007, 38(3): 298-304.
[3]Kashuk JL, Moore EE, Sawyer M, et al. Postinjury coagulopathy management: goal directed resuscitation via POC thrombelastography[J].Ann Surg, 2010, 251(4): 604-614.
[4]Floccard B, Rugeri L, Faure A, et al. Early coagulopathy in trauma patients: an on-scene and hospital admission study[J]. Injury, 2012, 43(1):26-32.
[5]Frith D, Davenport R, Brohi K. Acute traumatic coagulopathy[J]. Curr Opin Anaesthesiol, 2012, 25(2): 229-234.
[6]MacLeod JB, Lynn M, McKenney MG, et al. Early coagulopathy predicts mortality in trauma[J]. J Trauma, 2003, 55(1): 39-44.
[7]Brohi K, Cohen MJ, Ganter MT, et al. Acute traumatic coagulopathy: initiated by hypoperfusion: modulated through the protein C pathway[J]? Ann Surg, 2007, 245(5): 812-818.
[8]Cohen MJ. Towards hemostatic resuscitation: the changing understanding of acute traumatic biology, massive bleeding, and damage-control resuscitation[J]. Surg Clin North Am, 2012, 92(4): 877-891.
[9]Rizoli SB, Scarpelini S, Callum J, et al. Clotting factor deficiency in early trauma-associated coagulopathy[J]. J Trauma, 2011, 71(5 Suppl 1):S427-S434.
[10]Wohlauer MV, Moore EE, Thomas S, et al. Early platelet dysfunction: an unrecognized role in the acute coagulopathy of trauma[J]. J Am Coll Surg, 2012, 214(5): 739-746.
[11]Wikkelsoe AJ, Afshari A, Wetterslev J, et al. Monitoring patients at risk of massive transfusion with Thrombelastographyor Thromboelastometry: a systematic review[J]. Acta Anaesthesiol Scand, 2011, 55(10): 1174-1189.
[12]Casutt M, Konrad C, Schuepfer G. Effect of rivaroxaban on blood coagulation using the viscoelastic coagulation test ROTEMTM[J].Anaesthesist, 2012, 61(11): 948-953.
[13]Johansson PI. Coagulation monitoring of the bleeding traumatized patient[J]. Curr Opin Anaesthesiol, 2012, 25(2): 235-241.
[14]Kashuk JL, Moore EE, Johnson JL, et al. Postinjury life threatening coagulopathy: is 1:1 fresh frozen plasma: packed red blood cells the answer[J]? J Trauma, 2008, 65(2): 261-270.
[15]Johansson PI. Goal-directed hemostatic resuscitation for massively bleeding patients: the Copenhagen concept[J]. Transfus Apher Sci, 2010,43(3): 401-405.
[16]Schöchl H, Nienaber U, Hofer G, et al. Goal-directed coagulation management of major trauma patients usingthromboelastometry (ROTEM)-guided administration of fibrinogen concentrate and prothrombin complex concentrate[J]. Crit Care, 2010, 14(2): R55.
[17]Johnson JL, Moore EE, Kashuk JL, et al. Effect of blood products transfusion on the development of postinjury multiple organ failure[J]. Arch Surg, 2010, 145(10): 973-977.
[18]Borgman MA, Spinella PC, Perkins JG, et al. The ratio of blood products transfused affects mortality in patients receiving massivetransfusions at a combat support hospital[J]. J Trauma, 2007, 63(4): 805-813.
[19]Holcomb JB, Wade CE, Michalek JE, et al. Increased plasma and platelet to red blood cell ratios improves outcome in 466 massively transfused civilian trauma patients[J]. Ann Surg, 2008, 248(3): 447-458.
[20]Davenport R, Curry N, Manson J, et al. Hemostatic effects of fresh frozen plasma may be maximal at red cell ratios of 1:2[J]. J Trauma, 2011,70(1): 90-95.
[21]Simmons JW, White CE, Eastridge BJ, et al. Impact of improved combat casualty care on combat wounded undergoing exploratory laparotomy and massive transfusion[J]. J Trauma, 2011,71(1 Suppl):S82-S86.
[22]Stinger HK, Spinella PC, Perkins JG, et al. The ratio of fibrinogen to red cells transfused affects survival in casualties receiving massive transfusions at an army combat support hospital[J]. J Trauma, 2008, 64(2 Suppl): S79-S85.
[23]Neal MD, Marsh A, Marino R, et al. Massive transfusion: an evidence-based review of recent developments[J]. Arch Surg, 2012, 147(6): 563-571.
[24]Schöchl H, Nienaber U, Maegele M, et al. Transfusion in trauma: thromboelastometry-guided coagulation factor concentrate-based therapy versus standard fresh frozen plasma-based therapy[J]. Crit Care, 2011, 15(2): R83.
[25]Kashuk JL, Moore EE, Sawyer M, et al. Postinjury coagulopathy management: goal directed resuscitation via POC thrombelastography[J].Ann Surg, 2010, 251(4): 604-614.
