骨髓间质干细胞对小鼠皮肤瘢痕形成的抑制作用观察
2013-11-02武艳冯长江恩和吉日嘎拉黄沙马奎杨思明孙同柱付小兵
武艳,冯长江,恩和吉日嘎拉,黄沙,马奎,杨思明,孙同柱,付小兵
瘢痕形成是组织损伤修复的正常过程,适度的瘢痕形成是一种生理性和自卫性表现,而过度增生则属于病理性改变。瘢痕可形成于机体的任何组织,临床最常见的是皮肤组织。当皮肤受到较重损伤后,无法达到完美修复,往往会形成难愈性瘢痕,对患者的生理和心理产生巨大影响。瘢痕形成的发生机制尚不明确,临床治疗一直难以取得突破。当前干细胞在再生医学中的应用已成为研究热点,骨髓间质干细胞(BM-MSCs)能够促进组织修复[1-2],且在动物模型中发现其可减轻心[3]、肺[4]、肝[5]、肾[6]等多种器官的纤维化及腹膜纤维化[7],有望在皮肤创面愈合过程中产生积极影响。因此,本研究采用同源BM-MSCs在不同时间点多次移植于博来霉素诱导的小鼠皮肤瘢痕模型[8],以验证BMMSCs移植对皮肤瘢痕的作用。
1 材料与方法
1.1 实验动物及主要试剂 健康C57BL/6小鼠(模型建立及移植用:雌性,7~8周龄,体重23±3g;提取BM-MSCs用:雄性,3~4周龄,体重12±2g)由北京华阜康生物科技股份有限公司提供,许可证编号SCXK京2009-0007。DMEM/F12培养基、胎牛血清及胰酶购自Gibco公司,BM-MSCs成骨、成脂诱导培养基所需成分磷酸甘油钠、抗坏血酸磷酸盐、地塞米松、胰岛素、3-异丁基-1-甲基黄嘌呤(IBMX)、吲哚美辛、L-脯氨酸、丙酮酸钠购自Sigma公司,ITS-Premix购自BD公司,博来霉素购自日本化药株式会社,转化生长因子β1(TGF-β1)抗体及α-平滑肌肌动蛋白(α-SMA)购自Abcam公司,Cy3标记的山羊抗兔IgG(H+L)及抗荧光猝灭封片剂购自碧云天公司,DAB显色剂购自北京中杉金桥公司。CO2恒温培养箱购自美国Thermo公司,荧光倒置显微镜购自日本Olympus公司。
1.2 BM-MSCs的分离及培养 将3~4周龄雄性C57BL/6小鼠颈椎脱臼处死,分离出股骨和胫骨,去除韧带和多余组织,置于加双抗的D-Hanks'液中;用注射器冲出骨髓细胞,70μm细胞滤网过滤,吹打制成单细胞悬液;将细胞接种在含10%FBS的DMEM/F12完全培养液(含100U/ml青霉素和100mg/ml链霉素)中,3d后更换培养液,去掉非贴壁细胞,此后每2d换液1次,待细胞生长融合达90%后消化传代。实验采用第3~5代细胞。
1.3 BM-MSCs的成骨、成脂分化功能鉴定 选取生长状态良好的第3代细胞分别加入成骨诱导体系[DMEM/F12(含10%胎牛血清),10mmol/L β-磷酸甘油,50μmol/L抗坏血酸磷酸盐,0.1μmol/L地塞米松]和成脂诱导培养体系[DMEM/F12(含10%胎牛血清),1μmol/L地塞米松,10μg/ml胰岛素,0.5mmol/L IBMX,200μmol/L吲哚美辛],每72h换液1次。成骨诱导时间为3周,成脂诱导时间为2周。通过茜素红染色显示钙化结节沉积了解成骨情况,通过油红O染色显示脂肪空泡形成了解成脂情况。
1.4 实验动物分组及给药方式 将30只7~8周龄雌性C57BL/6小鼠随机分为对照组、皮肤瘢痕模型组及BM-MSCs移植组,每组10只。模型组和BMMSCs移植组小鼠经背部皮下注射1ml浓度为1mg/ml的博来霉素(PBS溶解),3h后BM-MSCs移植组经皮下注射1×106个BM-MSCs,模型组给予相同剂量的PBS,对照组于相同时间点分别皮下注射相同剂量PBS。各组小鼠均连续注射28d,于第29天处死全部小鼠,取新鲜皮肤组织制备冰冻切片,另取皮肤组织经4%多聚甲醛固定,常规石蜡包埋切片,用于病理组织学观察及免疫组织化学检测。
1.5 TGF-β1表达水平的免疫荧光分析 新鲜皮肤组织经OCT包埋,冰冻切片,厚6μm,100%甲醇固定10min,然后经硼氢化钠(1mg/ml,PBS溶解)孵育10min以降低自发荧光,0.5% Triton-X-100常温孵育60min以透化固定后的细胞,进口羊血清封闭液封闭30min,加入TGF-β1兔抗小鼠一抗稀释液(1:500)4℃过夜,加入Cy3标记的山羊抗兔IgG(H+L)室温孵育2h,避光,抗荧光淬灭,封片剂封片,荧光倒置显微镜下观察并照相。
1.6 病理组织学观察 石蜡包埋皮肤组织常规切片,厚5μm,行HE及Masson's Trichome染色,光学显微镜下观察。
1.7 α-SMA表达的免疫组织化学检测 石蜡包埋皮肤组织标本常规切片,厚5μm,脱蜡,3% H2O2室温孵育5~10min灭活内源性过氧化物酶,加入抗小鼠α-SMA单克隆抗体(1μg/ml),4℃过夜,DAB显色,苏木素复染,中性树胶封片,光学显微镜下观察,并比较各组之间α-SMA的阳性表达量。
1.8 统计学处理 采用SPSS 11.0软件进行统计分析,数据结果以x±s表示,组间比较采用单因素方差分析,进一步两两比较采用SNK法(q检验)。P<0.05为差异有统计学意义。
2 结 果
2.1 BM-MSCs的分离培养 分离的BM-MSCs在接种24h后开始贴壁生长,3d后贴壁细胞明显增多,并首次换液,去除未贴壁细胞,以后每隔2d换液,接种7d后细胞呈克隆样生长,多呈纺锤形或梭形,接种后10~12d克隆之间逐渐融合,呈辐射状或漩涡状排列,并铺满整个培养瓶底部(图1)。
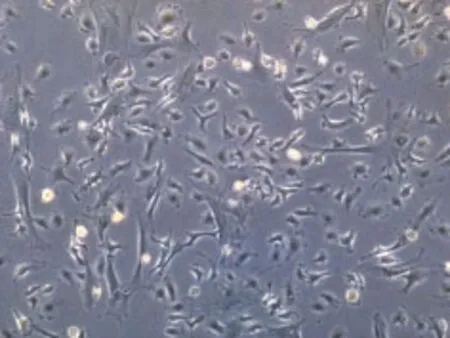
图1 倒置显微镜下观察小鼠BM-MSCs形态(×100)Fig. 1 Morphology of mouse BM-MSCs under inverted microscope(×100)
2.2 小鼠 BM-MSCs 的成骨、成脂分化鉴定 选取生长状态良好的第3代细胞,在成骨分化体系中诱导3周,茜素红染色结果显示有钙化结节形成(图2A);在成脂分化体系中诱导2周,油红O染色可见明显的脂肪滴形成(图2B)。
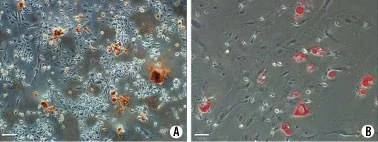
图2 BM-MSCs成骨、成脂分化形态观察Fig. 2 Morphology of BM-MSCs osteogenic (A) and lipoblast(B) differentiation
2.3 各组小鼠皮肤组织学检测及真皮厚度比较HE及Masson's Trichome染色显示:对照组皮肤组织结构完整,呈红染波纹状,胶原纤维较细,密集排列,纤维间和纤维周围可见部分成纤维细胞,无炎性细胞浸润;模型组表皮层上皮增厚明显,真皮层胶原沉积增加,胶原束增粗,排列不规则,脂肪层由结缔组织取代,并可见大量炎性细胞浸润;BM-MSCs移植组胶原排列与正常皮肤组织相似,部分脂肪层为结缔组织取代,可见少量炎性细胞(图3)。为评价各组纤维化的程度,对真皮厚度进行测量,结果显示模型组的真皮厚度(420.3±35.2μm)显著高于BM-MSCs移植组(291.1±16.8μm,P<0.05)及对照组(221.4±20.5μm,P<0.01),且BM-MSCs移植组的真皮厚度明显高于对照组(P<0.05)。
2.4 各组小鼠皮肤组织中TGF-β1的表达 TGF-β1呈红色荧光。免疫荧光检测显示对照组和BM-MSCs移植组中的TGF-β1表达较少,而模型组TGF-β1大量表达(图4)。
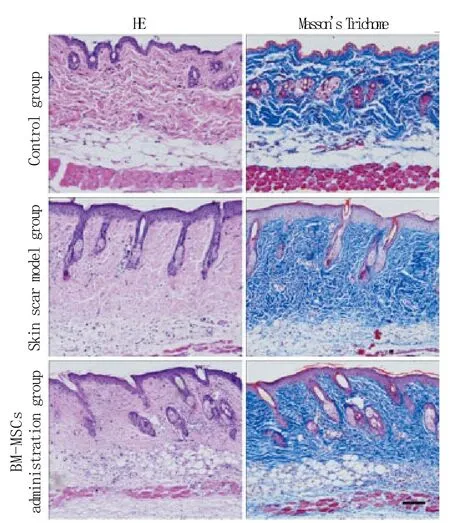
图3 小鼠皮肤组织学染色结果(×100)Fig. 3 Skin histology of C57BL/6 mice (×100)

图4 皮肤组织中TGF-β1表达的免疫荧光检测Fig. 4 Expression of TGF-β1 in skin tissue by immunofluorescene assay
2.5 各组小鼠皮肤组织中α-SMA蛋白的表达 免疫组织化学染色显示,α-SMA阳性表达呈棕黄色颗粒状,位于细胞质中。对照组α-SMA蛋白几乎全部表达于皮肤血管平滑肌细胞(19±3个/高倍视野),而模型组除了血管平滑肌外,可见大量α-SMA表达于肌成纤维细胞(105±11个/高倍视野),MSCs移植组表达α-SMA的肌成纤维细胞(46±7个/高倍视野)明显少于模型组(图5)。
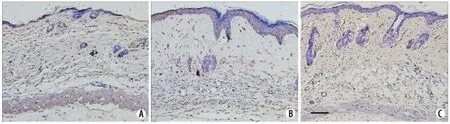
图5 皮肤组织中α-SMA蛋白表达的免疫组织化学检测Fig. 5 Expression of α-SMA protein in skin tissue of mice by immunohistochemical test
3 讨 论
皮肤受到较严重损伤后,往往会过度修复形成瘢痕,即细胞外基质过度堆积,同时伴有胶原的合成与降解失衡。但由于皮肤瘢痕的形成机制复杂[9-10],对其治疗的研究尚处于探索之中。细胞移植治疗具有来源广泛、创伤小及可重复等优点,成体干细胞及再生医学相关技术的应用为皮肤愈合中瘢痕抑制的研究提供了获得重大突破的可能。BM-MSCs是干细胞家族的重要成员,具有自我更新和多向分化潜能。成年人骨髓中BM-MSCs含量很少[11],但具有很强的体外扩增能力,可动员、归巢并扩充到损伤部位参与创伤修复,且可取自自体骨髓,取材方便,在移植时不存在组织配型及免疫排斥等问题[12],因而可作为候选的种子细胞用于抑制瘢痕的形成。
既往研究发现,BM-MSCs作用时间较短,24h后即被清除[13-14],因此在本实验中,我们采用经局部皮下多次移植BM-MSCs的方法,病理及皮肤真皮厚度检测结果证实,移植的BM-MSCs能有效抑制博来霉素诱导的小鼠皮肤瘢痕形成。TGF-β1是纤维化形成过程中的关键细胞因子,是迄今发现的最强的可促进细胞外基质沉积的蛋白,作用于瘢痕形成的多个环节,刺激各种细胞外基质成分的合成及沉积,包括上调基质成分的转录、翻译,促进基质蛋白及受体产生,减少基质降解酶以及降解抑制剂的合成等[15-16]。另外,在瘢痕的真皮中肌成纤维细胞增多,可促进纤维化的病理过程[17],促进细胞外基质(主要是胶原)的合成[18]。本研究发现,BM-MSCs移植组中TGF-β1和α-SMA的表达均较模型组明显减少,推测BM-MSCs可能与皮肤局部微环境互相作用,通过影响信号转导系统抑制TGF-β1等致纤维化细胞因子的生成,降低胶原的合成,减少组织中胶原的沉积,从而起到抑制瘢痕形成的作用。
本研究结果表明,多次BM-MSCs移植能有效抑制博来霉素诱导的皮肤瘢痕形成,移植的BMMSCs可能与局部微环境相互作用,影响了TGF-β1等重要细胞因子的表达,抑制了肌成纤维细胞的增多,降低了胶原的合成,但其相关的信号转导机制仍需进一步研究。总之,本研究为病理性瘢痕的治疗提供了一种新的策略,也为干细胞用于临床治疗提供了新的理论和实验依据。
[1]Amado LC, Saliaris AP, Schuleri KH, et al. Cardiac repair with intramyocardial injection of allogeneic mesenchymal stem cells after myocardial infarction[J]. Proc Natl Acad Sci USA, 2005,102(32): 11474-11479.
[2]Uccelli A, Moretta L, Pistoia V. Mesenchymal stem cells in health and disease[J]. Nat Rev Immunol, 2008, 8: 726-736.
[3]Timmers L, Lim SK, Arslan F, et al. Reduction of myocardial infarct size by human mesenchymal stem cell conditioned medium[J]. Stem Cell Res Nov, 2007, 1(2):129-137.
[4]Kim SY, Lee JH, Kim HJ, et al. Mesenchymal stem cellconditioned media recovers lung fibroblasts from cigarette smoke-induced damage[J]. Am J Physiol Lung Cell Mol Physiol,2012, 302(9): L891-L908.
[5]Abdel Aziz MT, Atta HM, Mahfouz S, et al. Therapeutic potential of bone marrow-derived mesenchymal stem cells on experimental liver fibrosis[J]. Clin Biochem, 2007, 40(12):893-899.
[6]Semedo P, Correa-Costa M, Cenedeze MA, et al. Mesenchymal stem cells attenuate renal fibrosis through immune modulation and remodeling properties in a rat remnant kidney model[J].Stem Cells, 2009, 27(12): 3063-3073.
[7]Wang N, Zhang L, Li QG, et al. Study on functional mode of marrow mesenchymal stem cells to acute peritoneal fibrosis[J].Med J Chin PLA, 2011, 36(12): 1263-1268.[王楠, 张利, 李清刚, 等. 骨髓间充质干细胞治疗急性腹膜纤维化的作用方式探讨[J]. 解放军医学杂志, 2011, 36(12): 1263-1268.]
[8]Yamamoto T, Kuroda M, Nishioka K. Animal model of sclerotic skin. III: Histopathological comparison of bleomycin-induced scleroderma in various mice strains[J]. Arch Dermatol Res,2000, 292(11): 535-541.
[9]Rhett JM, Ghatnekar GS, Palatinus JA, et al. Novel therapies for scar reduction and regenerative healing of skin wounds[J]. Cell,2008, 26(4): 173-180.
[10]Liu W, Wu XL, Gao Z. New potential antiscarring approaches[J].Wound Rep Reg, 2011, 19(Suppl 1): S22-S31.
[11]Parekkadan B, Milwid JM. Mesenchymal stem cells as therapeutics[J]. Annu Rev Biomed Eng, 2010, 12: 87-117.
[12]Chen L, Tredget EE, Liu C, et al. Analysis of allogenicity of mesenchymal stem cells in engraftment and wound healing in mice[J]. PloS one, 2009, 4(9): 1-7.
[13]Gao J, Dennis J, Muzic R, et al. The dynamic in vivo distribution of bone marrow-derived mesenchymal stem cells after infusion[J]. Cells Tissues Organs, 2001, 169(1): 12-20.
[14]Schrepfer S, Deuse T, Reichenspurner H, et al. Stem cell transplantation: the lung barrier[J]. Transplant Proc, 2007,39(2): 573-576.
[15]Krieglstein K, Miyazono K, Dijke P, et al. TGF-β in aging and disease[J]. Cell Tissue Res, 2012, 347(1): 5-9.
[16]Arany PR, Flanders KC, Kobayashi T, et al. Smad3 deficiency alters key structural elements of the extracellular matrix and mechanotransduction of wound closure[J]. PNAS, 2006,103(24): 9250-9255.
[17]Ludwicka A, Trojanowska M, Smith EA, et al. Growth and characterization of fibroblasts obtained from bronchoalveolar lavage of patients with scleroderma[J]. J Rheumatol, 1992,19(11): 1716-1723.
[18]Gabbiani G. The myofibroblast in wound healing and fibrocontractive diseases[J]. J Pathol, 2003, 200(4): 500-503.
