TLM钛合金表面白蛋白涂层的制备及抗凝血性研究
2013-10-31刘春潮于振涛韩建业牛金龙
刘春潮,于振涛,余 森,韩建业,牛金龙
(西北有色金属研究院,陕西 西安 710016)
0 引言
生物医用钛合金材料由于其良好的生物相容性、在血液环境中极为卓越的耐腐蚀性能和物理化学稳定性、出色的综合力学性能匹配,而成为最具发展前途的生物材料,已在心脑血管介入医学领域得到了广泛的关注,并已开始部分替代目前临床常用的316L不锈钢。但是,血液接触类金属医疗器械由于自身固有的物理特性和表面特征,植入人体后,在充满电解质的血液中其表面会迅速产生蛋白质吸附、腐蚀以及对血管壁的损伤等界面过程,而这些都会引起支架表面局部凝血,进而触发产生血栓[1-2]。
已有大量研究结果发现,生物材料植入体内后,几秒钟内即有大量蛋白质分子粘附在材料表面,形成蛋白质吸附层(厚度10~20 nm),然后再在蛋白质吸附层上进一步吸附凝血因子并最终诱发血液凝固[3-7]。即植入材料抗凝血性能的优劣与其表面对血浆蛋白的吸附行为和程度密切相关,且主要与蛋白质种类紧密相关。人体血浆蛋白中主要包含三种蛋白质,其中纤维蛋白会诱导血小板的激活、变形,并且会被替代为一种不溶性的高分子量蛋白而导致内源性凝血。但有研究表明,当有白蛋白覆盖在材料表面时能形成很薄的白蛋白层,该膜层能起到隔离血液成分和材料反应的作用,从而显著减少纤维蛋白原和血小板等凝血组织在植入材料表面的粘附,提高材料的抗凝血性能,这一现象被称之为“白蛋白钝化”[6-8],可用于血液接触材料或器械的表面抗凝血改性处理。
Ti-3Zr-2Sn-3Mo-25Nb(TLM)合金是西北有色金属研究院根据临床数据反馈、需求及发展趋势开发的一种新型近β型医用钛合金材料,它不含Al、Ni等细胞毒性元素,体内生物相容性优于目前临床常用的316LSS、Ti-6Al-4V等金属材料,且具有良好的生物力学性能匹配和冷加工性能,是有望获得广泛临床应用的新型介入医用钛合金材料[9-11]。为了进一步提高TLM合金的抗凝血性能,首先通过溶胶-凝胶法在其表面制备一层TiO2薄膜,并通过化学法对该薄膜进行活化处理,然后再通过静电自组装和共价交联反应将白蛋白分子固定在薄膜表面,最后对白蛋白修饰前后的TLM合金表面的抗凝血性能进行测试、对比评价和分析。
1 实验
1.1 实验材料
将TLM合金加工成φ10 mm×2 mm的圆片状样品,经砂纸初步打磨平整后再在抛光机上抛光至镜面,并依次在稀盐酸、丙酮、去离子水和无水乙醇中超声波清洗15 min,真空干燥备用。
1.2 TiO2薄膜的制备及活化处理
TiO2薄膜是通过溶胶-凝胶法制成的。前驱物为Ti(OC4H9)4,溶剂为乙二醇甲醚,配置好的溶胶静置陈化 24 h 后备用[5-6,12-13]。
通过提拉法镀膜。镀膜后将样品放入箱式电阻炉中缓慢升温至500℃保温l h,采用炉冷方式冷却至室温。
将镀膜后的样品依次在盐酸、双氧水混合溶液和丙稀酰胺、硝酸等的混合溶液中活化处理8 h。之后,将试样依次在0.05 mol/L的NaOH溶液和去离子水中漂洗干净,真空干燥。
1.3 白蛋白的静电自组装固定
牛血清白蛋白为生物纯,由Sigma公司提供,并配制成1 mg/mL的白蛋白的柠檬酸溶液,调节pH至4.8。随机挑取TLM镀膜活化试样9个,先将全部试样浸入白蛋白溶液中,恒温振荡2 h后彻底清洗干净,再将上述样品全部浸没入1 mg/L的硫酸葡聚糖特征溶液中,并继续恒温振荡1 h,随后在去离子水中超声波清洗30 min。重复以上操作6次,然后在2.5%的戊二醛溶液中浸泡2 h,最后在磷酸盐缓冲溶液(pH=7.4)中超声清洗30 min,真空晾干。
1.4 涂层相组成测试
通过X射线衍射仪检测分析白蛋白涂层的相组成。测试条件:铜靶,管电压30 kV,电流20 mA,扫描速度0.03°/s,扫描区间15°~80°,掠射角1°。通过扫描电镜(JSM-6460)观察涂层的表面微观形貌。通过原子力显微镜(Veeco)表征白蛋白涂层表面的三维特征。
1.5 薄膜亲水性的测定
用接触角测试仪(Phoenix-300)检测白蛋白处理前后TLM合金样品对蒸馏水的接触角,比较其表面亲水性的变化。
1.6 凝血时间的测定
通过测量动态凝血时间来对比研究白蛋白改性前后TLM合金的抗凝血性能变化,具体操作如下:精确移取0.2 mL新鲜抗凝人血,分别滴加在白蛋白改性涂层及TLM合金空白样品表面,再精确移取浓度为0.2 mol/L的CaCl2溶液0.2 μL于样品表面,依次在10、20、30、40、50和60 min时用蒸馏水缓慢冲洗样品表面,并将各次冲洗的洗液分别收集在96孔板中,用酶标仪(CliniBio128C,Austria)在550 nm波长处测定各洗液的吸光度值。重复测量5次,取平均值。
1.7 血小板黏附实验
通过血小板黏附实验评价白蛋白涂层对主要凝血组织——血小板的激活反应。具体操作如下:分别通过微量进样器移取30 μL新鲜富血小板血浆滴加在白蛋白涂层和空白样品表面,室温接触30 min后用PBS缓冲液缓慢清洗各样品,随后将样品完全浸没在2.5%的戊二醛溶液中30 min,最后经超临界干燥后,采用扫描电镜(JSM-6700)观察各样品表面黏附的血小板的形态和数量。
2 结果与讨论
2.1 涂层相组成
TLM合金表面抗凝血涂层的XRD衍射曲线如图1所示。可以看出,涂层基体主要是TiO2薄膜,除少量杂质峰外,主要由金红石和锐钛矿组成,且衍射峰尖锐狭窄,没有宽化和分裂,说明结晶度较高[12]。
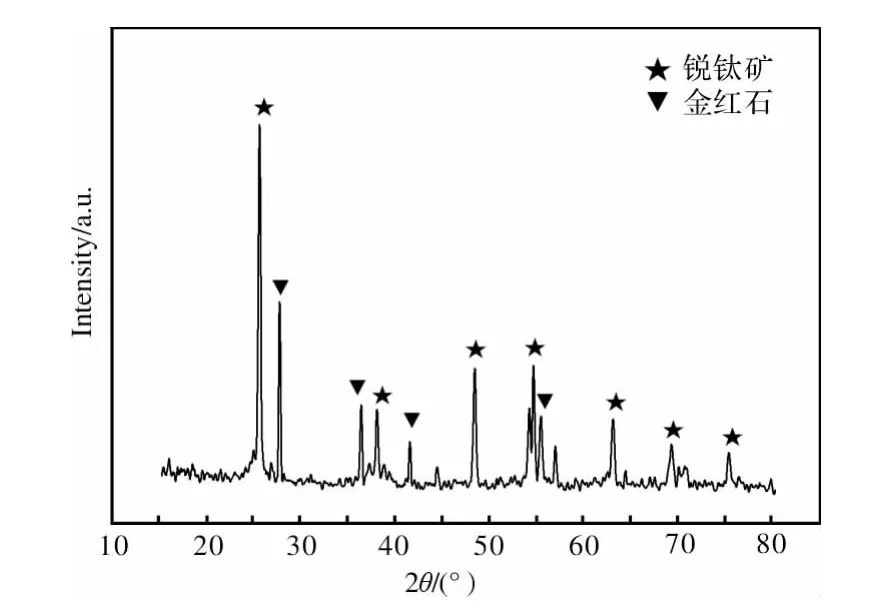
图1 抗凝血涂层的XRD衍射谱图Fig.1 XRD pattern of the anticoagulant coating
虽然钛合金在有氧的环境下,其表面也会迅速原位生成一层Ti-O膜,并且该氧化钛膜也具有较好的抗凝血性能,但是这种自发生成的Ti-O膜通常为非晶态,其血液相容性不如金红石或锐钛矿。
2.2 薄膜的表面分析
图2为TLM合金表面经白蛋白修饰前后的微观形貌。从TLM合金表面溶胶-凝胶膜的SEM照片(图2a)可以看出,TiO2薄膜表面平整,但含有少量微裂纹,经表面活化和白蛋白覆膜处理后(图2b),薄膜表面微小裂纹进一步减少,表面更为光滑,平均粗糙度为200 nm(图2c)。
溶胶-凝胶法是一种经典的化学薄膜制备方法[12-13],但在薄膜干燥和热处理过程中,由于凝胶是一种有机混合物,受热时会迅速干燥挥发,质量损失极大,导致收缩率也很大。本实验中,由于基体材料是钛合金,其热膨胀率很小,因此薄膜在干燥和高温热处理时会产生裂纹。此外,由于凝胶的表层与空气接触后,会马上凝胶化,干燥形成一层硬壳,而凝胶内部固化较慢,并且在热处理时,凝胶有机物大部分会变成气体,气体受热膨胀从而冲破表层硬壳,也会在薄膜表面产生裂纹。因此,溶胶-凝胶薄膜表面通常都会有少量的微小裂纹。但经长时间在热的官能化溶液中活化处理和静电自组装涂膜后,薄膜表面微裂纹会明显减少,表面更加光滑。光滑的表面不利于血小板和纤维蛋白等凝血组织的黏附,因此抗凝血性能更好。

图2 TLM合金表面经白蛋白修饰前后的微观形貌Fig.2 Micrographs of the coatings before and after modification by albumin
2.3 亲水性测试
TLM合金表面经白蛋白修饰前后蒸馏水的接触角如表1所示。
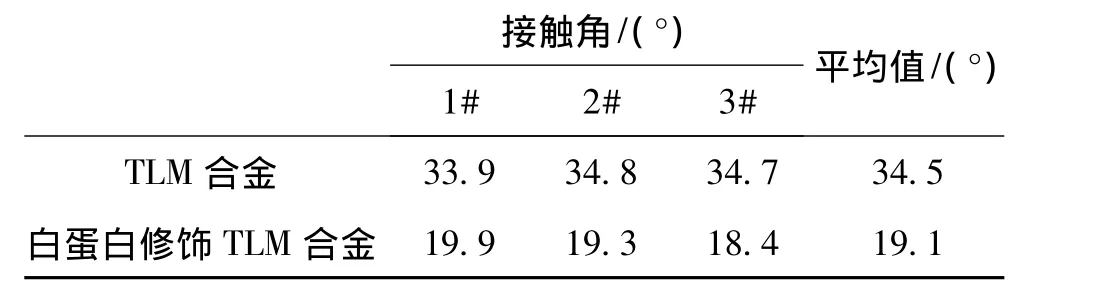
表1 TLM合金表面经白蛋白修饰前后对蒸馏水的接触角Table 1 Contact angle of TLM alloy before and after surface modification by albumin
从表1可以看出,试样表面经白蛋白修饰处理以后,接触角从34.5°降低到19.1°,即亲水性变好。TiO2薄膜本身具有很好的亲水性[14-16],且TLM合金经过溶胶-凝胶膜和白蛋白修饰处理后,材料表面形成了一个生物活性白蛋白层,并且在此过程中,涂层表面引入了OH-和NH2-亲水基团,同时白蛋白分子也带有大量亲水基团,从而材料的亲水性能得到了改善[17]。
研究表明,生物材料植入人体组织并与血液接触后,血浆中的各种蛋白质以及部分凝血因子、抗凝血因子会迅速吸附在植入材料表面[7],且吸附的蛋白质的类别、数量及立体空间构象等特性与植入材料的物理、化学等表面特征密切相关,并会对血小板等凝血组织与植入材料表面的交互作用、动态吸附与解吸附过程产生巨大的影响[7,17-18]。例如,吸附在材料表面的蛋白质发生变性、活化将诱导或启动血液内源、外源凝血途径,与此同时,血小板在材料表面的黏附、变形和激活等反应又会进一步引起其它血小板发生凝血反应,最终大量不溶性的纤维蛋白和血小板等物质共同形成血栓[7,17]。
而材料表面的亲/疏水性能是影响材料表面蛋白质吸附、细胞黏附的一个重要因素。对于抗凝血材料,材料表面的亲水性越好,蛋白质吸附量越小,抗凝血性越好。这是由于亲水性材料含有大量的水,与蛋白质和细胞中的水分子的有序排列极为相似,它们之间的相互作用力很小,与血液的界面能很小,因此,具有良好的抗凝血性。
2.4 凝血时间的测定
图3为TLM合金表面经白蛋白修饰处理前后的动态凝血时间测试结果。
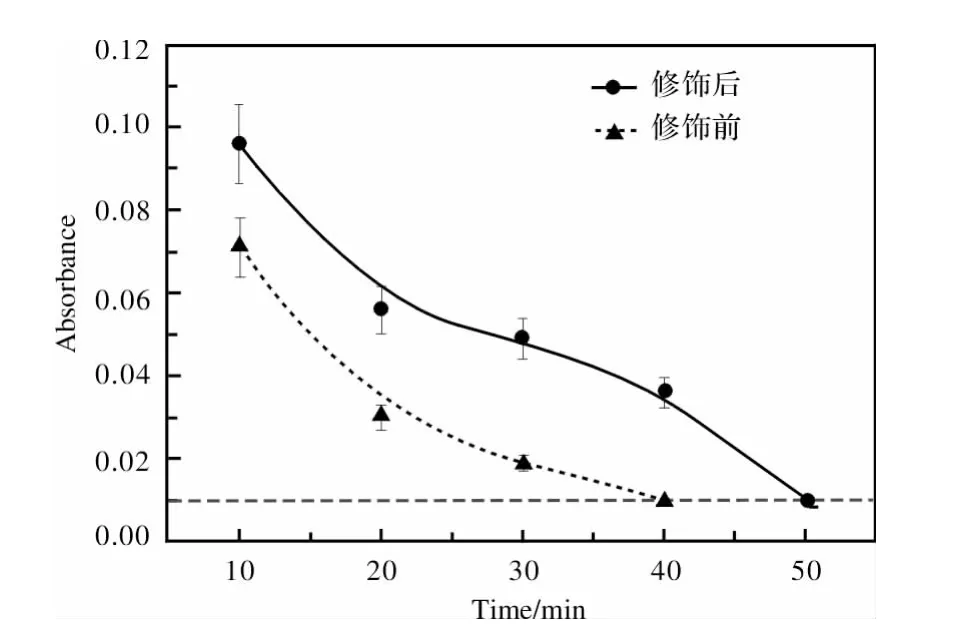
图3 TLM合金表面经白蛋白修饰前后的动态凝血时间测试结果Fig.3 Test result of dynamic coagulation time of TLM alloy before and after surface modifacation by albumin
植入材料与血液接触时会发生溶血反应,未凝血的红细胞溶解在洗脱液中,溶解的自由红细胞数量越多,洗脱液的吸光度值就越高,即凝结在植入材料表面的红细胞数量就越少,说明材料的抗凝血作用越好。
由图3可以看出,与血液的接触时间相同时,表面经白蛋白修饰处理后的TLM合金的吸光度值较未处理的高。由此说明,白蛋白修饰后的TLM合金具有较好的抗凝血性,即通过上述白蛋白修饰处理使TLM合金的抗凝血性能得到了提高。
图4为TLM合金表面经白蛋白修饰前后材料表面的血小板黏附照片。由图4可以看出,表面经白蛋白涂层改性后(图4a),试样表面黏附的血小板数量很少,且黏附的血小板形态没有发生明显的变形、团聚等激活迹象。而未经处理的空白TLM合金表面(图4b)不仅黏附着大量的血小板,而且血小板明显被激活。

图4 TLM合金表面经白蛋白修饰前后的血小板黏附照片Fig.4 SEM micrographs of platelets adhered of TLM alloy before and after modifacation by albumin
蛋白质在植入材料表面的吸附是一个非常复杂的过程,目前对其微观机理也没有形成完全统一的解释。一般认为:血浆蛋白在高分子生物材料表面上的吸附虽然与蛋白质的浓度有关,但更取决于蛋白质的种类和材料表面的组成与结构。
纤维蛋白原(凝血因子I)是和凝血密切相关的血浆蛋白质,在材料表面的吸附不仅会启动人体凝血途径,还可转化为不溶性的纤维蛋白,它是血栓的主要成分之一。而Wahid Khan等[18-19]的研究结果表明,人工植入材料表面可逆吸附的血浆白蛋白层则具有良好的抗凝血性能。但是,在医用金属材料表面,白蛋白的竞争吸附率却显著低于纤维蛋白原及其它凝血因子[20]。而且,蛋白质在人工植入生物材料表面吸附后,其空间构象会发生不同程度的变化,在疏水性材料上的变化较在亲水性材料上的要大。而 Y.L.Jeyachandran等[19-20]的研究结果表明,只有吸附后构象变化小,具有可逆吸附特性的血浆白蛋白层才具有良好的抗凝血性能。
因此,本实验通过化学方法提高TLM合金表面的亲水性,并将白蛋白共价固定在具有良好血液相容性的TiO2表面[14-15],不仅可增加材料表面的白蛋白浓度,还能尽量保持白蛋白的空间构象,极大程度协同利用TiO2和白蛋白的抗凝血效果,显著提高TLM合金的抗凝血性能。
3 结论
(1)通过溶胶-凝胶法在TLM合金表面镀TiO2膜,并将该薄膜活化处理后通过静电自组装可在其表面制备出白蛋白涂层。
(2)经白蛋白涂层修饰后,TLM合金表面的亲水性增强,动态凝血时间也有所延长,合金表面黏附的血小板数量很少且没有被明显激活,即白蛋白涂层可明显提高TLM合金的抗凝血性能。
[1]Pradier C M,Costa D,Rubio C,et al.Role of salts on BSA adsorption on stainless steel in aqueous solutions.I.FTIRRAS and XPS characterization[J].Surface and Interface Analysis,2002,34(1):50-54.
[2]Weng Y J,Qi F,Huang N,et al.Photochemical immobilization of bovine serum albumin on Ti-O and evaluations in vitro and in vivo[J].Applied Surface Science,2008,255(2):489-493.
[3]Brynda E,Milan Houska,Markéta Jiroušková,et al.Albumin and heparin multilayer coatings for blood-contacting medical devices[J].Journal of Biomedical Materials Research,2000,51(2):249-257.
[4]Kowalczyńska H M,Nowak-Wyrzykowska M,Szczepankiewicz A A,et al.Albumin adsorption on unmodified and sulfonated polystyrene surfaces,in relation to cell-substratum adhesion[J].Colloids and Surfaces B:Biointerfaces,2011,84(2):536-544.
[5]Wojciech Chrzanowski,Ensanya Ali Abou Neel,David Andrew Armitage,et al.Effect of surface treatment on the bioactivity of nickel-titanium[J].Acta Biomaterialia,2008,4(6):1969-1984.
[6]Claudia Sperling,Milan Houska,Eduard Brynda,et al.In vitro hemocompatibility of albumin-heparin multilayer coatings on polyethersulfone prepared by the layer-by-layer technique[J].Journal of Biomedical Materials Research Part A,2006,76A(4):681-689.
[7]余森,于振涛,牛金龙,等.医用钛合金 Ti-3Zr-2Sn-3Mo-25Nb表面自组装抗凝血复合涂层的构建及其血液相容性研究[J].金属热处理,2012(27):16-20.
[8]Weng Y J,Hou R X,Li G C,et al.Immobilization of bovine serum albumin on TiO2film via chemisorption of H3PO4interface and effects on platelets adhesion[J].Applied Surface Science,2008,254(9):2712-2719.
[9]Zhentao Yu,Gui Wang,Xiqun Ma,et al.Development of biomedical near β titanium alloys[J].Materials Science Forum,2009,618-619:303-306.
[10]张明华,于振涛,周廉,等.β型钛合金材料的生物相容性评价[J].稀有金属材料与工程,2007,36(10):1815-1818.
[11]Milan Houska,Eduard Brynda,Andrey Solovyev,et al.Hemocompatible albumin-heparin coatings prepared by the layer-by-layer technique.The effect of layer ordering on thrombin inhibition and platelet adhesion[J].Journal of Biomedical Materials Research Part A,2008,86A(3):769-778.
[12]Tianfa Wen,Jianping Gao,Juyun Shen,et al.Preparation and characterization of TiO2thin films by the sol-gel process[J].Journal of Materials Science,2001,36(24):5923-5926.
[13]Michael Grätzel.Sol-gel processed TiO2films for photovoltaic applications[J].Journal of Sol-Gel Science and Technology,2001,22(1/2):7-13
[14]Xuanyong Liu,Paul K.Chu,Chuanxian Ding.Surface modification of titanium,titanium alloys,and related materials for biomedical applications[J].Materials Science and Engineering:R:Reports,2004,47(3/4):49-121.
[15]Huang N,Yang P,Leng Y X,et al.Hemocompatibility of titanium oxide films[J].Biomaterials,2003,24(13):2177-2187.
[16]Wang Xianghui,Zhang Feng,Li Changrong,et al.Improvement of blood compatibility of artificial heart valves via titanium oxide film coated on low temperature isotropic carbon[J].Surface and Coatings Technology,2000,128-129(1):36-42.
[17]Chang Zhang,Jing Jin,Jie Zhao,et al.Functionalized polypropylene non-woven fabric membrane with bovine serum albumin and its hemocompatibility enhancement[J].Colloids and Surfaces B:Biointerfaces,2013,102(1):45-52.
[18]Wahid Khan,Mamta Kapoor,Neeraj Kumar.Covalent attachment of proteins to functionalized polypyrrole-coated metallic surfaces for improved biocompatibility[J].Acta Biomaterialia,2007,3(4):541-549
[19]Jeyachandran Y L,Mielczarski J A,Mielczarski E,at al.Efficiency of blocking of non-specific interaction of different proteins by BSA adsorbed on hydrophobic and hydrophilic surfaces[J].Journal of Colloid and Interface Science,2010,341(1):136-142.
[20]Willem Norde,Carla E Giacomelli.BSA structural changes during homomolecular exchange between the adsorbed and the dissolved states[J].Journal of Biotechnology.2000,79(3):259-268.
