不同贮藏条件下青花椒香气成分的比较*
2013-10-30张艺宋莹莹武菁菁陈光静汪莉莎谭雁文阚建全
张艺,宋莹莹,武菁菁,陈光静,汪莉莎,谭雁文,阚建全
1(西南大学食品科学学院,重庆,400715)
2(重庆市农产品加工与贮藏重点实验室,重庆,400715)
3(农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆,400715)
花椒(Chinese pricklyash),又名蜀椒、川椒等,是芸香科(Rutaceae)花椒属(ZmnthoxylumL)的一种香料植物,主要包括青花椒(Zmnthoxylum schinifoliumSieb. et Zucc. )和红花椒(Zanthoxylum bungeanumMaxim. ),是中国传统的香料和中药配料,有“中国八大调料”之称[1]。青花椒麻味纯正浓烈,气味清香,广泛用于食品的烹调和加工之中。由于青花椒的生产具有季节性,因此干青花椒是青花椒产业中最主要的初级产品。青花椒的香气是干青花椒最重要的质量指标之一[2]。目前对青花椒香气成分的研究主要集中于其挥发油的成分分析[3-4]、提取方法[5-7]及其生理活性[8-10]等方面,而对其在不同贮藏条件下香气含量及成分的比较研究较少。本试验采用内标法测定干青花椒在贮藏过程中香气成分及含量的变化,对2 种不同贮藏条件干青花椒挥发油含量与组成进行比较,以期为干青花椒的贮藏提供数据。
1 材料与方法
1.1 材料与试剂
干青花椒,2012 年7 月2 日于重庆市江津区先锋镇青花椒生产基地采摘鲜青花椒后晒制而成。
PE 塑料袋(14 cm ×16 cm,0.025 mm),铝箔包装袋(14 cm×19 cm,0.10 mm),购买于浙江台州市名科塑业有限公司。
正癸烷(纯度>99%)标准品,USA Sigma 公司;无水乙醇为色谱纯,成都科龙化工试剂厂;无水Na2SO4等均为分析纯,成都科龙化工试剂厂。
1.2 仪器与设备
101-3-S 电热恒温鼓风干燥箱,重庆慧达实验仪器有限公司;MAP-500D 电子天平,上海一恒科学仪器有限公司;GC-MS 2010 型气相色谱-质谱联用仪,日本岛津公司。
1.3 实验方法
1.3.1 样品处理
将晒制好的干青花椒先取一部分作为对照样品(贮藏前),其余的分为2 批(A 批与B 批),A 批青花椒采用铝箔包装袋密封包装,包装好的样品放于4℃条件下贮藏,即在低温密封避光的条件下贮藏,命名为DB 组。B 批青花椒采用PE 塑料袋包装,不封口,包装好的样品放在室温条件下贮藏,即在室温未密封不避光的条件下贮藏,命名为SB 组。2 组样品均每隔20d 取一次样,用于测定青花椒的香气成分。
1.3.2 干青花椒挥发油的提取[11]
采用水蒸气蒸馏法。取粉碎(80 目)后的干青花椒20 g,置于500 mL 平底烧瓶中,加入300 mL 去离子水,加热蒸馏4 h。收集蒸馏所得的挥发油,然后用无水Na2SO4干燥脱水,得到具有浓烈香气的淡黄色透明液体。测量所得挥发油的体积,并将其保存-20℃条件下待用。
1.3.3 干青花椒挥发油含量的测定
根据《中华人名共和国药典》[12]附录中精油的测定方法(甲法)进行测定,计算公式如下:
精油含量/[mL·(100 g)-1]=精油体积( mL) /样品质量( g) ×100
1.3.4 干青花椒挥发油组成成分的测定[13]
1.3.4.1 试样的制备
标准品溶液的配制:称取标准品正癸烷0.25 g,定容到25 mL,配制成0.01 g/mL 的标准品溶液。
样品溶液的配制:取1.3.2 中提取所得的挥发油30 μL,并加入配置好的标准品溶液0.3 mL,然后用无水乙醇定容到10 mL,此溶液用于GC-MS 分析。
1.3.4.2 GC-MS 分析条件
色谱条件:色谱柱为DB-5MS(30 m × 0.25 mm,0. 25μm);升温程序:60℃保持10 min ,先以2℃/min 速率升至70℃,再以10℃/min 速率升至140℃,然后以5℃/min 速率升至170℃ ,保持1 min,最后以15℃/min 速率升至230℃,保持4 min;载气:He;流速:0.8 mL/min;压力:37.8 kPa;进样量1 μL;进样口温度:250℃;分流比5∶1。
质谱条件:电子轰击(EI)离子源;检测器电压830eV;离子源温度250℃;接口温度250℃;溶剂延迟时间3.5 min;ACQ 方式:Scan;扫描速度:769/s;质量扫描范围:m/z 40 ~400。
1.4 实验数据分析处理方法
所有实验均重复3 次,采用Origin 8.6 和Excel(2007)进行实验数据处理和分析。所有结果均以标准偏差形式给出。
2 结果与分析
2.1 干青花椒贮藏过程中挥发油含量的变化研究
从图1 中可以看出,在2 种贮藏条件下青花椒中的挥发油含量均会随贮藏时间的延长而降低。贮藏前干青花椒挥发油含量为17.49%,DB 组干青花椒挥发油的含量在贮藏60d 后显著降低(P<0.05)且贮藏结束时其含量为15.97%,而SB 组青花椒挥发油的含量在贮藏20d 后就极显著的降低了(P<0.01),贮藏结束时其含量为9.87%。2 种贮藏条件下青花椒挥发油含量差异极显著(P<0.01),说明青花椒挥发油在不同贮藏条件下均有损失,但损失程度不同,低温密封避光包装条件下贮藏可有效降低青花椒挥发油的损失。分析其原因可能是挥发油在常温下具有易挥发性,即温度对挥发油仍具有明显的影响,而光照对青花椒挥发油是否存在影响以及影响程度则还需进一步研究。
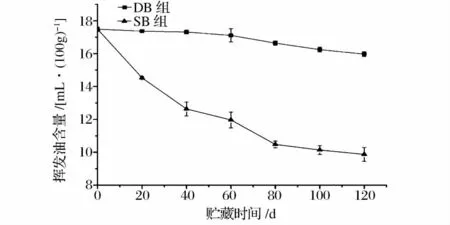
图1 青花椒贮藏过程中挥发油含量的变化Fig.1 The variations of volatile content of green prickleyashes during storage period
2.2 贮藏前后干青花椒挥发油组成成分的变化
对贮藏前后干青花椒中的挥发油进行GC-MS 分析,其GC-MS 总离子流色谱图见图2。经仪器所配置的NIST05s. LIB 和NIST05. LIB 谱库进行检索确定挥发油中的化学成分,以内标法计算挥发油各组分的含量和相对保留时间,结果见表1。

图2 贮藏前后青花椒挥发油成分的总离子流色谱图Fig.2 GC-MS total ion current chromatograms of volatile oils from green prickleyashes before and after storage
由图2 与表1 中可知,从贮藏前后干青花椒挥发油中共鉴定出31 种化学成分,其中从贮藏前挥发油中鉴定出28 种化学成分,主要成分有香桧烯[(113.97 ±1.81)mg/mL]、月桂烯[(32.02 ±1.89)mg/mL]、(+)-萜二烯[(139.96 ±7.48)mg/mL]、芳樟醇[(193.60 ± 1.88)mg/mL]、反式橙花叔醇[(21.47 ±1.24)mg/mL]等;贮藏后从DB 组挥发油中共鉴定出29 种化学成分,主要成分有香桧烯[(105.94 ±0.86)mg/mL]、月桂烯[(28.89 ±1.74)mg/mL]、(+)-萜二烯[(131.4 ±2.84)mg/mL]、芳樟醇[(162.63 ± 8.35)mg/mL]、反式橙花叔醇[(13.92 ±1.18)mg/mL]等;贮藏后从SB 组挥发油中共鉴定出28 种化学成分,主要成分有香桧烯[(69.16 ±3.19)mg/mL]、月桂烯[(14.44 ±0.61)mg/mL]、(+)-萜二烯[(71.52 ±2.88)mg/mL]、芳樟醇[(142.03 ± 3.57)mg/mL]、反式 橙花叔醇[(11.08 ±0.41)mg/mL)]等。与唐玉莲等[13-14]对青花椒挥发油成分的研究结果存在一定的差异,这可能与其产地、品种等因素有关[15]。
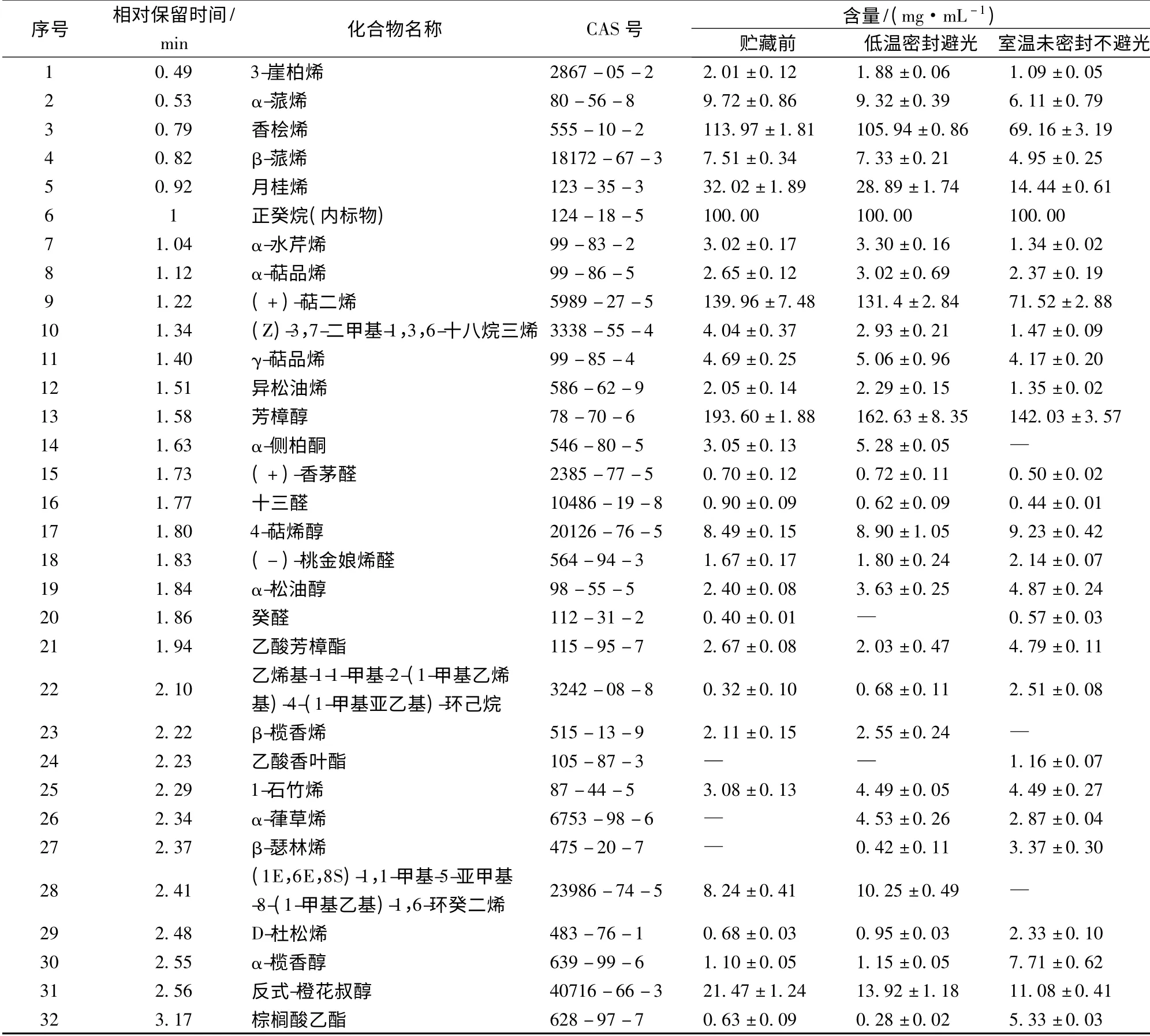
表1 干青花椒贮藏前后挥发油的GC-MS 分析结果Table 1 GC-MS analytical results of volatile oil composition of green prickleyashes
通过分析可知,3 组试验中青花椒挥发油的主要成分基本相同,但其含量有差异,贮藏前后干青花椒挥发油中主成分的含量由大到小依次为贮藏前>DB组>SB 组。说明贮藏条件虽对挥发油主成分的组成无影响,但会影响其含量,低温密封避光的贮藏条件可有效的减少主成分在量上的损失。
与贮藏前相比,贮藏后DB 组未检测到癸醛,但检测出α-葎草烯与β-瑟林烯;而SB 组未检测到α-侧柏酮、β-榄香烯和(1E,6E,8S)-1,1-甲基-5-亚甲基-8-(1-甲基乙基)-1,6-环癸二烯,检测到了乙酸香叶酯、α-葎草烯与β-瑟林烯。说明贮藏过程中干青花椒挥发油中的原有成分有所损失并会产生新的微量成分,且低温密封避光贮藏能有效减少原有微量成分种类的损失。
3 结论
干青花椒挥发油含量随贮藏时间的延长而逐渐降低,但低温密封避光贮藏能有效延缓挥发油的损失。不同贮藏条件并不影响干青花椒挥发油主要成分的组成,但对主要成分的含量存在一定的影响,低温密封避光贮藏可有效减少主成分在量上损失。2种贮藏条件下干青花椒挥发油中的微量成分的种类均有所变化,而低温密封避光贮藏能有效减少原有微量成分种类的损失。综合分析,低温密封避光贮藏可较好的保持干青花椒的香气。
[1] 黄德民,赵国华,陈宗道,等. 我国花椒的饮食文化探源[J]. 中国调味品,2006,(01):75 -81.
[2] 余晓琴. 花椒品质评价方法及其应用研究[D]. 重庆:西南大学食品科学学院,2010.
[3] Chyau C C,Mau J L,Wu C M. Characteristics of the steam-distilled oil and carbon dioxide extract of zanthoxylum simulans fruits[J]. Journal of Agriculture and Food Chemistry,1996,44:1 096 -1 099.
[4] 石雪萍,张卫明. 红花椒和青花椒的挥发性化学成分比较研究[J]. 中国调味品,2010(2):102 -105.
[5] Charng-cherng C,Jeng-leun M,Chung-may W. Characteristics of the steam-distilled oil and carbon dioxide extract of zanthoxylum simulans fruits[J]. Agric. Food Chem,2011,44(4):1 096 -1 099.
[6] Wei Shigang,Zhang Huihui,Wang Yeqiang,et al. Ultrasonic nebulization extraction-heating gas flow transfer-headspace single drop microextraction of essential oil from pericarp ofZanthoxylum bungeanumMaxim. [J]. Journal of Chromatography A,2011,1 218:4 599 -4 605.
[7] 曹雁平,张 东. 固相微萃取-气相色谱质谱联用分析花椒挥发性成分[J]. 食品科学,2011,,32(8):190 -193.
[8] Ngassoum M B,Essia-Ngang J J,Tatsadjieu L N,et al.Antimicrobial study of essential oils ofOcimum gratissimumleaves andZanthoxylum xanthoxyloidesfruits from Cameroon[J]. Fitoterapia,2003,74:284 -287.
[9] Saulo L. da Silva,Patricia M S. Figueiredo,TOMOMASA Yano et al. Chemotherapeutic potential of the volatile oils from Zanthoxylum rhoifoliumLam leaves[J]. European Journal of Pharmacology,2007,576:180 -188.
[10] 袁娟丽. 花椒挥发油的抗炎、镇痛作用[J]. 中药材,2010,33(5):794 -797.
[11] Wang Lu,Wang Ziming,Li Xueyuan,et al. Analysis of volatile compounds in the pericarp ofZanthoxylum bungeanummaxim by ultrasonic nebulization extraction coupled with headspace single-drop microextraction and GCMS[J]. Chromatographia,2010,71:455 -459.
[12] 中华人民共和国卫生部药典委员会. 中华人民共和国药典[M]. 北京:化学工业出版社,2000. 附录25.
[13] 唐玉莲,林红卫,陈迪钊,等. 五菱青花椒壳挥发油成分及脂肪酸分析[J],食品工业科技,2012,33(10):74-78.
[14] 贾利蓉,赵志峰,雷绍荣,等. 汉源青花椒挥发油的成分分析[J]. 食品与机械,2008,24(3):105 -108.
[15] Kim J H. Seasonal variations in the content and composition of essential oil fromZanthoxylum piperitum[J]. Journal of Ecology and Field Biology,2012,35(3):195-201.
