固态发酵豆粕的不同生产工艺及其营养品质比较*
2013-10-30魏春刘茂锋宣磊汪钊
魏春,刘茂锋,宣磊,汪钊
(浙江工业大学 生物与环境工程学院,浙江 杭州,310014)
饲料产品中,豆粕目前是最主要的蛋白质饲料。2012 年国内豆粕加工总量(不含进口豆粕)已达1 000 万t 以上。为降低养殖成本,提高豆粕消化吸收率和使用效益已成为新的研究课题。豆粕发酵后,多种抗营养因子比如脲酶、胰蛋白酶抑制因子、凝血素等大大减少,可解决普通豆粕引起的仔猪腹泻等问题[1];另外,不容易消化的大分子蛋白减少,小肽增加,营养成分全面,可部分代替高价位的动物源蛋白质饲料[2-5]。将乳酸菌应用在豆粕发酵中还可以进一步增加发酵豆粕的益生功能、提高豆粕的使用效益,同时由于乳酸、细菌素等抑菌成分的存在,也使发酵豆粕更容易保存,可减少抗生素等化学合成药物的使用[6-8]。
本研究选用食品安全级的米曲霉和植物乳杆菌WZ011 (Lactobacillus plantarumWZ011)为发酵菌种,组合设计了5 种固态发酵工艺,以多种指标评价这几种工艺对发酵豆粕营养品质的影响,以期获得最优的益生发酵豆粕生产工艺。L.plantarumWZ011 具有生产γ-氨基丁酸(GABA)能力。GABA 是一种新型饲料添加剂,摄取少量的GABA 即可增强动物的免疫性能和抗热应激性能,促进生长[9]。
1 材料与方法
1.1 菌株
植物乳杆菌WZ011(L.plantarumWZ011)[10],由实验室自筛所得;米曲霉(Aspergillus oryzae),购自上海迪发酿造生物制品有限公司。
1.2 主要试剂
分析纯试剂:无水乙酸钠、硼酸、三乙胺、OPA(邻苯二甲醛)、茚三酮、谷氨酸钠、乳酸、二甲基亚砜、无水乙醇等。猪胰蛋白酶(≥2 500 u/mg)、胃蛋白酶(1:3000)、牛血清蛋白、酪蛋白、酪氨酸等。豆粕来源于浙江鸿源有限公司。
1.3 种子培养基
米曲霉种子培养基PDA(g/L):土豆200,葡萄糖20,琼脂粉20,pH 自然。
植物乳杆菌种子培养基MRS(g/L):蛋白胨10,牛肉膏10,酵母膏5,葡萄糖10,无水乙酸钠5,柠檬酸氢二铵2,磷酸氢二钾0.33,MnSO4·H2O 0.05,MgSO4·7H2O 0.02,吐温80 1 mL,pH 6.2 ~6.4。
1.4 五种生产工艺介绍
工艺1:米曲霉单独固态发酵。10 g 豆粕,1 g 麸皮,3.6%的硫酸铵,含水量51%,接种量36%孢子悬液,30℃间歇翻料培养36 ~48 h。
工艺2:米曲霉固态发酵后水解反应。米曲霉固态发酵后转入55℃高温水浴锅中水解10 ~14 h。
工艺3:植物乳杆菌单独固态发酵。10 g 豆粕,1 g 麸皮,3.6% 的硫酸铵,可溶性淀粉2%,含水量60%,接种量5%,30℃封口厌氧发酵60 h。
工艺4:米曲霉好氧发酵后串联乳酸菌厌氧发酵。米曲霉固态发酵后加入可溶性淀粉2%,含水量60%,接种植物乳杆菌5%,30℃厌氧发酵60 h。
工艺5:米曲霉好氧发酵后水解再接植物乳杆菌厌氧发酵。米曲霉固态发酵后转入55℃高温水浴锅中水解10 ~14 h,再加入可溶性淀粉2%,含水量60%,接种植物乳杆菌5%,30℃封口厌氧发酵60 h。
1.5 发酵豆粕各项指标检测方法
干重的测定参考国标GM 6435 -1986。乳酸的检测采用NaOH 滴定法。可溶性蛋白的测定参考Da Teng 等的方法[5]。溶解度(氮溶指数)的测定参考AOCSBa11 -65 的方法。小肽含量测定参考GB/T 22492 -2008 大豆肽粉国标法。游离氨基酸测定参考GB/T 8314 -2002。总氨基酸、游离总氨基酸含量测定参考GB/T 14965 -1994。豆粕还原糖测定参考DNS 法[11]。中性蛋白酶测定参考国标SBT 10317 -1999。乳酸菌活菌数测定按照稀释涂布法稀释一定倍数后涂布培养,48 h 后计单菌落。粗蛋白的测定参考凯氏定氮法(GB/T 6432 -1994),利用自动定氮仪测定。脲酶含量以滴定法测定[12],酶活定义为每分钟每克大豆制品释放氮的毫克量。胰蛋白酶抑制因子的测定参考马文强等研究者的方法[13]。GABA以HPLC 方法检测[10]。SDS -PAGE 和蛋白质分析参考Da Teng 等研究者的方法[5]。体外消化试验参考Da Teng 等人的方法,先用胃蛋白酶在酸性环境下37℃进行消化4 h 后再用胰蛋白酶在中性pH 环境下消化24 h,模拟动物体内胃肠道消化[5]。
2 实验结果与讨论
2.1 米曲霉固态发酵条件及水解条件的确定
5 种工艺里涉及米曲霉固态发酵、水解及植物乳杆菌发酵工艺,因此,先对米曲霉固态发酵和水解条件进行了研究,植物乳杆菌发酵条件参照已有研究结果[10]。以粗蛋白和中性蛋白酶酶活为指标进行米曲霉单独发酵生长周期的考察。图1 结果表明,粗蛋白在0 ~36 h 增长最快,而后几乎无增长。中性蛋白酶酶活在0 ~36 h 也增加最快,酶活达1196.4 u/g,而后酶活略微有所下降。这些说明米曲霉在0 ~36 h时间段,尤其是在12 ~36 h 生长迅速,而后增长缓慢,主要以产孢子为主。孢子粉尘不利于加工车间的环境,也不利于消化,因此,为减少成本和不利因素,36 h 为发酵终止点。
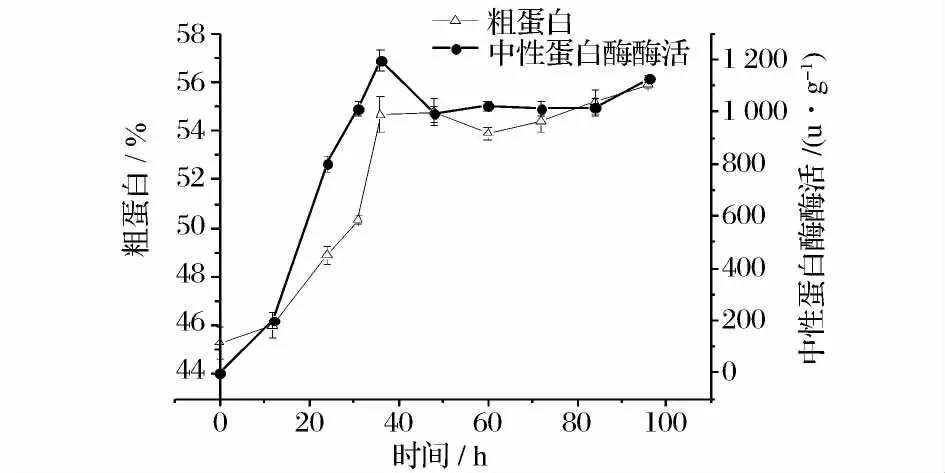
图1 米曲霉固态发酵中蛋白酶酶活和粗蛋白含量的时间过程曲线Fig.1 Time course of protease activity and crude protein content in solid state fermentation by Aspergillus oryzae
发酵36 h 后可能由于营养或水分不足,米曲霉生长趋于停止,大分子蛋白、抗营养因子可能还未消除完全。而米曲霉此时产中性蛋白酶酶活达1 196.4 u/g。许晶等利用碱性蛋白酶水解豆粕,获得制备大豆肽的酶解工艺[14],因此本实验采用在发酵36 h 后继续在蛋白酶最适酶解温度55℃的环境下进行高温水解的方法,以进一步水解蛋白质。
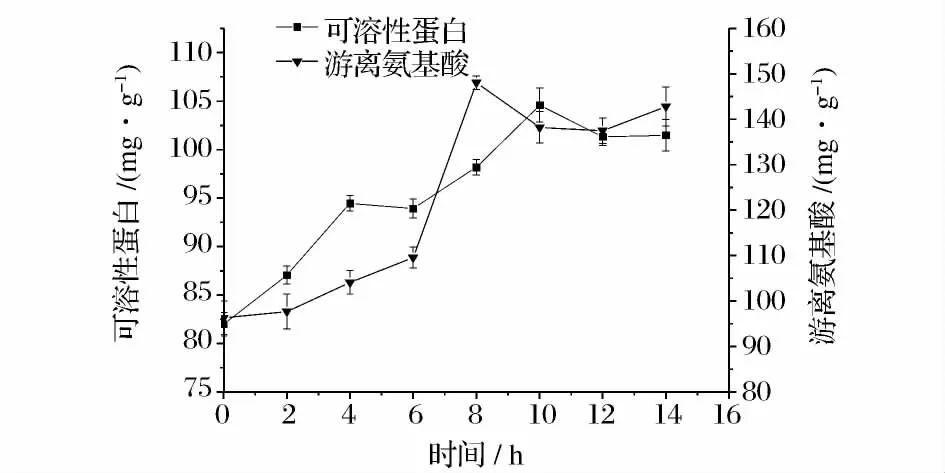
图2 发酵豆粕水解过程中可溶性蛋白和游离氨基酸含量的时间变化曲线Fig.2 Time course of soluble protein and free amino acid content during the hydrolysis of soybean meal after fermentation
由图2 可见,继续水解可显著提高可溶性蛋白和游离氨基酸含量,在0 ~10 h 提高量最大,可溶性蛋白含量提高27.55%,游离氨基酸含量提高43.53%,而后提高不明显。因此选用10 h 为水解终点。
2.2 发酵豆粕主要营养指标比较和分析
2.2.1 营养指标总体比较
通过各指标的结果可以发现,5 种工艺中,工艺3的豆粕营养指标最差,说明植物乳杆菌单独发酵会消耗部分酸溶性蛋白和小肽。工艺2 的豆粕酸溶性蛋白、氮溶指数、小肽增加最多,分别为9.73 倍、25.1%、10.94 倍。这3 项同时表明了在米曲霉发酵后进一步水解,酸溶性蛋白、氮溶指数以及小肽具有明显的提高,这些都明显改善了大豆蛋白营养及在动物体内的消化吸收[15-16]。水解后还原糖比水解前提高了34.92%,说明55℃水解也有助于纤维素酶、淀粉酶水解更多的多糖成还原糖,更易消化吸收。与植物乳杆菌串联发酵后的工艺四,其大部分营养指标均优于工艺五。在植物乳杆菌活菌数和GABA 含量上,工艺4 比工艺5 分别高69.3%和352%。
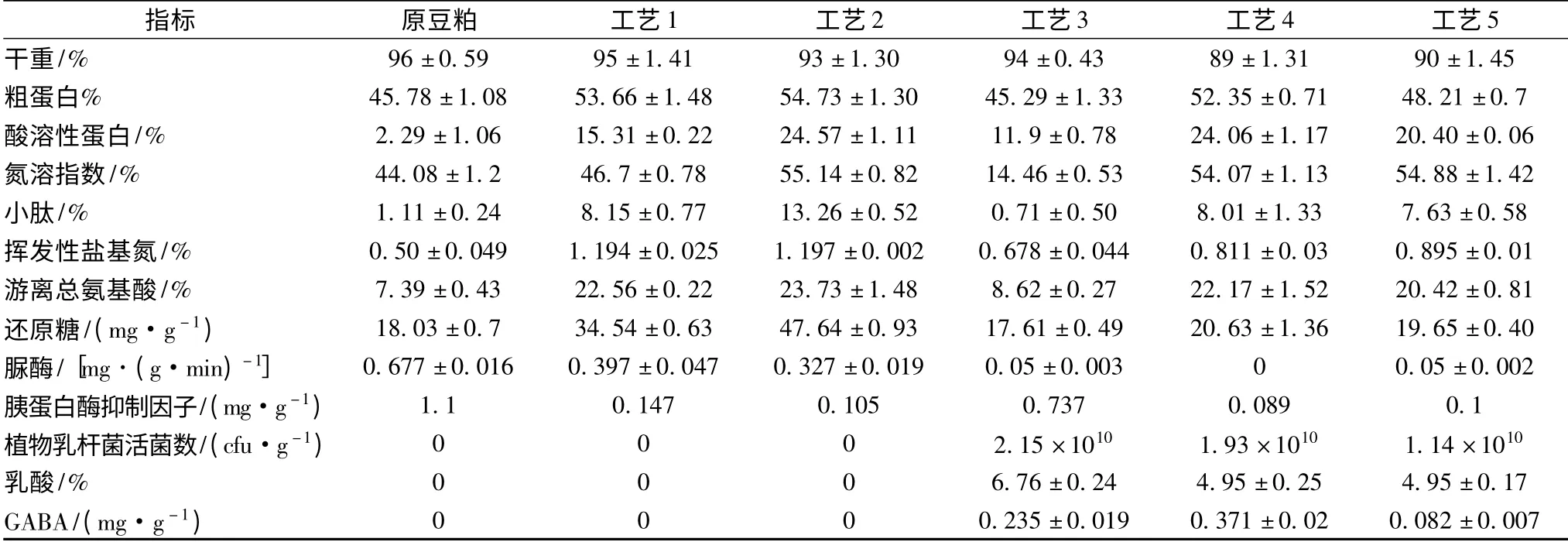
表1 五种工艺对应的发酵豆粕营养指标比较Table 1 Comparison of nutrition index of fermented soybean meals with five different production technology
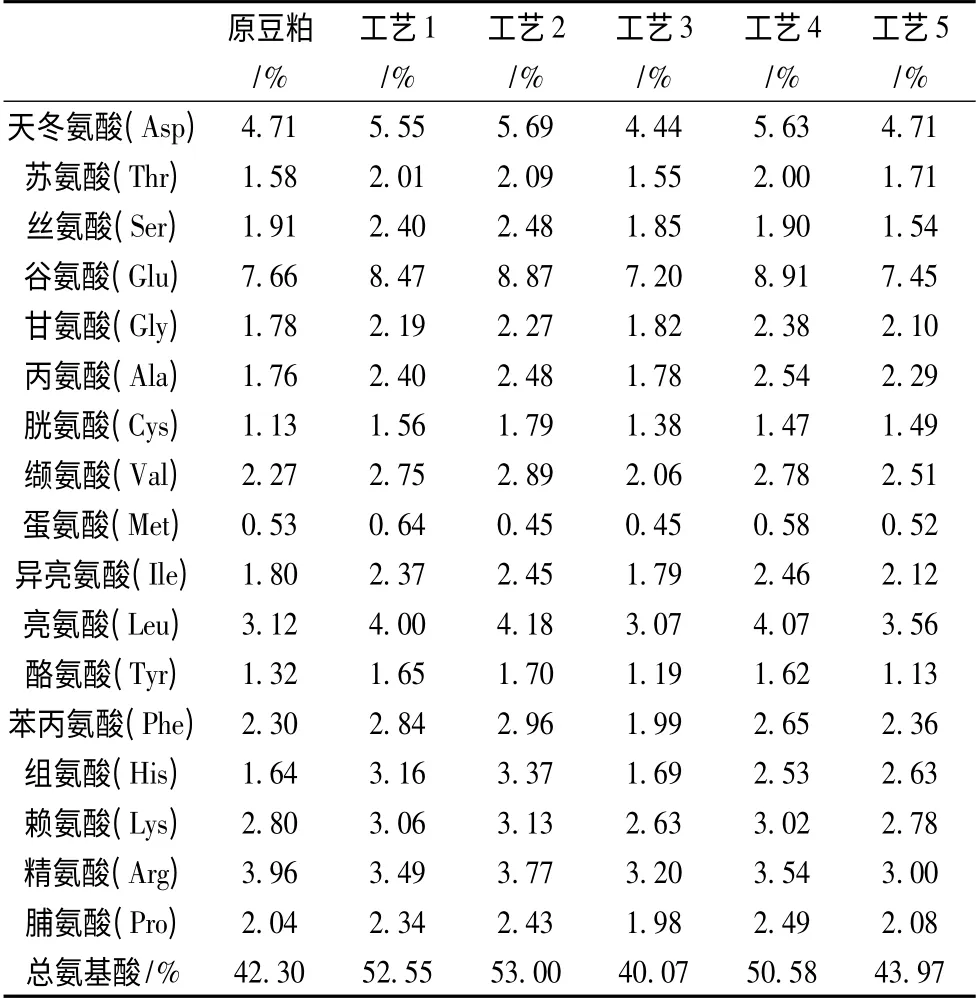
表2 六种豆粕饲料氨基酸含量分布Table 2 Amino acid composition of six kinds of soybean meals
此植物乳杆菌在最优条件下液态培养时可产GABA 达5.8 g/L[10]。虽然本研究中植物乳杆菌WZ011 生产GABA 并不在最优条件下,工艺4 豆粕中测得的GABA 含量相对液态发酵含量较低,但说明该菌株在固态发酵中也具有产GABA 的能力。范志勇等人报道,在生长猪日粮中添加GABA(50、100 mg/kg),可显著提高生长激素、促黑激素、促甲状腺激素(TSH)的分泌水平,对动物激素具有积极的调节作用[17]。工艺4 所得豆粕的GABA 含量达371 mg/kg,完全可以满足猪对GABA 的少量需求,因此该饲料具有比一般乳酸菌发酵饲料更全面的促生长功效。
脲酶在国家饲料标准中规定不得大于0.4 mg/g. min,工艺4 脲酶酶活已减少到无法检出,同时其胰蛋白酶抑制因子消除率也最高,达91.8%。胰蛋白酶抑制因子本质上是水溶性球蛋白[18],因此工艺4中高的胰蛋白酶抑制因子消除率可能是植物乳杆菌发酵过程中的蛋白酶进一步降解所致。
2.2.2 游离氨基酸含量分布比较
表2 结果表明,除了工艺3 总氨基酸含量降低以外,其他类型豆粕饲料的总氨基酸含量都有所增加。其中工艺2 增加最多,达25.3%,其必需氨基酸含量也增加最多,达26.04%。必需氨基酸含量增加,说明豆粕在进一步降解的条件下,必需氨基酸比例有增加的趋势。在各种氨基酸中,组氨酸含量增加最多,达105.5%。组氨酸对成年动物而言,是一种非必需氨基酸,但对幼龄动物却是必需氨基酸。工艺2 中组氨酸含量的增加,对于喂养幼龄动物更具优势。赖氨酸作为豆粕饲料中第1 限制性氨基酸,显著影响着动物的代谢和生长,其含量在工艺1、工艺2、工艺4 豆粕中较原豆粕分别增加9.3%、11.8%、7.9%。因此用于猪特别是乳猪的饲料中,工艺2 豆粕的氨基酸营养价值最高。
2.2.3 可溶性蛋白质的SDS-PAGE 分析
各种发酵工艺对豆粕蛋白质分子量的影响如图3 所示。分子量>45 kDa 定为大分子蛋白质,分子质量在15 ~45 kDa 定为中分子量蛋白质,分子质量<15 kDa 定为小分子蛋白质。通过软件GlyKo Band-Scan (Version 5.0)分析各条带的浓度比例[5],结果如表3。
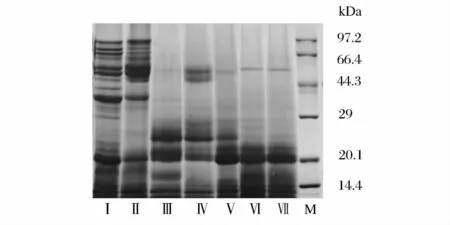
图3 各种豆粕饲料的蛋白质电泳结果图Fig.3 SDS-PAGE diagram of the protein composition for different soybean meal feedingstuffs

表3 各种豆粕饲料中蛋白质分子质量分布Table 3 Molecular weight distribution of the proteins from different soybean meal feedingstuffs
图3 和表3 表明,经过米曲霉发酵的豆粕(Ⅲ、Ⅴ、Ⅵ、Ⅶ),其大分子蛋白得到了有效地降解,主要的抗原蛋白β-伴球蛋白基本被消除,蛋白质主要集中在20 kDa 以下。而只有植物乳杆菌发酵的豆粕(Ⅱ),其蛋白质几乎没有被降解。和米曲霉单独发酵相比较,工艺2 对豆粕中球蛋白β 亚基(50 kDa 左右)的消除更彻底,表明水解10 h 比继续发酵10 h更有利于蛋白酶参与的降解。米曲霉发酵后串联植物乳杆菌发酵所得的豆粕蛋白(第Ⅲ组)分子量明显比米曲霉发酵后水解再加植物乳杆菌发酵(Ⅳ组)的更低。分析原因可能是:米曲霉发酵后不经水解步骤直接加植物乳杆菌发酵,米曲霉自溶现象不明显,其蛋白酶在后续发酵过程中仍会继续少量分泌,从而有利于降解生成更多的小分子蛋白[19],而采用高温水解之后的米曲霉自溶严重,其蛋白酶停止分泌,不再增加,同时菌体内的一些高分子量蛋白质释放至培养基中,导致小分子量蛋白的比例减少。
2.3 五种工艺发酵豆粕和原豆粕的体外消化
体外消化率结果如图4 所示,其中工艺4(米曲霉发酵后直接串联植物乳杆菌厌氧发酵豆粕)的消化率最高,达到96.8%,高于Da Teng 等人研究的最高消化率(85.36%)[5]。结果表明,米曲霉有氧发酵后与植物乳杆菌串联进行厌氧发酵的工艺使得豆粕中的蛋白质更容易被消化。
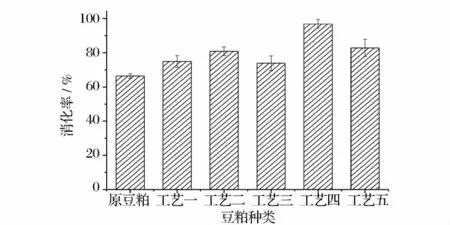
图4 六种豆粕饲料体外消化率Fig.4 In vitro digestibility of six kinds of soybean meal feedingstuffs
3 结论
(1)单菌发酵工艺结果的比较分析表明,经米曲霉发酵后55℃水解的豆粕营养品质要优于米曲霉单独发酵和植物乳杆菌单独发酵,各种蛋白质、小肽、氨基酸含量都高于无水解步骤的单菌发酵,更易于消化吸收,同时脲酶和胰蛋白酶抑制因子等抗营养因子含量更低。单菌发酵结合高温水解有利于营养指标的改善。
(2)双菌串联发酵工艺结果的比较分析表明,米曲霉有氧发酵36 h 后直接串联植物乳杆菌厌氧发酵(工艺4)所获豆粕在营养品质上优于中间加高温水解步骤工艺(工艺5)所获的豆粕,也优于单菌发酵的豆粕和原豆粕。在本研究中,高温水解在双菌串联发酵中并不能提高其营养价值。
(3)工艺4 的发酵豆粕在营养指标上除了常规成分外,还含有乳酸4.95%,GABA 0.317 mg/g,植物乳杆菌活菌数1.93 ×1010CFU/g,。发酵产品具酸香味,体外消化率达96.8%。
该双菌串联固态发酵工艺简单可行且绿色环保,所产豆粕的营养价值高、富含益生菌及益生素,可以减少抗生素和防腐剂的使用,在饲料行业和养殖业具有应用意义。
[1] Fu CJ,Jez JM,Kerley MS,et al. Identification,characterization,epitope mapping,and three -dimensional modeling of α-subunit of β-conglycinin of soybean,a potential allergen for young pigs [J]. J Agric Food Chem,2007,55:4 014 -4 020.
[2] 葛文光.大豆多肽的生理功能及作用效果[J].无锡轻工大学学报,1996,,15(3):272 -277.
[3] 曲永洵.大豆肽的特性及其应用[J]. 中国油脂,1996,21(2):3 -5.
[4] 吴胜华,李吕木,张邦辉,等.多菌种固态发酵豆粕生产小肽饲料[J]. 食品与发酵工业,2008,34(10):113 -115.
[5] Teng D,Gao M,Yang Y,et al. Bio-modification of soybean meal withBacillus subtilisorAspergillus oryzae[J].Biocatal Agric Biotechnol,2012,1(1):32 -38.
[6] Refstie S,Sahlstrom S,Brathen E,et al. Lactic acid fermentation eliminates indigestible carbohydrates and antinutritional factors in soybean meal for Atlantic salmon (Salmo salar)[J].Aquaculture,2005,246:331 -345.
[7] Frias J,Song YS,Cristina MV,et al. Immunoreactivity and amino acid content of fermented soybean products[J].J Agric Food Chem,2008,56 (1):99 -105.
[8] Amadou I,Le G,Shi Y,et al. OptimizedLactobacillus plantarumLP6 solid-state fermentation and proteolytic hydrolysis improve some nutritional attributes of soybean protein meal [J]. J Food Biochem,2011,35:1 686 - 1 694.
[9] 胡家澄,邹晓庭. 新型绿色饲料添加剂—γ -氨基丁酸[J].畜牧与兽医,2009,41(8):98 -100.
[10] 周青,魏春,应向贤,等.产γ-氨基丁酸乳酸菌的筛选及发酵过程研究[J].食品与发酵工业,2011,37(5):26 -31.
[11] 张水华主编. 食品分析[M]. 北京:中国轻工业出版社,2010:125.
[12] 杨奇慧,舒璐,钟剑锋.不同方法测定大豆脲酶活性的比较研究[J].饲料广角,2008(21):30 -32.
[13] 马文强,冯杰,刘欣,等.微生物发酵豆粕营养特性研究[J].中国粮油学报,2008,23(1):121 -124.
[14] 许晶,江连洲,李杨,等.酶水解高温豆粕制备高水解度大豆肽的研究[J].食品与发酵工业,2009,35(4):98-102.
[15] Molina Ortiz SE,Wagner JR. Hydrolysates of native and modified soy protein isolates:structural characteristics,solubility and foaming properties [J]. Food Res Int,2002,35(6):511 -518.
[16] Netto FM,Galeazzi MAM. Production and characterization of enzymatic hydrolysate from soy protein isolate[J].LWT-Food Sci Technol,1998,31(7):624 -631.
[17] Fan ZY,Deng JP,Liu GH,et al. Study on the effect of γ - aminobutyric acid on the reproduction performance and internal hormone levels in growing pigs[J]. Chinese Journal of Animal Nutrition,2007,19(4):350 -356.
[18] 陈秋东,项雷文,郑建兵,等. 大豆中抗营养因子—致甲状腺肿素、凝血素、胰蛋白酶抑制剂祛除方法初探[J].食品研究与开发,2002,23(3):35 -36.
[19] Park MJ,General T,Lee SP. Physicochemical properties of roasted soybean flour bioconverted by solid -state fermentation usingBacillus subtilisandLactobacillus plantarum[J]. Prev Nutr Food Sci,2012(17):36 -45.
