氨基酸添加对吸水链霉菌5008 发酵过程中有效霉素A 合成的影响*
2013-10-30冯劲松李玮刘燕热米拉周文文郑晓冬
冯劲松,李玮,刘燕,热米拉,周文文,郑晓冬
(浙江大学 生物系统工程与食品科学学院,浙江 杭州,310058)
有效霉素A(Validamycin A)又被称作井冈霉素,是一种安全高效的抗真菌抗生素。目前在我国以及东南亚各主要粮食产区,有效霉素A 作为一种优质农药在防治水稻、玉米以及小麦纹枯病方面取得了显著的成效[1]。另外,作为合成抗糖尿病临床药物阿卡波糖(拜糖平)和伏格列波糖(倍欣)的重要原料,有效霉素A 的发酵生产在医药领域也受到了广泛关注[2]。目前工业化发酵采用的菌株是上海农药所报道的吸水链霉菌5008 变种(Streptomyces hygroscopicus 5008),尽管自70 年代开始该菌株使用已有近40 年,但其代谢产物有效霉素A 仍是最为有效、应用面积最广的农用抗生素。现阶段我国的年需求量超过6万t,年产值超5 亿元[3-4]。因此如何提高有效霉素A 产量,降低其生产成本仍是当前研究的热点问题。
氨基酸作为重要的生物小分子,在微生物发酵过程中对菌体生长以及抗生素合成起着关键性作用。作为抗生素合成的前体物质,氨基酸可以直接参与到抗生素合成途径中参与合成反应;氨基酸或其功能肽结构可以作为抗生素合成过程的激活剂或抑制剂对代谢途径中关键酶的活力进行调节;作为氮源,培养基中氨基酸的种类与含量也会影响菌体的生长速率;而作为两性小分子,氨基酸的水解产物会造成培养基中pH 波动,改变微生物的生长环境。
在发酵过程中添加氨基酸促进发酵产量的方法已在很多微生物中进行了应用[5-8]。Cheng 等[9]发现在培养基中添加氨基酸会对链霉菌生长以及次级代谢产物合成有着显著的影响。在吸水链霉菌5008的发酵过程中,其次级代谢物-有效霉素A 的合成会受多方面因素的影响[10-11]。汪世山等[12]利用响应面实验证实以黄豆饼粉作为氮源时,有效霉素A 产量会显著提高。随后Wei 等[13]进一步验证了氮源的种类与含量对有效霉素A 产量影响的作用。有效霉素A 作为氨基糖苷类抗生素,其生物合成必定需要结合氮源提供的氨基以完成结构转化,所以氨基酸对其生物合成尤为重要,但目前对氨基酸影响有效霉素A 生物合成的研究十分有限。本实验通过在摇瓶中添加9 种不同种类的氨基酸,研究其对有效霉素A发酵过程的影响,以便系统地阐述氨基酸对吸水链霉菌5008 生长及代谢产物积累的作用,为深入研究有效霉素A 合成过程中氨基的来源提供了实验依据。
1 材料与方法
1.1 菌种与培养基
实验菌种为吸水链霉菌5008(S. hygroscopicus 5008),孢子悬浮于25%甘油中,-20℃保存。
产孢平板培养基(SFM)(g/L):黄豆饼粉20、甘露醇20、琼脂20。
种子培养基(g/L):玉米粉30、黄豆饼粉22、酵母提取物10、NaCl 2、KH2PO40.8。
发酵培养基(g/L):玉米粉100、黄豆饼粉25、酵母提取物5、NaCl 1、KH2PO41.5。
1.2 培养方法
种子培养:在250 mL 摇瓶中装入50 mL 种子培养基,121℃灭菌20 min。在超净工作台中,接种0.1 mL 孢子悬浮液。培养温度37℃,转速220 r/min,培养时间1d。
发酵培养:在250 mL 摇瓶中装入50 mL 发酵培养基,121℃灭菌20 min。在超净工作台中,接种5 mL 种子培养液。在接种12 h 后,在超净台中将灭菌好的氨基酸按照1、10、100 mmol/L 的终浓度加入到发酵培养基中。每隔24 h,用灭菌枪头对同一发酵条件下的3 个摇瓶进行取样,每次吸取2 mL 培养液于离心管中用于后续检测。培养温度37℃,转速220 r/min,培养时间5d。
1.3 分析方法
1.3.1 有效霉素A 产量测定
本研究结合相关文章报道,以0 ~20 g/L 浓度范围的有效霉素A 纯品溶液制作标准曲线,采用高效液相色谱法(HPLC)测定有效霉素A 产量[11]。
吸取2 mL 发酵液于离心管,10 000 g 离心5 min,吸取0.5 mL 上清液于新离心管。加入0.5 mL氯仿,剧烈振荡直至形成乳浊液。将乳浊液常温静置15 min,12 000 g 离心5 min。上清液用0.22 μm 微孔滤膜过滤,待测。配制液相磷酸盐溶液:吸取7.8 g/L的NaH2PO4·2H2O 溶液51 mL,吸取17.9 g/L 的Na2HPO4·12H2O 溶液49 mL,去离子水定容到1 000 mL,调节pH 到7.0。溶液用0.22 μm 滤膜抽滤后超声30 min,待用。色谱柱采用Elite Hypersil ODS2 C18column (250 mm×4.6 mm,5 μm),检测波长为210 nm,流动相为98%的磷酸盐缓冲液与2%的甲醇,流速为1 mL/min,柱温为35℃,出峰时间约为8 min。
1.3.2 菌体生长量测定
由于发酵培养基中用作营养物质的玉米粉和黄豆饼粉都是实际生产中使用的固体颗粒材料,所以常规的干重法并不能准确反映菌体生长的情况。本实验采用Bradford 法测量细菌裂解后的蛋白量来反映菌体生长[11-14]。
1.3.3 残糖含量测定
通过计算培养基中各组分的含糖量(玉米粉82.92%,黄豆饼粉24.57%,酵母粉25.89%),得出培养基的初始糖浓度为90.35 g/L,并采用苯酚-浓硫酸法测定残糖含量[10],以反映培养基中总糖利用情况。
1.3.4 三磷酸甘油醛脱氢酶( GAPDH) 与葡萄糖-6-磷酸脱氢酶( G6PD) 活力测定
G6PD 的测定方法参照Lee 的报道并进行修改[15]。GAPDH 的测定方法参照Ralser 和Griffiths 的报道[11,16]。
以上数据均是取自3 个独立样本的平均值,在SPSS 软件中采用独立样品t 检验对数据的差异性进行分析,如果P值小于0.05,差异被认为是显著的。
2 结果与讨论
2.1 氨基酸最适添加浓度筛选及其对有效霉素A产量的影响
不同种类、不同添加量的氨基酸添加发酵实验结果如图1 所示。
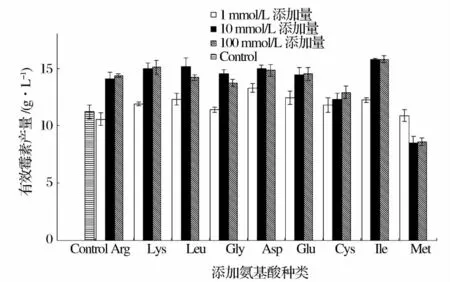
图1 不同氨基酸添加量对有效霉素产量的影响Fig.1 Effect of additive amounts of different amino acids on Val-A production
图1 结果表明,所有氨基酸添加发酵实验中,当氨基酸添加浓度只有1 mmol/L 时,与对照组相比,有效霉素A 产量受到的影响有限;而当氨基酸添加浓度达到10 mmol/L 时,除去半胱氨酸与甲硫氨酸添加组,其余组中有效霉素A 产量都有明显的上升;当氨基酸添加浓度提高至100 mmol/L,发酵产量并未有更为明显的升高,这说明10 mmol/L 的氨基酸浓度是促进有效霉素A 产量的阈值浓度,并且从成本角度考虑也认为10 mmol/L 是氨基酸添加发酵策略的最适添加浓度。这一现象与Stirrett[8]和Bouras[17]的研究结果类似,他们发现添加氨基酸对抗生素产量的提升作用存在最适浓度,当添加量超过这一浓度时,次级代谢产物产量并不会再有显著提升。随后在最适添加浓度下,对氨基酸影响有效霉素A 产量的结果进行分类分析。
在测试的氨基酸中,精氨酸和赖氨酸为碱性。氨基酸;天冬氨酸和谷氨酸为酸性氨基酸;半胱氨酸为极性中性氨基酸;亮氨酸、异亮氨酸、甘氨酸和蛋氨酸均为非极性中性氨基酸。由表1 可知,9 种氨基酸中仅有半胱氨酸对有效霉素产量没有影响,其他8 种氨基酸均有显著影响。除甲硫氨酸对有效霉素A 合成表现出较强的抑制作用,其余7 种氨基酸均表现出显著的促进作用。其中异亮氨酸与亮氨酸对产量提升促进作用最大,与对照相比,分别使有效霉素A 产量提高了48%和43%。根据氨基酸的酸碱性对有效霉素A 产量影响进行分类分析,结果显示中性氨基酸效果最优,其次为酸性氨基酸,碱性氨基酸效果最差。根据Jin 等[18]报道,当发酵环境中pH 较低时会降低有效霉素A 的终产量,但我们通过添加强酸弱碱盐和强碱弱酸盐调节发酵过程中pH 模拟该报道结论,最终产量结果并未显示出与氨基酸添加实验相同的效果,而且氨基酸添加实验中2 种含硫的中性氨基酸,甲硫氨酸与半胱氨酸也未对有效霉素A 产量产生促进作用,所以推测氨基酸引起的pH 变化并不是影响有效霉素A 产量的唯一因素。
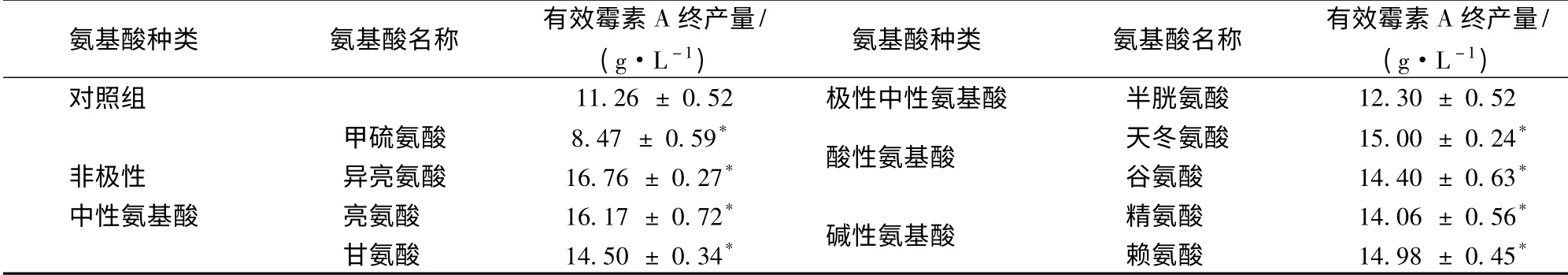
表1 不同种类氨基酸对有效霉素产量的影响Table 1 Effect of different kinds of amino acids on Val-A production
2.2 氨基酸对菌体生长和糖利用的影响
在抗生素发酵过程中加入前体氮源物质提高发酵效价的报道中,代焕梅等[19]发现添加丝氨酸会促进菌体生长并提高宁南霉素产量;胡景等[20]发现在添加氨基酸之后,阿维菌素的产量会随着菌体生长的促进而得到提高。在确定了氨基酸的最适添加浓度和其对产量影响作用后,我们对10 mmol/L 添加浓度下不同种类氨基酸对菌体生长和糖利用的影响进行考察,如表2 所示,尽管氨基酸会对有效霉素A 产量产生影响,但是与对照组相比,所有氨基酸添加组中链霉菌生物量积累并无显著差异,且整个过程中糖利用也未呈现显著变化。由此可见,氨基酸添加对有效霉素A 产量的提升作用,不是通过增加细胞量或提高糖利用率实现的,而是通过调节胞内碳源流向,促进单位细胞中有效霉素A 的合成效率,进而实现了对有效霉素A 产量的提升作用。

表2 不同种类氨基酸对蛋白积累和糖利用的影响Table 2 Effect of different kinds of amino acids on protein accumulation and sugar utilization
2.3 氨基酸对菌体碳代谢的影响
曾有报道指出[21]在酵母发酵过程中经过脱氨作用的氨基酸碳骨架可经特定的分解代谢途径直接进入三羧酸循环(TCA),导致碳代谢流在3-磷酸甘油醛节点处发生转移,进而影响次级代谢。由图2 所示,在吸水链霉菌5008 中,磷酸戊糖途径(PPP)是合成有效霉素A 前体物质7-磷酸景天庚酮糖的主要代谢途径,作为限速酶,6-磷酸葡萄糖脱氢酶(G6PD)的活力直接影响磷酸戊糖途径中有效霉素A 前体的积累量。此外,糖酵解途径(EMP)作为胞内主要供能途径与PPP 途径对碳源存在着竞争关系,三磷酸甘油醛脱氢酶(GAPDH)是催化EMP 途径中关键反应的限速酶,因此其活力不仅会直接影响菌体生长也会间接影响有效霉素A 前体的合成。我们选定对有效霉A 素产量有明显影响作用的异亮氨酸与甲硫氨酸发酵组,对其碳代谢途径中关键酶活力进行了检测,以反映氨基酸对碳代谢的影响。
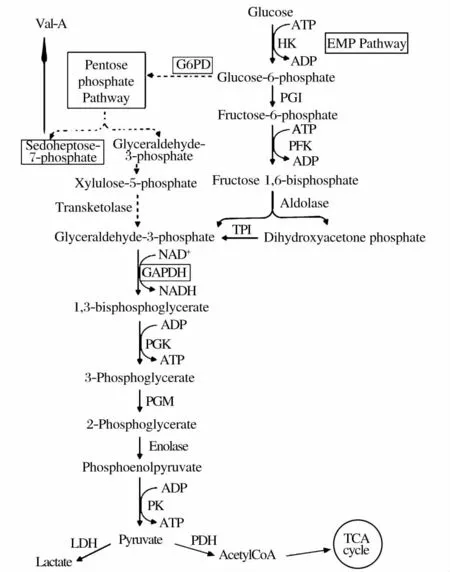
图2 碳代谢与有效霉素A 合成的关系Fig. 2 Relationship between carbon metabolism and Val-A biosynthesis
由图3a 所示,异亮氨酸组中,G6PD 活力在发酵初期就呈现出明显的升高,在24 h,酶活力提高了41%,在48 h,酶活力也有24%的提高。而甲硫氨酸组却在48 h 使G6PD 活力抑制了11%。当发酵进入稳定期后,菌体生长停滞,所有发酵组中G6PD 活力大幅度下降,与对照相比不再有差异。与G6PD 相比,作为主要供能途径的限速酶,GAPDH 在整个生长周期中都保持着较高的活性。由图3b 所示,氨基酸添加对GAPDH 活力影响不大。在菌体生长前期,GAPDH 活力并没有展现出与对照组的区别。但是当菌体生长到48 h 向稳定期过渡阶段,异亮氨酸组中GAPDH 活力开始下降,到72 h,异亮氨酸组中GAPDH 活力受到明显抑制,与对照组相比其活力降低了13%,到96 h,抑制解除,所有组中GADPH 活力一致。
结合2 种酶活力变化的结果分析,异亮氨酸在发酵初期就对PPP 途径有明显的促进作用,但在对数生长阶段并没有抑制EMP 途径,所以菌体生长没有受到影响,当进入稳定期,菌体内次级代谢逐渐增强,在这一阶段异亮氨酸抑制了EMP 途径的活力,使碳代谢从EMP 途径流向PPP 途径,促进了有效霉素A前体的转化,提高了有效霉素A 生物合成的效率。而甲硫氨酸在发酵初期便对PPP 途径有明显的抑制作用,但在整个发酵周期中对EMP 途径的活力并没有影响,其通过抑制有效霉素A 合成前体的积累,降低了有效霉素A 的产量。由此推测,氨基酸都是通过调节碳代谢途径中关键酶活力,影响有效霉素A合成前体7-磷酸景天庚酮糖的积累量,从而造成对有效霉素A 生物合成的影响作用(包括异亮氨酸的促进作用与甲硫氨酸的抑制作用)。
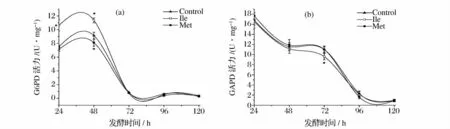
图3 氨基酸对碳代谢途径的影响Fig.3 Effect of amino acids on carbon metabolic pathway
3 结论
本研究将不同种类氨基酸添加到吸水链霉菌5008 发酵过程中并对其影响进行检测,进一步探索了氮源种类和含量对有效霉素A 产量的影响作用,通过筛选氨基酸添加量,发现氨基酸添加的最适阈值浓度,根据氨基酸的酸碱性,将其影响进行分类分析,在添加氨基酸的发酵实验中,除去半胱氨酸与甲硫氨酸,其余各组都展现了对有效霉素A 产量显著的促进作用。虽然中性氨基酸会优于酸性与碱性氨基酸,但是2 种含硫的中性氨基酸-半胱氨酸与甲硫氨酸并没有提高有效霉素A 的产量,说明氨基酸引起的pH变化并不是导致有效霉素A 产量提高的原因。随后为了进一步探索氨基酸的影响作用,对菌体生长和糖利用情况进行了检测,结合对碳代谢关键酶活力的分析,发现氨基酸是通过调节碳代谢途径的活力,实现了碳源从糖酵解途径到磷酸戊糖途径代谢流向的变化,从而造成了有效霉素A 前体积累量的改变,影响有效霉素A 的生物合成。此外在有效霉素A 合成过程中,氮的来源尚不清楚,因而氨基酸还可能以氨基氮形式存在,直接参与到次级代谢产物的合成反应中,促进有效霉素A 产量的提高。实验中发现2 种含硫氨基酸对有效霉素A 合成并无促进作用,且甲硫氨酸还会显著降低有效霉素A 的产量,这与氨基酸所携带基团有着密切关联,还需要进一步实验加以证实。
[1] 沈寅初. 农用抗生素-井冈霉素开发研究[J]. 抗生素,1981,6(1):58 -61.
[2] Bai L,Li L,Xu H,et al. Functional analysis of the validamycin biosynthetic gene cluster and engineered production of validoxylamine A[J]. Chem Biol,2006,13(4):387 -397.
[3] Deng Z,Bai L. Antibiotic biosynthetic pathways and pathway engineering-a growing research field in China[J]. Nat Prod Rep,2006,23(5):811 -827.
[4] 郭文灿,钟世华,黄叶菊. 井冈霉素生产工艺优化研究[J]. 精细化工中间体,2006,36(2):40 -42.
[5] Choudhari S M,Ananthanarayan L,Singhal R S. Use of metabolic stimulators and inhibitors for enhanced production of β-carotene and lycopene byBlakeslea trisporaNRRL 2895 and 2896[J]. Bioresour Technol,2008,99(8):3 166 -3 173.
[6] Lin J,Bai L,Deng Z,et al. Enhanced production of ansamitocin P-3 by addition of isobutanol in fermentation ofActinosynnema pretiosum[J]. Bioresour Technol,2011,102(2):1 863 -1 868.
[7] 刘沛溢,董函竹,谭天伟. 补加前体L-蛋氨酸对高密度发酵生产S-腺苷-L-蛋氨酸的影响[J]. 生物工程学报,2006,22(2):268 -272.
[8] Sturrett K,Ddnoya C,Westpheling J. Branched-chain amino acid catabolism provides precursors for the Type II polyketide antibiotic,actinorhodin,via pathways that are nutrient dependent[J]. J Ind Microbiol Biotechnol,2009,36(1):129 -137.
[9] Cheng Y R,Fang A,Demain A L. Effect of amino acids on rapamycin biosynthesis byStreptomyces hygroscopicus[J]. Appl Microbiol Biotechnol,1995,43(6):1 096 -1 098.
[10] Liao Y,Wei Z H,Bai L,et al. Effect of fermentation temperature on validamycin A production byStreptomyces hygroscopicus5008[J]. J Biotechnol,2009,142(3):271 -274.
[11] Zhou W W,Ma B,Tang Y J,et al.. Enhancement of validamycin A production by addition of ethanol in fermentation ofStreptomyces hygroscopicus5008[J]. Bioresour Technol,2012,114(12):616 -621.
[12] 汪世山,陈守文,喻子牛. 吸水链霉菌井冈霉素发酵中氮源及碳氮比的优选[J]. 华中农业大学学报,2001,20(6):554 -556.
[13] Wei Z H,Bai L,Deng Z,et al. Impact of nitrogen concentration on validamycin A production and related gene transcription in fermentation ofStreptomyces hygroscopicus5008[J]. Bioprocess Biosyst Eng,2012,35(7):1 201-1 208.
[14] Zhang Q,Lo C M,Ju L K. Factors affecting foaming behavior in cellulase fermentation byTrichoderma reesei RutC-30[J]. Bioresour Technol,2007,98(4):753 -760.
[15] Lee Y N,Lessie T G. Purification and characterization of the two 6-phosphogluconate dehydrogenase species fromPseudomonas multivorans[J]. J Bacteriol,1974,120(3):1 043 -1 057.
[16] Ralser M,Wamelink M M,Kowald A,et al. Dynamic rerouting of the carbohydrate flux is key to counteracting oxidative stress[J]. J Bacteriol,2007,6(10):1 -18.
[17] Bouras N,Mathieu F,Sabaou N,et al. Effect of amino acids containing sulfur on dithiolopyrrolone antibiotic productions bySaccharothrix algeriensisNRRL B-24137[J].J Appl Microbiol,2006,100(2):390 -397.
[18] Jin L Q,Xue Y P,Zheng Y G,et al. Production of trehalase inhibitor validoxylamine A using acid-catalyzed hydrolysis of validamycin A[J]. Catal Commun,2006,7(3):157 -161.
[19] 代焕梅,陈家任,胡厚芝,等. 丝氨酸对宁南霉素生物合成的影响[J]. 中国抗生素杂志,2007,32(6):334 -337.
[20] 胡景,储炬,谌颉,等. 前体氨基酸对avermectin 生物合成的影响[J]. 中国抗生素杂志,2004,29(7):388-390.
[21] 谢涛,方慧英,诸葛健. 一些氨基酸对产甘油假丝酵母生产的促进作用[J]. 生物工程学报,2006,22(1):138 -143.
