低产乙醛啤酒酵母的定向驯化筛选*
2013-10-30沈楠王金晶刘春凤李永仙李崎
沈楠,王金晶,刘春凤,李永仙,李崎
1(江南大学教育部工业生物技术重点实验室,江苏 无锡,214122)
2(江南大学酿酒科学与工程研究室,江苏 无锡,214122)
乙醛,啤酒中含量最高的挥发性醛,是啤酒生青味、烂苹果味的主要来源,其含量的高低直接决定了啤酒的品质。成熟的优质啤酒的乙醛含量一般在3~8 mg/L[1]。乙醛是引起“上头”的物质之一,并具有致癌作用,国外学者对其致癌性和毒性已进行了大量的研究[2]。因此,目前关于乙醛的研究重点是如何降低其在啤酒中的含量。
国内外的啤酒生产一般都是通过酿造工艺的调整来降低乙醛的含量[3-6]。但要从根本上解决成品啤酒中乙醛含量偏高的问题,选育低产乙醛的啤酒酵母是最理想的措施和手段。因此很多研究者利用分子手段通过基因工程的方法改良菌种来改变乙醛的代谢能力[7-10],以达到降低乙醛产量的目的。
在酵母的代谢途径中(如图1),乙醛脱氢酶是乙醛代谢途径中的关键酶之一。双硫仑是乙醛脱氢酶的抑制剂,使乙醛不能氧化为乙酸,致使乙醛在胞内蓄积,乙醛是毒性物质,当胞内乙醛浓度升高时,可与一些蛋白质、磷脂、核酸等形成共价键结合,导致这些物质失活,从而引起机体的多种不适。目前国内外对双硫仑的关注主要在医药领域,其作为戒酒、抗白内障、抗胶质瘤等药物已被广泛应用,尚未有研究报道其可作为酵母选育的“筛子”。本文设想利用双硫仑筛选低产乙醛酵母,其原理如下:在含有双硫仑的、以乙醇为唯一碳源的培养上,双硫仑通过抑制乙醛脱氢酶的活性而抑制酵母的生长,然而酶活性相对较高的菌株由于乙醛脱氢酶活性只受到部分抑制因而能继续在双硫仑平板上生长。能产高活性乙醛脱氢酶的菌株,其代谢的乙醛可在该酶的作用下被快速转化,从而使乙醛含量降低,由此即可筛选出低产乙醛的啤酒酵母。
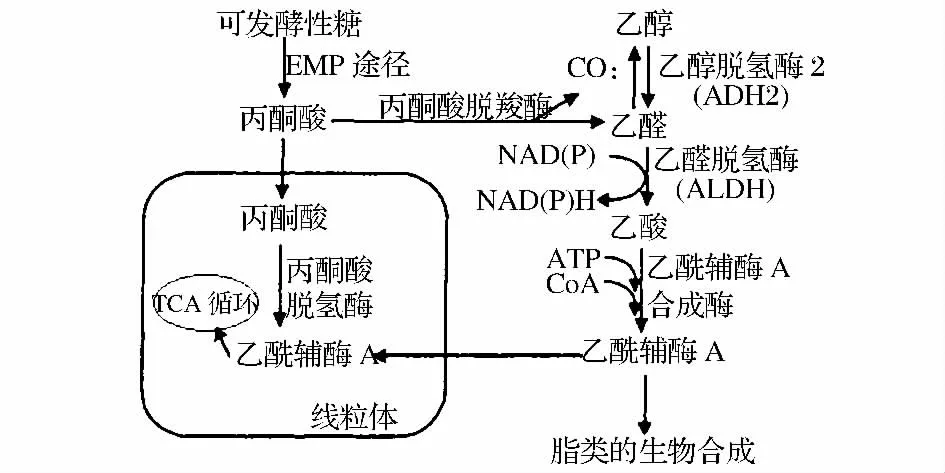
图1 酵母乙醛代谢途径[4]Fig.1 The metabolic pathways of acetaldehyde in yeast
考虑到既要加快乙醛的代谢速度又不能过多改变该菌株的其他各项发酵指标,本研究决定采用紫外诱变的形式对酵母进行改良,利用双硫仑平板初筛到高乙醛脱氢酶的酵母,再将其置于高浓度乙醛培养基连续驯养,进化出较强的乙醛代谢能力而筛选出优选菌,从代谢途径上降低酵母代谢乙醛的含量。
1 材料与方法
1.1 材料
1.1.1 菌株和培养基
酿酒酵母(Saccharomyces pastorianu)MI4,由本实验室保藏。
无碳培养基:(NH4)2SO45 g/L,KH2PO41 g/L,NaCl 0.1 g/L,MgSO4·7H2O 0.5 g/L,CaCl20.1 g/L,酵母膏0.1 g/L,灭菌条件:121 ℃,20 min。
双硫仑平板:在无碳培养基的基础上,添加琼脂、无水乙醇及一定浓度的双硫仑。
乙醛培养基:(NH4)2SO45 g/L ,KH2PO41 g/L,NaCl 0.1 g/L,MgSO4·7H2O 0.5 g/L,CaCl20.1 g/L,酵母膏0.1 g/L,乙醛500 mg/L,灭菌条件:121 ℃,20 min。
YEPD 培养基:酵母浸出粉10 g,蛋白胨20 g,葡萄糖20 g,水1 000 mL,pH 6.0,灭菌条件:115 ℃15 min。
自制麦汁:灭菌条件:115 ℃15 min。
1.1.2 试剂
酵母浸出粉,蛋白胨购自英国OXOID;葡萄糖,无水乙醇,CaCl2,NaCl,(NH4)2SO4等,国药集团;双硫仑,镇江天茂橡胶助剂有限公司;麦芽,中粮;99.5%乙醛,阿拉丁。
1.1.3 仪器
灭菌锅,日本Hirayama-HVE-50;顶空气相色谱仪(GC-2010 型),日本岛津(Shimadzu)公司;超净台,苏净集团安泰公司;生化培养箱SPX-250,上海跃进;HYG-A 全温摇瓶柜,太仓市实验设备厂。
1.2 方法
1.2.1 紫外诱变[11]
将对数期的酵母培养液以3 000 r/min 离心5 min,倾去上清液,生理盐水洗涤1 次,洗涤后用生理盐水重悬稀释,使重悬液中酵母细胞数达到106~107CFU/mL 左右。取上述菌悬液10 mL 于9 cm 培养皿,同时放入一无菌磁力搅拌器,置于磁力搅拌器上,置于已开启预热10 min 的15 W 紫外灯下30 cm 处。开启皿盖照射10 ~70 s 后,稀释涂布于YPD 平板,在避光条件下于28 ℃培养箱中培养48 h。
1.2.2 双硫仑初筛
将预先用生理盐水洗涤2 ~3 次的诱变菌涂布于含3.5 mg/L 的双硫仑抗性平板上,培养4 ~5 d 后,挑取能生长在此平板上生长的菌株进行摇瓶发酵。
1.2.3 高浓度乙醛培养基驯化
经初筛后的酵母置于一定浓度的以乙醛为唯一碳源的液体培养基中,每48 ~72 h 转接1 次以保证乙醛的浓度,11 ℃培养14 d。
1.2.4 摇瓶发酵
斜面菌株1 环→10 mL 试管(25 ℃,36 h)→9 mL试管(25 ℃,36 h)→70 mL 麦汁(23 ℃,48 h)→4 ℃冰箱中沉降酵母泥12 h 左右→250 mL 麦汁(500 mL锥形瓶中),摇匀后上发酵栓,水或浓硫酸密封→11℃发酵6 d→分析乙醛含量
1.2.5 顶空气相色谱法测定乙醛含量[12]
顶空进样器平衡温度70 ℃,平衡时间30 min,传输线温度:130 ℃,进样时间:0.04 min,进样口温度:200 ℃,检测器温度:250 ℃,色谱柱初始温度40 ℃,经程序升温10 ℃/min 到180 ℃;柱流量1. 2 mL/min,载气(N2)流量:30 mL/min,燃气(H2)流量:47 mL/min,助燃气(空气)流量:400 mL/min。
2 结果与分析
2.1 致死率曲线
使用15 W 紫外灯,在30 cm 处对打散的酵母菌液进行不同时间的紫外照射,得到酵母的致死情况如图2 所示。

图2 不同照射时间下的酵母致死率Fig.2 Lethality of lager yeast strains after UV mutation
采用紫外诱变选育啤酒酵母一般要考虑以下几方面,首先紫外致死率较低则达不到对啤酒酵母某些发酵性能进行改良的目的,其次较高的致死率又会引起出发菌性能的大幅度改变,会改变成品啤酒的主体风味,因此选择80%的致死率为最佳,即选择经紫外诱变27 s 后的菌株进行诱变。
2.2 双硫仑初筛方法的建立
分别以含双硫仑浓度为0.5、1.0、1.5、2.0、2.5、3.0、3.5 mg/L 的培养基培养出发菌,只有双硫仑为3.5 mg/L 的培养基无酵母长出,所以选取3.5 mg/L为筛选低产乙醛酵母的抗性浓度。将经生理盐水洗涤后的诱变酵母菌株均匀涂于以乙醇为唯一碳源、双硫仑含量为3.5 mg/L 的选择培养基上,28 ℃条件下培养48 ~72 h 后,长出乳白色菌落,如图3 所示。
同时从上述双硫仑抗性平板上挑取50 株生长状态良好的菌落,进行500 mL 三角瓶发酵,发酵结束后考察其乙醛含量,结果如表1 所示。实验证明经双硫仑平板筛选的酵母均是乙醛含量降低的菌株,只是乙醛含量的降低幅度有高有低,需要进一步筛选。

图3 诱变菌初筛结果Fig.3 Screening of mutant strains
2.3 乙醛驯养可行性的验证
经紫外诱变的酵母分别置于乙醛培养基(乙醛含量为150 mg/L)和普通的麦汁(原麦浓度为11 °P)培养中驯养同样的时间后,进行三角瓶发酵,考察其乙醛含量。由表2 和表3 可以看出,经乙醛培养基驯养的酵母乙醛下降率(89.5%)要高于普通麦汁驯养的酵母(63.1%)。而且经过乙醛培养基驯养的酵母乙醛含量下降50%以上的占68.4%,而经麦汁培养驯养的乙醛下降50%仅占15%。从而证明酵母通过一定时间的高浓度的乙醛压力的驯化,提高酵母自身转化乙醛的能力,使终产物中乙醛的浓度进一步降低。双硫仑平板与乙醛培养基驯化的结合可以有效的筛选出低产乙醛酵母菌,减少了菌株选育的盲目性。

表2 经乙醛培养基驯养后的酵母发酵情况Table 2 Fermentation of the yeast by directional domestication with acetaldehyde

表3 经普通麦汁培养基驯养后的酵母发酵情况Table 3 Fermentation of the yeast by directional domestication with wort
2.4 菌种的筛选
2.4.1 初筛
挑取双硫仑抗性平板上的单菌落经活化后,接入带有发酵栓的500 mL 三角瓶进行发酵,发酵结束后对发酵液中的乙醛进行分析,部分结果如表4 所示。
2.4.2 复筛
从初筛的60 株酵母中选出4 株较优的进一步复筛,将4 株菌在乙醛含量为150 mg/L 的液体培养基中11 ℃传代生长,低温既符合啤酒工业生产的发酵环境也保证乙醛的不挥发,同时每48 h 转接1 次新鲜的乙醛培养基,使菌体始终处在“高渗透压”的环境下,利于其定向驯化。4 株啤酒酵母经复筛后,摇瓶发酵乙醛含量如表5 所示。

表5 4 株优选菌发酵液乙醛含量Table 5 Acetaldehyde content of four mutants
表5 中4 株啤酒酵母的乙醛含量均可适用于啤酒生产,但是考察1 株啤酒酵母,要综合多种发酵性能,以保证其可以满足啤酒实际大生产的需要。综合啤酒风味、酵母的生长性能、遗传稳定性等生理生化指标,最终发酵实验证明D-A-14 更符合啤酒生产的要求,如表6 所示D-A-14 发酵液相对于出发菌MI4而言,高级醇总量降低而酯升高,风味更加协调。同时通过对该株菌的大量实验发现,该株适合在15 ℃发酵,相对于传统的11 ℃的低温发酵,更有利于节能降耗。

表6 出发菌与优选菌的三角瓶发酵指标(mg/L)Table 6 Some indexes with the fermentation of initial strain and mutants (mg/L)
3 结论
采用紫外诱变的处理方式,再经双硫仑平板初筛及乙醛液体培养基复筛可以有效的得到低产乙醛啤酒酵母,该菌株各项发酵性能良好,遗传性能稳定,适用于啤酒工业大生产。
[1] 顾国贤主编. 酿造酒工艺学[M]. 北京:中国轻工业出版社,1996:204 -205.
[2] Dirk W Lachenmeier,Eva-Maria Sohnius. The role of acetaldehyde outside ethanol metabolism in the carcinogenicity of alcoholic beverages:Evidence from a large chemical survey[J]. Food and Chemical Toxicology 2008(46):2 903 -2 911.
[3] 李明东,张袢心,苗同畅. 啤酒中乙醛含量的影响因素及控制[J]. 啤酒科技,2007(7):22 -23.
[4] 袁静. 啤酒中乙醛含量的影响因素及其控制[D]. 无锡:江南大学,2008:2 -13.
[5] Romano P,G Suzzi,L Turbanti,et al. Acetaldehyde production inSaccharomyces cerevisiaewine yeasts[J]. FEMS Microbiology Letters,1994,118(3):213 -218.
[6] 唐朝艳. 影响啤酒乙醛含量的因素分析[J]. 啤酒科技,2010(1):15 -16.
[7] Wang ZY,Wang JJ,Liu XF,et al. Recombinant industrial brewing yeast strains with ADH2 interruption using self-cloning GSH1 + CUP1 cassette[J]. FEMS Yeast Research,2009,9(4):574 -581.
[8] Wang JJ,Wang ZY,Liu XF,et al. Construction of an industrial brewing yeast strain to manufacture beer with low caloric content and improved flavor[J]. J Microbiol Biotechnol,2010,20(4):767 -774.
[9] Wang JJ,Wang ZY,Liu XF,et al. Construction of amylolytic industrial brewing yeast strain with high glutathione content for manufacturing beer with improved anti-staling capability and flavor[J]. J Microbiol Biotechnol,2010,20(11):1 539 -1 545.
[10] 王德良,宋绪磊,张五九. 采用分子生物学降低啤酒中乙醛含量的研究[J]. 啤酒科技,2005(12):18 -23.
[11] 诸葛健,王正祥主编. 工业微生物实验技术手册[M].北京:中国轻工业出版社,1994:391 -392.
[12] 张媛媛,魏良鑫,佟婷婷,等. 顶空进样气相色谱法检测啤酒中的乙醛[J]. 分析实验室,2011(9):26 -29.
