L-苯丙氨酸抗噬菌体生产菌的选育和应用
2013-10-30周海岩刘龙堵国成陈坚
周海岩,刘龙,堵国成,3,陈坚,3
1 (浙江工业大学生物工程研究所,浙江 杭州,310014)
2 (江南大学生物工程学院,江苏 无锡,214122)
3 (江南大学食品科学与技术国家重点实验室,江苏 无锡,214122)
噬菌体是一类感染细菌或放线菌的特殊的病毒[1]。噬菌体污染现象在工业发酵生产中极其普遍,轻则使发酵周期延长、发酵产量降低,重则造成倒罐,不仅浪费时间、人力及物力,而且造成重大经济损失[2]。为解决噬菌体污染的问题,通常采用多方面综合治理的措施,即控制生产环境质量、化学防治及更换或轮流使用不同的生长菌株等方法。然而防治过程往往不够彻底,这是由于噬菌体分布极其广泛,凡是有细菌的地方就可能存在相应的噬菌体,而且噬菌体体积较小,一般的过滤装置难以将其完全除去。抗噬菌体生产菌株的选育可以从根本上解决这一问题,从而保证发酵过程连续、稳定地进行。
在大肠杆菌WSH-Z06 (pAP-B03)发酵生产L-苯丙氨酸(L-Phe)过程中,L-Phe 产量下降、菌体裂解、发酵产物提取困难等异常现象时有出现。经双层平板法检测证实,导致发酵异常的主要原因是噬菌体污染。为克服此问题,本研究进行了抗噬菌体并高产L-Phe 的菌株选育工作,考察了突变株在外源添加噬菌体条件下的发酵能力,并初步探讨了突变株的抗噬菌体机制,为L-Phe 的工业化生产提供了1 株发酵性能优良的菌株。
1 材料与方法
1.1 菌株、质粒和噬菌体
大肠杆菌WSH-Z06 和质粒pAP-B03,由江南大学生物系统与生物加工实验室构建并保藏[3]。
噬菌体BP-1 分离于重组大肠杆菌WSH-Z06(pAP-B03)的L-Phe 异常发酵液,由中国典型培养物保藏中心保藏,保藏编号为CCTCC NO:M 2010054。
1.2 培养基
TY 培养基[4](g/L):蛋白胨10,酵母膏5,葡萄糖1,NaCl 5,pH 7.0,用于噬菌体增殖;单层固体培养基中加琼脂2%,用于噬菌体的检测;双层固体培养基中上层加琼脂0.8%,下层加2%,用于噬菌体的分离和检测。
蛋白胨水[5]:蛋白胨10 g/L,蒸馏水配制,pH 7.0。
曙红亚甲基蓝琼脂培养基(EMB):蛋白胨10 g/L,乳糖10 g/L,KH2PO42 g/L,2%伊红Y 溶液20 mL,0.65%美蓝溶液10 mL,琼脂2%,pH 7.1,用于大肠杆菌的鉴定。
种子培养基、发酵培养基和流加培养基参照文献[3]。
1.3 噬菌体BP-1 的分离、纯化
1.3.1 噬菌体增殖液的制备
取感染了噬菌体的发酵液5 mL,接入50 mL TY培养基中,同时加入1 mL 培养至对数期的WSH-Z06菌液,于37℃、200 r/min 培养12 ~16 h,即为噬菌体增殖液。
1.3.2 噬菌体裂解液的制备
取噬菌体增殖液500 μL,加入到4.5 mL 蛋白胨水中;37℃、200 r/min 振荡培养4 ~6 h;60℃水浴中静置10 min 以诱导噬菌体的释放;37℃、200 r/min振荡培养2 ~3 h;加入10% (v/v)三氯甲烷,处理30 min (帮助噬菌体裂解细菌);8 000 r/min 离心5 min;取上清液,用0.22 μm 的微孔滤膜过滤除菌;置于4℃冰箱中保存备用。
1.3.3 噬菌体的分离、纯化
采用双层琼脂平板法[6]。将适当稀释的噬菌体裂解液100 μL、培养至对数期的WSH-Z06 菌悬液100 μL 加入到保温于45 ~50℃的TY 上层培养基中,振荡混匀,立即倒入预先准备好的下层培养基平板表面,凝固后置于37℃培养12 ~24 h,待平板上出现单个的噬菌斑,用接种针将噬菌体接入含有WSHZ06 的液体TY 中,37℃振荡培养12 ~16 h;按照1.3.2 所述的方法制备噬菌体裂解液,重复以上步骤,直至出现形态、大小特征基本一致的噬菌斑。
1.3.4 噬菌体效价的测定
对双层平板中出现的噬菌斑进行计数,将结果代入以下公式以计算噬菌体的效价:

式中,N为效价值(PFU/mL);Y为平均噬菌斑数/皿;V为取样量(mL);X为稀释倍数。
1.3.5 噬菌体的电镜观察
取一定量的异常发酵液或稀释后的噬菌体裂解液,与等量的2%磷酸钨钠混合染色5 ~10 min 后滴1 小滴在覆有弗姆瓦(Formvar)的铜网膜上,用干燥滤纸从侧面吸取染液,自然干燥后在透射电镜(H -7000,日本Hitachi 公司)下观察噬菌体的形态特征。
1.3.6 pH 和温度对噬菌体活性的影响
pH 对噬菌体活性的影响:参照文献[7]进行。将噬菌体裂解液分别加入到pH 为3、4、5、6、7、8 和9的蛋白胨水中,25℃水浴中静置2 h,以pH 7.0 的蛋白胨水逐级稀释,按照1.3.4 所述的方法测定噬菌体的活性。
温度对噬菌体活性的影响:参照文献[7]进行。将噬菌体裂解液分别置于50℃、60℃、70℃和80℃水浴中5 min、10 min、15 min 和20 min,之后立即置于冷水中至恒温,以蛋白胨水逐级稀释,按照1.3.4 所述的方法测定噬菌体的活性。
1.4 抗噬菌体、高产L-Phe 的重组大肠杆菌的筛选
1.4.1 WSH-Z06 的NTG 诱变处理
离心(10 000 r/min,5 min)、收集培养至对数期的WSH-Z06 菌体,用0.1 mol/L,pH 7.0 的磷酸钾缓冲液洗涤1 ~2 次,然后悬浮菌体。按照表1 的体积组成配制成菌悬液为10% (v/v)、NTG 终浓度分别为0.2、0.4、0.6 和0.8 mg/mL 的体系;于37℃、200 r/min 的摇床上振荡30 min;25℃、10 000 r/min 离心10 min,取菌体沉淀,用磷酸钾缓冲液洗涤3 次并制成菌悬液,37℃、200 r/min 中间培养4 ~6 h,适当稀释后涂布LB 平板,37℃下培养过夜。挑取不同形态、大小和颜色的单菌落,用无菌牙签分别点种在划有小格子的LB 平板上,37℃培养12 ~14 h,4℃保藏以待噬菌体抗性的检测。

表1 NTG 诱变体系的体积组成Table 1 Composition and concentration of NTG mutagesis system
1.4.2 抗噬菌体、高产L-Phe 的重组大肠杆菌突变株的筛选
初筛:采用单层平板法[4]。对平板上的单菌落逐一进行噬菌体抗性的检测,方法如下:挑取单菌落,与100 μL LB 培养基在TY 平板中混匀、涂布,在平板的4 个象限处分别滴加10 μL 噬菌体裂解液。静置10 ~20 min,置于37℃培养12 ~24 h,观察噬菌斑的出现。对4 个象限中均没有噬菌斑的菌株进行传代培养,并对每1 代菌株以同样的方法进行噬菌体抗性检验。对于传代20 次以后仍没有出现噬菌斑的菌株进一步以TY 双层平板法对其进行验证,挑选出抗性菌株,作为初筛目的菌株,保藏,以备复筛。
复筛:将L-Phe 生产质粒pAP-B03 转化入初筛目的菌中,检测重组菌摇瓶发酵生产L-Phe 的能力,以WSH-Z06 (pAP-B03)为对照,挑选出在菌体生长和L-Phe 产量方面均没有显著降低的突变株,作为复筛目的菌株,用于L-Phe 的发酵生产。
1.5 感受态的制备及质粒的转化方法
参照《分子克隆实验指南》第三版[8]。
1.6 培养方法
大肠杆菌种子培养、摇瓶发酵和3 L 发酵罐发酵按照文献[3]进行。添加噬菌体的发酵则在培养初始时向培养基中添加1% (v/v)、1 ×1010PFU/mL 的噬菌体裂解液。
1.7 发酵参数检测方法
菌体浓度(DCW)、葡萄糖浓度(Glc)和L-Phe产量测定方法按照文献[3]进行。
2 结果与讨论
2.1 噬菌体BP-1 的分离、纯化和形态特征
WSH-Z06 (pAP-B03)发酵生产L-Phe 的异常发酵液中感染的噬菌体,在TY 双层平板上呈现形态、大小较一致的噬菌斑,后经反复纯化证实感染的是同一种噬菌体,将其命名为BP-1。其噬菌斑呈全透明状,形态为圆形,直径3 mm 左右[图1(a)]。
经透射电镜观察发现,BP-1 呈蝌蚪状,有一个多面体立体对称的头部,直径约45 nm,有一长尾,尾长约125 nm,宽6 ~8 nm,无尾丝[图1(b)],初步判断属于长尾噬菌体科,λ 噬菌体属。
2.2 pH 和温度对BP-1 活性的影响
2.2.1 pH 对BP-1 活性的影响
BP-1 在不同pH 的蛋白胨水中处理后,其活性因pH 的不同而表现出明显的变化。由图2(a)看出,BP-1 的存活率与pH 之间的关系呈现钟形分布;最适pH 范围为5 ~8,在该范围内,BP-1 具有80%以上的存活率;在该范围之外,随着pH 的降低或增加,BP-1的存活率明显下降,在pH 为2 和11 时,接近于0。

图1 噬菌体BP-1 的噬菌斑(a)和电镜下的形态(箭头所指处)(×19 000)(b)Fig. 1 Plaques of bacteriophage BP-1 (a)and its transmission electron micrograph (b)
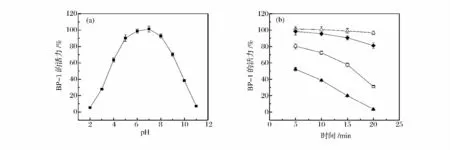
图2 不同pH (a)和温度对噬菌体BP-1 (b)活力的影响Fig. 2 Effect of pH (a)and temperature (b)on bacteriophage BP-1 viability
2.2.2 温度对BP-1 活性的影响
通过测定不同温度下BP-1 的活性,发现其在50℃和60℃下较稳定,处理20 min 之后,活力仍保持在80%以上;而在70℃和80℃下活力随着时间的延长而显著下降,80℃处理20 min 之后,BP-1 的存活率几乎降至0[图2(b)],说明噬菌体BP-1 对60℃以上的温度比较敏感。
2.3 WSH-Z06 的NTG 诱变处理结果
经过4 个不同浓度(0.2、0.4、0.6 和0.8 mg/mL)的NTG 处理后,挑选出416 株菌进行BP-1 抗性的检验,初步得到了6 株突变菌,分别命名为BR-42、BR-55、BR-95、BR-130、BR-183 和BR-184。
对6 株突变菌进行遗传稳定性检验,淘汰了4 株不稳定菌株;对剩下的BR-42 和BR-130 进行镜检、EMB 平板验证等确证了这2 株菌是遗传稳定的抗BP-1 的大肠杆菌(见图3)。
2.4 抗BP-1 的重组菌摇瓶发酵生产L-Phe
对突变菌BR-42 和BR-130 进行质粒pAP-B03的转化和摇瓶发酵培养,以WSH-Z06 (pAP-B03)为对照,结果见表2。

表2 不同的重组大肠杆菌发酵生产L-Phe 的能力比较Table 2 Comparison of L-Phe production by different recombinant E. coli strains

图3 NTG 诱变后的突变菌BR-42 和BR-130 对BP-1 的抗性检测Fig.3 The examination of bacteriophage BP-1-resistance of E. coli mutants after NTG treatment
发酵结束时,对照菌的DCW 和L-Phe 产量分别为7.05 g/L 和4.47 g/L,而BR-130 (pAP-B03)的分别为3.67 g/L 和2.11 g/L,与对照菌相比,分别降低了48%和53%,这可能是由于NTG 对细胞的生理造成的损坏所导致的生长、代谢缓慢;而BR-42 (pAPB03)的DCW (7.18 g/L)和L-Phe 产量(4.24 g/L)均与对照无显著差别,因此,选择BR-42 (pAP-B03)进行以后的发酵实验。
2.5 在添加噬菌体BP-1 条件下的摇瓶发酵
为了考察E.coliBR-42 (pAP-B03)在BP-1 存在条件下生产L-Phe 的能力,在500 mL 摇瓶水平上分别对BR-42 (pAP-B03)和WSH-Z06 (pAP-B03)进行了2 组发酵实验,其中一组是正常发酵培养,另一组是在发酵初始时向培养基中添加了1% (v/v)、效价为1 ×1010PFU/mL 的BP-1 裂解液,结果见表3。在BP-1 存在的条件下,WSH-Z06 (pAP-B03)的生长和生产L-Phe 的能力大大降低,分别是正常发酵时的40%和26%,发酵结束时的pH 值较正常发酵时高19%;而BR-42 (pAP-B03)的DCW、L-Phe 产量以及终pH 值在有BP-1 存在的情况下和正常发酵时均无明显差别,表明BR-42 (pAP-B03)的生长和发酵能力不受噬菌体BP-1 的影响。

表3 添加噬菌体BP-1 条件下的两组大肠杆菌摇瓶发酵参数比较Table 3 L-Phe production by E. coli WSH-Z06 (pAP-B03)and E. coli BR-42 (pAP-B03)in the presence of bacteriophage BP-1 in shake flasks
2.6 在添加噬菌体BP-1 条件下的3-L 发酵罐发酵
为了进一步确证BR-42 (pAP-B03)对BP-1 的抗性,在3-L 发酵罐上分别对BR-42 (pAP-B03)和WSH-Z06 (pAP-B03)进行了分批补料培养,并在发酵初始时添加1% (v/v)、效价为1 ×1010PFU/mL 的BP-1 裂解液,结果见图4 和图5。发酵2 h 后,WSHZ06 (pAP-B03)DCW 逐渐下降;8 h 时菌体形态变为椭圆和圆形,长度只有正常时的1/4 左右,并伴有大量菌体裂解、致使形态模糊[图4(b)];14 h 时发酵液变澄清,显微镜下观察只有极少量的椭圆形菌体,菌体几乎完全被BP-1 裂解[图4(c)],被迫下罐;而BR-42 (pAP-B03)菌体生长和产L-Phe 能力几乎没有受到BP-1 的影响[图4(d)、(e)、(f)和图5(b)],最大DCW 为15.41 g/L,发酵52 h 时L-Phe 产量达到34.87 g/L,该水平与初始菌株WSH-Z06 (pAPB03)正常发酵时(35.38 g/L)[3]无显著差别。
2.7 WSH-Z06 (pAP-B03)对噬菌体的抗性机制
噬菌体对微生物细胞的侵染经历了吸附、DNA的注入、DNA 的复制和衣壳蛋白的装配以及成熟噬菌体的释放等4 个基本过程。抑制或阻止任一过程都可以使宿主菌具有抵御噬菌体的能力[9]。经检测,突变株WSH-Z06 对实验室保藏的其它λ 噬菌体同样不敏感,而且该菌株不能利用麦芽糖为碳源进行生长。据报道,麦芽糖转运蛋白LamB 是λ 噬菌体尾丝蛋白与宿主菌的外膜蛋白特异性结合的受体[10-11],由此可初步推断WSH-Z06 对噬菌体的抗性机制可能与麦芽糖转运蛋白LamB 的突变有关,即LamB 的失活阻止了噬菌体对宿主菌的吸附。分子水平和基因水平的噬菌体抗性机理还有待于进一步的研究。

图4 WSH-Z06 (pAP-B03)和BR-42 (pAP-B03)在添加BP-1 的条件下的菌体形态Fig.4 The cellular morphous of E. coli WSH-Z06 (pAP-B03)and BR-42 (pAP-B03)during the fermentation process in the presence of bacteriophage BP-1
3 结论
(1)利用双层平板法从WSH-Z06 (pAP-B03)生产L-Phe 的异常发酵液中分离、纯化到一株噬菌体BP-1,初步判断其属于长尾噬菌体科,λ 噬菌体属。
(2)采用NTG 诱变处理WSH-Z06,检测单菌落对BP-1 的敏感性和遗传稳定性,又经镜检、EMB 平板验证初筛出2 株抗噬菌体BP-1 的突变菌BR-42 和BR-130。将生产L-Phe 的质粒pAP-B03 转化到突变菌中,进行摇瓶发酵复筛,获得了菌体生长和L-Phe生产能力均无显著降低的BR-42 (pAP-B03)。
(3)向培养基中添加1% (v/v)、效价为1 ×1010PFU/mL 的BP-1 裂解液,BR-42 (pAP-B03)最大DCW 达到15.41 g/L,在52 h 时,L-Phe 产量达到34.87 g/L,该水平与WSH-Z06 (pAP-B03)正常发酵时无显著差别,说明BR-42 (pAP-B03)是1 株可以抗噬菌体BP-1 并能高产L-Phe 的优良菌株,可以代替WSH-Z06 (pAP-B03)应用于L-Phe 的工业生产中。

图5 添加BP-1 条件下的E. coli WSH-Z06 (pAP-B03)(a)和E. coli BR-42 (pAP-B03)(b)的发酵过程曲线Fig. 5 L-Phe production by E. coli WSH-Z06 (pAP-B03)(a)and E. coli BR-42 (pAP-B03)(b)in the presence of bacteriophage BP-1
(4)初步推断WSH-Z06 对噬菌体的抗性机制可能与麦芽糖转运蛋白LamB 的突变有关,即LamB 的失活阻止了噬菌体对宿主菌的吸附,该机制还有待于进一步的研究。
[1] 诸葛健,王正祥. 工业微生物实验技术手册[M]. 北京:中国轻工业出版社,1994:32.
[2] 李彦英,方宏清,陈惠鹏. 抗噬菌体工程菌的选育[J]. 生物技术通讯,2003,14(3):15 -18.
[3] Zhou H Y,Liao X Y,Wang T W,et al. EnhancedL-phenylalanine biosynthesis by co-expression ofpheAfbrandaroFwt[J]. Bioresour Technol,2010,101(11):4 151-4 156.
[4] Romig W R,Brodetsky A M. Isolation and preliminary characterization of bacteriophages forBacillus subtilis[J].J Bacteriol,1961,82(1):135 -141.
[5] 蒋如璋,于利民,侯炳炎,等. 短小芽孢杆菌1037 抗温和性噬菌体菌株的筛选及投产[J]. 遗传,1980,2(1):21 -24.
[6] Albert M J,Bhuiyan N A,Rahman A,et al. Phage specific forVibrio choleraeO139 Bengal[J]. J Clin Microbiol,1996,34(7):1 843 -1 845.
[7] 杨水云,郭春林,赵文明. 理化因素对苏云金芽孢杆菌噬菌体活性影响的研究[J]. 陕西师范大学学报(自然科学版),1998,26(4):225 -228.
[8] Sambrook J,Russell D W. Molecular Cloning:A Laboratory Manual (Third ed)[M]. New York:Cold Spring Harbor Laboratory Press,2001:26 -99.
[9] Coakley M,Fitzgerald G F,Ross R P. Application and evaluation of the phase resistance-and bacteriocin-encoding plasmid pMRC01 for the improvement of dairy starter cultures[J]. Appl Environ Microbiol,1997,63(4):1 434-1 440.
[10] Esquinas-Rychen M,Erni B. Facilitation of bacteriophage lambda DNA injection by inner membrane proteins of the bacterial phosphoenol-pyruvate:carbohydrate phosphotransferase system (PTS)[J]. J Mol Microbiol Biotechnol,2001,3(3):361 -370.
[11] 张利军,熊洪燕. 噬菌体宿主特异性变化的分子机制研究[J]. 第三军医大学学报,2004,26(4):356 -358.
