乳酸菌LA4 还原亚硒酸钠形成红色单质硒
2013-10-30刘红芳邓泽元徐靓陈华蓉刘文群
刘红芳,邓泽元,徐靓,陈华蓉,刘文群
1(南昌大学食品科学与技术国家重点实验室,江西 南昌,330047)
2(江西省环境信息中心,江西 南昌,330077)
硒(Selenium,Se)是人体必需的重要微量元素之一,低浓度时具有提高免疫、抗氧化、抗病毒、抗癌等生物活性,但在高浓度时反而对人和动物具有毒性,硒在生物活性和毒性之间范围极端狭窄,因此容易接近或进入了硒的毒性范围[1]。与无机硒和有机硒相比,纳米硒具有较强的高效高安全优势,纳米硒(Nano-Se)是采用纳米技术,利用蛋白质的酰胺平面对红色元素硒有吸引作用的原理,控制红色元素硒形成以蛋白质为核、以红色元素硒为膜和以蛋白质为分散剂的纳米粒子,将零价硒制成红色纳米颗粒。研究发现,在体外以蛋白质为分散剂合成的红色纳米硒具有低毒高效性[2]。这种利用纳米技术合成红色纳米硒是一种模拟生物红硒化作用的方法。一些对无机硒耐受性强的微生物,能够将6 价和4 价硒转化为红色零价硒。国外在利用微生物进行硒的还原方面研究的较多,已经从最初的菌株的筛选发展到现在对还原机理的探究,而我国在这方面研究较少,目前报道的只有利用假单胞菌(Pseudomonas alcaliphilaMBR)[3-4]、固氮红细菌(Rhodoacter azotoformans)[5]、棒状菌属(Corynebacterium spp)[6]、芽孢杆菌HBS4(BacillusHBS4)[7]来形成纳米尺寸的红色单质元素硒;但是国外研究学者还发现根瘤菌(Rhizobiumsp. Strain B1)[8]、大肠杆菌(Escherichia coli)[9]、嗜麦芽寡养单胞菌(stenotrophomonas maltophilia)[10]、Tetrathiobacter kashmirensis[11]等微生物能将亚硒酸盐或者硒酸盐还原成红色纳米单质硒。生物体形成的是纳米尺度、胶体状态红色元素硒,这种纳米红色元素硒对热稳定,不转化形成灰或黑色元素硒。
本实验利用对亚硒酸钠有较强耐受性的一株编号LA4 乳酸菌株进行亚硒酸钠还原反应,研究分析亚硒酸钠对乳酸菌LA4 生长的影响,并通过X 射线光电子能谱仪(XPS)测试以及透射电镜分析(TEM)研究乳酸菌是否将亚硒酸钠还原为红色单质硒,为今后更经济、更迅速的合成高安全性纳米硒奠定了基础。
1 材料和方法
1.1 材料
1.1.1 菌种
本实验室保藏的乳酸菌。
1.1.2 培养基[12]
MRS 液体培养基:葡萄糖20 g(或10 g),蛋白胨10 g,牛肉膏10 g,酵母膏(或干粉)5 g,柠檬酸二胺2 g(或柠檬酸钠5 g),K2HPO42 g,乙酸钠5 g,MgSO4·7H2O 0.58 g(或0.2 g),MnSO4·4H2O 0.25 g(或0.05 g),吐温-80 1 mL,蒸馏水1 000 mL,pH6.2 ~6.4。
MRS 固体培养基:MRS 液体培养基添加1.5%琼脂。
1.1.3 主要设备
H-600 Electron Microscope,HITACHI;ESCALAB250 型X 射线光电子能谱仪,美国Thermo;752N紫外-可见分光光度计,上海精科;SF2000 三按键电子数显卡尺,Guang Lu;飞鸽KA-1000 型离心机,电热恒温水浴锅,上海医疗器械三厂;电热恒温培养箱,上海跃进医疗器械厂。
1.2 方法
1.2.1 菌株筛选
参照文献[13]方法筛选抗高浓度亚硒酸钠菌株。在装有100 mL MRS 液体培养基的三角瓶中加入灭菌的亚硒酸钠,使终浓度为6 mmol/L(103.92 mg/L)。再接入已活化的乳酸菌,在37℃、150 r/ min振荡培养48 h,菌体活力能够通过发酵培养基所形成的红色深浅程度来判断,同时利用分光光度法测其亚硒酸钠还原率。然后将还原率较高的培养菌悬液在含6 mmol/L(103.92 mg/L)亚硒酸钠的琼脂平板上再划线培养,挑取红色单菌落继续在液体培养基中培养,通过发酵培养基形成的红色深浅程度和亚硒酸钠还原量来判断,再次将培养菌悬液在平板上划线培养挑取单菌落。这个步骤重复3 次以保证获得纯化的菌株。
1.2.2 亚硒酸钠含量的测定
参照文献[14]分光光度法测定培养液亚硒酸钠含量。
1.2.3 亚硒酸钠对乳酸菌LA4 生长的影响
(1)将乳酸菌划线培养在含不同浓度的亚硒酸钠琼脂平板上,37℃恒温培养5 d,观察不同浓度的亚硒酸钠对菌落大小的影响。
(2)对生长曲线的影响:分别对含不同浓度的亚硒酸钠发酵液每3 h 取1 次样,测其OD值。采用紫外可见光分光光度计在600 nm 测定菌液的OD值。
1.2.4 红色纳米硒的合成
在装有100 mL MRS 液体培养基中加入所需浓度经紫外灭菌的亚硒酸钠,之后接入已活化的乳酸菌,在37℃、150 r/ min 振荡培养48 h。
1.2.5 X 射线光电子能谱( XPS)
利用高速台式离心机在25℃、10 000 r/min 的情况下对发酵液进行离心,得到沉淀物,室温自然风干后,利用XPS 对其进行成分测定。
1.2.6 透射电子显微镜分析样品制备[5]
发酵液经10 000 r/min 离心10 min 收集菌体,所得菌体再用无菌生理盐水洗涤3 次,用毛细管吸取菌悬液滴在铜网上,室温干燥后进行透射电子显微镜观察。
2 结果与分析
2.1 高浓度亚硒酸钠还原菌株的筛选
本实验筛选得到了5 株还原率较高的菌株,从中挑选了1 株在103.92 mg(6 mmol/L)亚硒酸钠浓度下,通过分光光度法测其亚硒酸钠还原量为35.01 mg(2.02 mmol/L),还原效率为33.69%,同时在69.28 mg(4 mmol/L)亚硒酸钠浓度下,亚硒酸钠还原量为32.42 mg (1.87 mmol/L),还原效率为46.79%的菌株进行接下来的试验,编号为LA4。

图1 LA4 菌株在含6mmol/L 亚硒酸钠琼脂平板上形成的红色菌落Fig.1 Red-colored colonies of Lactobacillus LA4 on agar plates that containing 6mmol/L Na2SeO3
2.2 亚硒酸钠对乳酸菌LA4 生长的影响
将乳酸菌LA4 划线培养在含不同浓度的亚硒酸钠琼脂平板上,37℃恒温培养5 d,观察不同浓度的亚硒酸钠对菌落大小的影响。从图2 可以看出亚硒酸钠浓度就算达到32 mmol/L 也不能完全抑制乳酸菌LA4 的生长,从而表明乳酸菌LA4 对高浓度亚硒酸钠具有较强的耐受性。
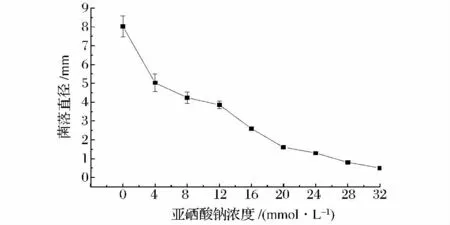
图2 亚硒酸钠对乳酸菌LA4 菌落大小的影响Fig.2 Effect of selenite on the growth (colony size)of Lactobacillus LA4
分别对含不同浓度的亚硒酸钠发酵液每3 h 取一次样,在600 nm 测定菌液的OD值,研究亚硒酸钠对乳酸菌LA4 生长曲线的影响。从图3 可以看出,乳酸菌LA4 在未添加亚硒酸钠发酵培养基中,9 h 之后就进入对数生长期,24 h 达到稳定期;然而乳酸菌LA4 在与亚硒酸钠作用过程中,都需要经过24 h 的延缓期才进入对数生长期,39 h 达到稳定期,但稳定期明显缩短,提前进入衰亡期。由此可推论得到,随着硒的添加,细菌的生长得到抑制。从图3 还可以看出,随着硒浓度的增大,硒对细菌生长的抑制增强,但细菌对各组溶液的适应时间几乎一致。添加1 mmol/L 亚硒酸钠的发酵液最终OD值最大,2 mmol/L 亚硒酸钠组次之,4 mmol/L 亚硒酸钠组最终OD值最小。由此可见,发酵液最终OD值是随着硒添加浓度的增加而相应减小。
2.3 透射电镜分析(TEM)
透射电子显微镜观察发现,生长在不含Na2SeO3培养基的乳酸菌LA4 长约4 μm,直径0.92 μm,培养基和细菌表面并没有球状颗粒(图4A)。从图4B 和4C 可以看出,含2 mmol/L Na2SeO3和4 mmol/L Na2SeO3的样品中都出现纳米尺寸的球状颗粒,颗粒粒径基本在50 ~200 nm,也有少数颗粒粒径比较大,在200 ~350 nm;相比4 mmol/L Na2SeO3,含2 mmol/L Na2SeO3样品中的球状颗粒更丰富些。这些球状颗粒不仅随机分布在细胞表面,而且还随机分布在培养基中。图4D 显示4 mmol/L Na2SeO3样品室温放置4 周后,样品中的球状颗粒依然是纳米尺寸的,并且肉眼观察到样品依然呈红色,这表明形成的红色球状颗粒非常稳定,不容易发生转变。这些球状颗粒很可能就是乳酸菌LA4 将亚硒酸钠转化形成的纳米单质硒颗粒。

图3 乳酸菌LA4 在含不同浓度亚硒酸钠培养基中的生长曲线(600 nm 处的OD 值变化)Fig.3 The growth curve of Lactobacillus LA4 in culture medium with different concentrations of sodium selenite(OD at 600 nm)

图4 生长在MRS 液体培养基中乳酸菌LA4 的整体细胞透射电镜图(工作电压:75 kV)Fig.4 Transmission electron micrographs of whole mounts of cells of Lactobacillus LA4 from a stationary phase culture grown in MRS medium containing
2.4 X 射线光电子能谱仪(XPS)测试结果
对上述培养基中含4 mmol/L Na2SeO3的样品(离心所得的沉淀需自然风干)进行了XPS 光谱测试分析,结果如图5 参照文献[15]以及John 等[16]编写的X 射线光谱分析手册分析XPS 光谱图结果,根据图谱中Se 的3d 峰位(3d 峰是Se 的峰值中最高的峰)55.6 ev 断定样品中含有零价单质硒,另外,还可以推断样品中存在其他价态硒(图5B)。由此表明乳酸菌LA4 已经部分将亚硒酸钠还原为红色的单质硒沉淀,但并没有完全还原,与上述2.1 中分光光度法测定此4mM 样品的亚硒酸钠还原效率(46.79%)结果一致。

图5 沉淀物的XPS 图谱Fig.5 X-ray photoelectron spectroscopy analysis(XPS)of precipitate
3 讨论
实验表明,乳酸菌LA4 对高浓度的亚硒酸钠具有一定耐受性,经分光光度法测定得知在4 mmol/L亚硒酸钠浓度下,亚硒酸钠的还原量为1.87 mmol/L,还原效率为46.79%。并将其亚硒酸钠还原产物通过X 射线光电子能谱仪(XPS)测试,发现乳酸菌LA4 能将亚硒酸钠还原为红色单质硒。观察透射电镜(TEM)测试图,发现添加亚硒酸钠的发酵液中,细胞表面以及培养基中都出现大量纳米尺寸的球状颗粒,粒径基本在50 -200 nm 之间,从而表明乳酸菌LA4 很有可能将亚硒酸钠转化成纳米尺寸的红色单质硒。大量研究表明,纳米硒粒径在200 nm 以内才具有生物学效应[17]。与Péter Eszenyi 等[18]利用乳酸菌合成的100 ~500 nm 粒径的纳米硒颗粒相比,本实验利用乳酸菌LA4 很有可能转化合成了粒径更小的球状颗粒。电镜测试结果表明此样品室温放置4 周后,样品中的球状颗粒依然是纳米尺寸的,并且肉眼观察到样品依然呈红色。这表明形成的红色球状颗粒非常稳定,不容易发生转变。
纳米级红色单质硒具有毒性小,生物活性高,能够充分被人体吸收等优点,因此人们已经开始着手用纳米硒替代毒性较大的亚硒酸盐[19]。本研究筛选得到耐高浓度亚硒酸钠的乳酸菌LA4(在含32 mmol/L亚硒酸钠的琼脂平板上依然形成直径约0.5 mm 的菌落),利用该菌株可以还原环境中的亚硒酸盐得到活性单质硒。虽然乳酸菌还原亚硒酸钠形成红色纳米单质硒的机制比较复杂,但操作较为简便,易于扩大化,因此在工业上具有良好的应用前景。
[1] Fordyce,F.M.,Selenium deficiency and toxicity in the environment[M]. The Amsterdam:Essentials of Medical Geology:Elsevier Academic Press,2005:373 -416.
[2] 孔涛,郝雪琴,赵振升,等. 纳米硒的生物学功能及应用[J]. 饲料研究,2011(9):38 -42.
[3] 蒋华东,何晓红,张礼霞,等. 一株假单胞菌(Pseudomonas alcaliphilaMBR)好氧还原亚硒酸钠为红色单质硒[J]. 微生物学报,2010,50(10):1 347 -1 352.
[4] 李子超,肖娜,李昀锴,等. 沼泽红假单胞菌对亚硒酸盐还原脱毒的研究[J]. 微生物学通报,2011,38(5):660-667.
[5] 王东亮,肖敏,钱卫,等. 还原亚硒酸盐产生红色单质硒光合细菌菌株的筛选与鉴定[J]. 微生物学报,2007,47(1):44 -47.
[6] 王明义,梁小兵,朱建明,等.2 株具有亚硒酸盐还原能力细菌的筛选和鉴定[J]. 环境与健康杂志,2006,23(1):31 -32.
[7] 李瑞萍,鲁安怀,郝瑞霞,等. 芽孢杆菌HBS4 还原亚硒酸钠为单质硒的实验研究[J]. 岩石矿物学杂志,2005,24(06):598 -602.
[8] William J,Hunter L,David Kuykendall,et al. Reduction of Selenite to Elemental Red Selenium byRhizobiumsp.Strain B1[J]. Curr Microbiol,2007,55:344 -349.
[9] Roux M,Sarret G,Pignot,Paintrandl,et al. Mobilization 0f selenite byRalstonla meiduransCH34. Applied and Environmental Microbiology,2001,67 (2):69 -773.
[10] Robert S Dungan,Scott R Yates,William T Frankenberger,Jr. Transformations of selenate and selenite byStenotrophomonas maltophiliaisolated from a seleniferous agricultural drainage pond sedimentt[J]. Environmental Microbiology,2003,5 (4):287 -295.
[11] William J,Hunter·Daniel K,Manter. Bio-reduction of selenite to elemental red selenium byTetrathiobacter kashmirensis[J]. Current Microbiology,2008,57:83 -88.
[12] 刘慧,张红星,张海予,等. 现代食品微生物学实验技术[M]. 北京:中国轻工业出版社,2009:262 -265.
[13] Mini Bajaj,Susan Schmidt,Josef Winter,et al. Formation of Se (0)Nanoparticles byDuganellasp. andAgrobacteriumsp. isolated from Se-laden soil of North-East Punjab,India[J]. Microbial Cell Factories,2012,11:64.
[14] 贺立东. 分光光度法测定富硒酵母中有机硒的含量[J]. 食品工业科技,2000,5(21):67 -68.
[15] 刘芬,赵志娟,邱丽美,等.XPS 光电子峰和俄歇电子峰峰位表[J]. 分析测试技术与仪器,2009,15(1):1 -17.
[16] John F,Moulder,William F,et al. Handbook of X-ray Photoelectron Spectroscopy[M]. The American:Physical Electronics,1992.
[17] 王华丽. 纳米硒的生物利用和毒性研究[D]. 合肥:中国科学技术大学博士学位论文,2007.
[18] Péter Eszenyi,Attila Sztrik,Beáta Babka,et al. Elemental,nano-sized (100 -500 nm)selenium production by probiotic lactic acid bacteria[J]. International Journal of Bioscience,Biochemistry and Bioinformatics,2011,1(2):148 -152.
[19] 王钟翊,李前勇,张德志,等. 纳米硒的研究进展和应用前景[J]. 四川畜牧兽医,2009(01):18 -19.
