棕色田鼠睾丸和附睾胚后发育中的雌二醇表达
2013-10-29王慧春王建礼邰发道
王慧春, 王建礼, 邰发道*
(1陕西师范大学 生命科学学院,陕西 西安710062;2北方民族大学 生命科学与工程学院,宁夏 银川750021)
对雌激素(estrogen)及其受体的大量研究表明,雌激素与雄激素(androgen)一样是雄性生殖所必需的.幼年雄性动物缺失雌激素会直接影响成年后的生殖能力,雌、雄激素通过受体发挥协调作用共同促进雄性生殖[1].雌二醇(estradiol,E2)作为睾丸生精细胞存活的保护因子,比雄激素更有效,而且直接影响精子发生,抑制生精细胞的凋亡[2].啮齿动物睾丸中生殖干细胞的数量和精子的成熟受到雌激素调控[3-4].给予高剂量的植物雌激素大豆黄酮能够延搁大鼠睾丸的生长和发育,并诱导青春期大鼠睾丸组织结构改变[5].产后1d的大鼠幼仔每日给予1μg的17-β-雌二醇后,观察产后3d、5d、8d、10d和16d的生殖母细胞分化,发现外源性雌激素会改变生殖母细胞向生精小管基层的迁移,可减少细胞增生和增加程序性死亡,而生殖母细胞的迁移和其后的增生对于生殖细胞的存活是必需的[6].Pelletier等利用免疫组化和原位杂交研究表明,大鼠的次级精母细胞和精子细胞有雌激素α受体(ERα)和ERαmRNA表达[7].ERα在偶线期和早粗线期的初级精母细胞及早期的长形精子细胞中表达强烈[2].对ERα基因敲除(ErαKO)的雄性小鼠研究证实,雌激素还可以通过影响睾丸输出小管的形态结构和输出小管的重吸收功能来间接影响睾丸的发育和精子发生[8-10].这些实验说明雌激素可以从多方面影响睾丸的发育和精子发生.但在胚后不同发育阶段的睾丸中,内源性雌激素在各级生精细胞的表达及对精子发生的调控还不清楚.棕色田鼠(Microtus mandarinus)主要生活于农田果园,营半地下生活,对农作物及果树造成很大危害.此前,我们曾对棕色田鼠胚后发育的睾丸和附睾内ERα和雄激素受体(AR)的分布和表达进行了研究[11-12],为了进一步探讨雌激素在胚后发育中精子发生、发育中的调控作用,并为从激素角度控制害鼠提供依据,我们对从出生到成体不同发育阶段的棕色田鼠睾丸和附睾组织内的E2表达进行了研究.
1 材料与方法
1.1 动物取材与切片制备
棕色田鼠捕自河南省灵宝市农作区(东经111°21′,北纬34°41′,海拔650m).不同洞群捕捉的雌、雄鼠进行配对.塑料饲养笼(0.4m×0.28m×0.15 m)饲养,木屑做垫料,棉花做巢材,以兔饲料搭配胡萝卜、麦芽为食.室温23±1℃,光照周期12L:12D(光周期:07:00—19:00),食物、饮水充足.实验鼠分别为产后1日龄、10日龄、25日龄、45日龄和60日龄(成体)的雄性鼠,每组6只.幼仔日龄以分娩当日为0日计算.称重后用4mg/mL戊巴比妥钠麻醉(1mg/100g体重),4%的多聚甲醛灌流固定后,摘取睾丸及附睾,固定于改良的Bouins液.脱水、透明,常规石蜡切片,制成6μm的连续切片,切片裱于覆有多聚赖氨酸的载玻片上,恒温箱烤干.
1.2 免疫组织化学染色
切片脱蜡复水后,用1%甲醇-过氧化氢液孵育30min以封闭内源性过氧化物酶.然后进行热修复抗原,SABC试剂盒(武汉博士德生物工程公司)中的抗原修复液在室温条件下修复抗原10min,经山羊血清于37℃孵育30min后,加入E2兔抗多克隆抗体(1∶1 500稀释,美国Sigma公司)置于4℃冰箱过夜,再加入生物素化羊抗兔IgG,室温孵育2h,最后加入试剂盒中的SABC孵育1h,经DAB(武汉博士德生物工程公司)显色,蒸馏水充分冲洗终止反应.以上各步骤间均用0.01mol/L的PBS冲洗3次,每次5min.然后按常规脱水、透明、中性树胶封片,光镜观察并照像.阴性对照组用0.01mol/L的PBS替代一抗进行免疫细胞化学染色,其他步骤同实验组.
1.3 图像及数据分析
用Qwin V3图像分析系统(Lecia)对免疫组织化学结果进行灰度值测试.每只实验动物选取3张切片,每张切片测试10个阳性细胞的灰度值.3张切片阳性细胞的平均灰度值作为每只动物原始数据,然后进行组间比较.测量的灰度值越小,阳性反应越强.数据采用SPSS for windows 10.0软件进行处理,通过t检验和One-way Anova进行数据分析,在P<0.05时,选择Post-Hoc检验中LSD法进行多重比较.结果以平均值±标准误表示(Mean±SE).
2 实验结果
1日龄,睾丸生精小管内生殖母细胞有E2阳性反应.10日龄,生殖母细胞阳性反应减弱(P<0.05).25日龄E2阳性表达主要见于精子细胞;45日龄,精子细胞和精母细胞中有E2的表达.成体生精小管中精原细胞、精母细胞、精子细胞和精子中均有E2表达,精母细胞和精子细胞表达较强,精原细胞表达较弱.1日龄和10日龄的间质区细胞E2表达最强,25日龄和45日龄表达明显减弱,成体间质细胞E2表达最弱(P<0.05)(图1,表1).
1日龄至45日龄,E2的表达主要集中在附睾上皮细胞和连接组织,25日龄E2表达微弱.成体,E2除在上皮细胞和连接组织表达外,附睾管中的大量精子表达明显(图2).

图1 不同日龄棕色田鼠睾丸内雌二醇的表达Fig.1 Estradiol expression in testes of mandarin voles(Microtus mandarinus)with different age

表1 棕色田鼠胚后发育中睾丸生精细胞和间质细胞的E2表达(Mean±SE)Tab.1 Immunohistochemistry expression of estradiol in spermatogenic cells and leydig cells of mandarin voles testes during postnatal development(Mean±SE)
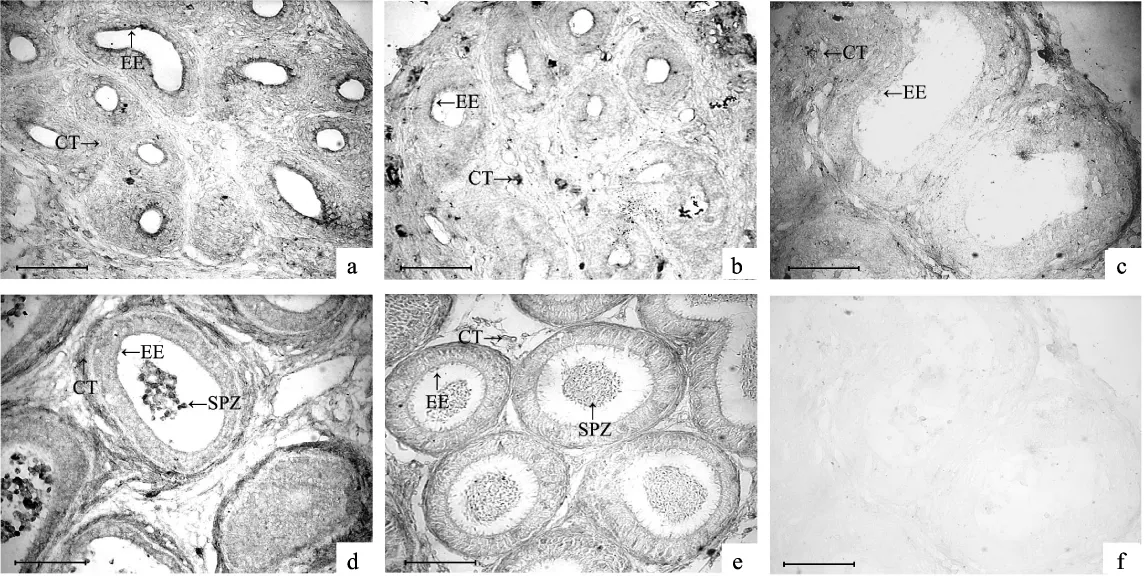
图2 不同日龄棕色田鼠附睾内雌二醇的表达Fig.2 Estradiol expression in epididymides of mandarin voles(Microtus mandarinus)with different age
3 讨论
RT-PCR技术研究表明,大鼠的间质细胞、支持细胞、精母细胞、精子细胞和精子中有细胞色素P450芳香化酶mRNA表达[13],表明睾丸内除体细胞外,生殖细胞也可以合成E2.本实验结果显示,在棕色田鼠胚后发育中,精原细胞、精母细胞、精子细胞及精子中均有E2表达,说明各级生精细胞均可能有E2生成.1日龄的雄性大鼠幼仔,生殖母细胞增生并且移向生精小管基层,这个过程有利于精子发生并且受到雌激素的调节[6].1日龄的棕色田鼠有E2阳性反应,说明雌激素对生殖母细胞的分化有调节作用.结合此前研究棕色田鼠胚后发育中生精细胞ERα的增龄变化[11],我们发现E2的表达与ERα的表达基本一致,推测E2可能通过ERα调控生精细胞的增殖分裂.ERαKO的成年雄性小鼠精子数目减少,形态异常,生殖能力下降,说明ERα介导的雌激素作用有利于精子发生[14].实验中25日龄和45日龄生精小管内精子细胞中有E2表达,一直持续到性成熟.说明棕色田鼠性成熟过程中,在精子发生的各阶段需要雌激素的调控.雌激素在精母细胞减数分裂和精子形成中具有直接的调控作用,而且雌激素具有防止未变态精子细胞凋亡、维持成熟精子功能的作用[15].因此,棕色田鼠睾丸胚后发育过程中,E2对生殖细胞的分化增殖有重要作用.
间质细胞除生成雄激素外,也是生成E2的主要来源细胞[16].在棕色田鼠胚后发育过程中,E2在间质细胞的表达也间接证明了这一点.结合对棕色田鼠生精细胞ERα的研究[11].可以推测ERα介导雌激素调节睾丸间质细胞的发育.与生精细胞不同,不同日龄间质细胞的E2和ERα的表达强度并不一致.这是由于受体具有精细的调节机制,受体随时与不断变化的配体及核膜微环境发生相互作用,并发生自适性地改变,致使受体的数量和反应性不断处于可塑性变换之中,可能上调也可能下调[17].ERα表达强度的变化反应了其对雌激素的反应性.而且,雌激素对间质细胞的分化作用依赖于间质细胞所处的阶段[18].大鼠出生后第5天注射E2后,到60日龄时睾丸中没有成熟的间质细胞,说明性成熟前间质细胞的发育受到E2的抑制.E2可以通过ERα介导抑制间质细胞的发育从而减少睾酮的分泌[19].ERα可以通过雌激素反映元件依赖式的机制和雌激素反映元件非依赖式的机制起作用,后者能影响间质细胞睾酮的生物合成[20].间质细胞产生的睾酮通过渗透作用进入生精小管,在支持细胞内由芳香化酶催化生成E2,E2在生精小管内扩散,作用于生精细胞从而调控生精过程[13].因此,E2通过抑制间质细胞睾酮的分泌,实现自反馈,从而精确地调节精子发生.
1日龄至成体的棕色田鼠附睾上皮细胞和连接组织均有E2表达,25日龄的E2表达微弱,成体附睾管中有大量精子,且有明显的E2表达.而且1日龄至成体附睾上皮细胞也有ERα表达[11].ERαKO的雄性小鼠生殖管道畸变,说明雌激素参与对生殖道上皮的形态构建[21].E2可能通过ERα的介导影响棕色田鼠附睾的发育,并且影响精子的成熟.
4 结论
棕色田鼠从出生至性成熟,睾丸内生精细胞和间质细胞均有不同程度的E2表达.一方面,间接说明这两类细胞是E2生成的重要位点;另一方面,E2在各级生精细胞及附睾上皮细胞的表达,说明生精细胞的分化增殖和精子的成熟都可能受其直接调控.E2也可以通过调控间质细胞的发育,调节精子发生.
[1]Oliveira C A,Mahecha G,Carnes K,et al.Differential hormonal regulation of estrogen receptors ERαand ERβ and androgen receptor expression in rat efferent ductules[J].Reproduction,2004,128(1):73-86.
[2]Pentikainen V,Erkkila K,Suomalainen L,et al.Estradiol acts as a germcell survival factor in the human testis in vitro[J].The Journal of Clinical Endocrinology &Metabolism,2000,85(5):2057-2067.
[3]Li H,Papadopoulos V,Vidic B,et al.Regulation of rat testis gonocyte proliferation by platelet-derived growth factor and estradiol:identification of signaling mechanisms involved[J].Endocrinology,1997,138:1 289-1 298.
[4]Shetty G,Krishnamurthy H,Krishnamurthy H N,et al.Effect of estrogen deprivation on the reproductive physiology of male and female primates[J].The Journal of Steroid Biochemistry and Molecular Biology,1997,61:157-166.
[5]蒋春霞,潘连军,冯耀,等.大豆黄酮对雄性大鼠生殖器官生长发育的影响[J].中华男科学杂志,2008,14(4):351-355.
[6]Vigueras-Villaseor R M,Moreno-Mendoza N A,Reyes-Torres G,et al.The effect of estrogen on testicular gonocyte maturation[J].Reproductive Toxicology,2006,22(3):513-520.
[7]Pelletier G,Labrie C,Labrie F.Localization of oestrogen receptorα,oestrogen receptorβand androgen receptors in the rat reproductive organs[J].Endocrinology,2000,165:359-370.
[8]Hess R A,Dunick D,Lee K H,et al.A role for oestrogen in the male reproductive system[J].Nature,1997,390:509-512.
[9]Hess R A.Oestrogen in fluid transport in efferent ducts of the male reproductive tract[J].Reviews of Reproduction,2000,5(2):84-92.
[10]Hess R A,Bunick D,Bahr J.Oestrogen,its receptors and function in the male reproductive tract:a review[J].Molecular and Cellular Endocrinology,2001,178(1/2):29-38.
[11]王慧春,邰发道,廉漪.棕色田鼠睾丸和附睾雌激素α受体表达的增龄变化[J].动物学研究,2005,26(4):435-441.
[12]王建礼,王慧春,邰发道.棕色田鼠睾丸和附睾雄激素受体表达的增龄变化[J].动物学研究,2009,30(1):53-58.
[13]Carreau S.Germ cells:a new source of estrogens in the male gonad[J].Molecular and Cellular Endocrinology.2001,178(1/2):65-72.
[14]Hess R A,Zhou Q L,Nie R L,et al.Estrogen and epididymal function.[J].Reporduction,Fertility and Development,2001,13(4):273-283.
[15]Robertson K M,O′Donnell L,Jones M E,et al.Impairment of spermatogenesis in mice lacking a functional aromatase(cyp19)gene[J].Proceedings of the National Academy of Sciences of the United States of A-merica,1999,96(14):7986-7991.
[16]Carreau S.Paracrine control of human Leydig cell and Sertoli cell functions.Paracrine control of human Leydig cell and Sertoli cell functions[J].Folia Histochemistry Cytobiology,1996,34:111-119.
[17]李国璋.神经生理学[M].北京:人民卫生出版社,2007:65-95.
[18]Mendis-Handagama S M,Ariyaratne H B.Differentiation of the adult Leydig cell population in the postnatal testis[J].Biology of Reproduction,2001,65(3):660-671.
[19]Abney T O.The potential roles of estrogens in regulating Leydig cell development and function:a review[J].Steroids,1999,64:610-617.
[20]Weiss J,Bernhardt M L,Laronda M M,et al.Estrogen actions in the male reproductive system involve estrogen response element-independent pathways[J].Endocrinology,2008,149(12):6 198-6 206.
[21]Nakai M,Bouma J,Nie R,et al.Morphological analysis of endocytosis in efferent ductules of estrogen receptor-αknockout male mouse[J].The Anatomical Record,2001,263:10-18.
