柿叶提取物对CCl4致小鼠急性肝损伤保护作用的研究
2013-10-29杨建雄
张 艳,杨建雄,马 蕊,王 芳
(陕西师范大学 生命科学学院,陕西 西安710062)
柿(Diospyros kakiL.f)为双子叶植物柿树科 柿树,柿叶为柿的新鲜或干燥叶片.黄酮类化合物是柿叶的主要有效成分[1],主要以苷类形式存在[2].已发现的黄酮类化合物有芦丁、黄芪苷(astraglin)、异槲皮素(isoquereitrin)、山奈酚(Kaempferol)等.目前对柿叶黄酮的研究主要集中在软化血管、降脂降压、抗氧化、止血等药理方面[3],而对其保肝作用尤其是对CCl4诱导的急性肝损伤保护作用的研究却较少.本研究探讨柿叶醇提物乙酸乙酯萃取制剂(EAF)对四氯化碳(CCl4)急性肝损伤的保护作用,为柿叶在保健食品中的进一步开发和利用提供依据.
1 材料和方法
1.1 试剂
ALT、AST、AKP、SOD、GPx、CAT、MDA试剂盒均由南京建成生物工程有限公司提供.化学试剂均为国产分析纯,EAF(黄酮含量为81.05%)溶液为自制.
1.2 动物
雄性昆明种小鼠,50只,体重(20±2)g,由西安交通大学实验动物研究中心提供.
1.3 方法
1.3.1 动物模型与药物处理 选择50只雄性昆明种小鼠,随机分组,每组10只,分别为正常组、模型组(CCl4)、EAF组(低剂量组50mg/kg、中剂量组100mg/kg、高剂量组200mg/kg).小鼠适应性喂养7d后,给药组采用灌胃给药,正常组和模型组给予等体积的生理盐水.每隔3d称一次体重,根据体重调整给药体积.连续7d后,除正常对照以外,其余各组于末次给药3h后按20mg/kg剂量腹腔注射2%CCl4花生油[4],正常组注射等体积的花生油,禁食不禁水.24h后眼眶采血,分离血清待用.取血后每只小鼠立即剖腹,取相同部位的一小块肝组织,用10%的福尔马林溶液固定,同时用生理盐水制备成10%的肝匀浆,离心,上清液4℃下保存备用.
1.3.2 肝功能生化检测 血清ALT、AST和AKP活性按试剂盒说明测定.
1.3.3 肝组织生化测定 肝匀浆SOD、GPx、CAT活性及MDA含量按试剂盒说明测定.
1.3.4 肝脏组织病理学检查 肝组织切片经HE染色,光镜下观察肝细胞损伤程度.
1.3.5 数据处理 用SPSS14.0统计软件进行数据处理,结果以±s表示,组间均数比较采用方差分析.
2 结果与讨论
2.1 对小鼠血清ALT、AST和AKP的影响
如表1所示,模型组血清中ALT、AST、AKP的含量明显高于正常组(P<0.01),与CCl4模型组比较,EAF不同给药组均能显著降低ALT、AST、AKP活性,其中以中剂量组效果最为显著.CCl4进入体内后,经肝微粒体细胞色素P450酶激活,生成三氯甲基自由基(CCl3·),CCl3·可进一步与氧反应,形成具有更强反应活性的CC13O2·,这些自由基与肝细胞内大分子发生共价结合,也可攻击肝细胞膜不饱和脂肪酸发生脂质过氧化,引起膜结构和功能完整性的破坏,导致肝细胞肿胀坏死.肝脏内ALT以及AST外流,EAF不同剂量给药组均能显著降低ALT、AST、AKP活性.表明EAF可能通过清除自由基[5],稳定肝细胞膜正常结构,加强组织修复,抑制脂质过氧化而减轻肝细胞损害.
表1 EAF对小鼠血清ALT、AST及AKP活力的影响Tab.1 Effects of EAF on serum ALT,AST and AKP in carbon tetrachloride intoxicated mice U/L,±s,n=10

表1 EAF对小鼠血清ALT、AST及AKP活力的影响Tab.1 Effects of EAF on serum ALT,AST and AKP in carbon tetrachloride intoxicated mice U/L,±s,n=10
注:与正常组比较**P<0.01,*P<0.05;与模型组比较##P<0.01,#P<0.05.
组别ALT AST AKP模型组144.8±10.1**98.68±3.41**427.1±36.80**正常组4.82±2.27 46.97±1.86 157.8±20.09低剂量(50mg/kg)+CCl4109.3±18.1#69.16±1.46##281.9±29.40##中剂量(100mg/kg)+CCl489.02±21.3##65.81±6.09##250.2±24.66##高剂量(200mg/kg)+CCl4126.2±5.93#72.90±4.41#293.1±30.09#
2.2 对小鼠肝组织SOD、GPx、CAT活性及MDA含量的影响
如表2所示,与正常组比较,CCl4显著降低了模型组小鼠肝匀浆SOD、CAT(P<0.01)及GPx活性(P<0.05),同时MDA含量显著升高(P<0.05).与模型组比较,EAF对这些变化都有不同程度的抑制作用.其中低、中剂量与模型组比较差异均有显著性(P<0.01或P<0.05),而高剂量组SOD、CAT、GPx活性有所增强,MDA含量有所降低,但没有统计学意义(P>0.05).
表2 EAF对小鼠肝匀浆SOD、GPx、CAT活性及MDA含量的影响Tab.2 Effects of EAF on MDA,SOD,GPx,and CAT in liver homogenate of in carbon tetrachloride intoxicated mice ±s,n=10
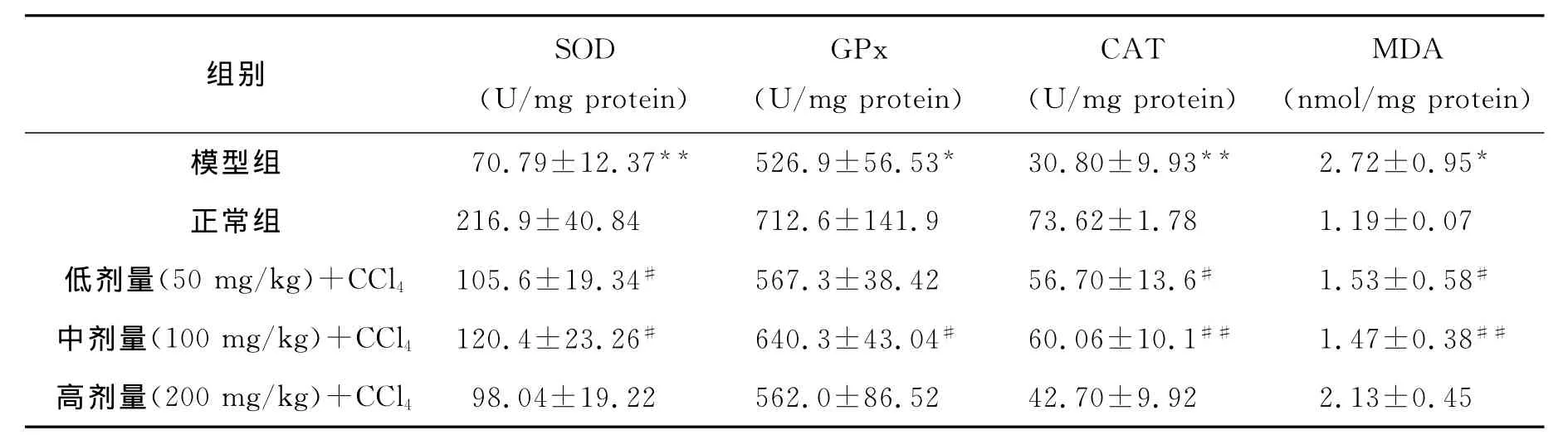
表2 EAF对小鼠肝匀浆SOD、GPx、CAT活性及MDA含量的影响Tab.2 Effects of EAF on MDA,SOD,GPx,and CAT in liver homogenate of in carbon tetrachloride intoxicated mice ±s,n=10
注:与正常组比较**P<0.01,*P<0.05;与模型组比较##P<0.01,#P<0.05.
组别SOD(U/mg protein)GPx(U/mg protein)CAT(U/mg protein)MDA(nmol/mg protein)模型组70.79±12.37**526.9±56.53*30.80±9.93**2.72±0.95*正常组216.9±40.84 712.6±141.9 73.62±1.78 1.19±0.07低剂量(50mg/kg)+CCl4105.6±19.34#567.3±38.42 56.70±13.6#1.53±0.58#中剂量(100mg/kg)+CCl4120.4±23.26#640.3±43.04#60.06±10.1##1.47±0.38##高剂量(200mg/kg)+CCl498.04±19.22 562.0±86.52 42.70±9.92 2.13±0.45
SOD是细胞内主要的防御性抗氧化酶,减少自由基的产生,减轻肝细胞的损伤.MDA能进入膜脂的水相,和膜蛋白、膜磷脂上的—NH2交联形成schiff碱,使细胞膜流动性降低,通透性增加,从而导致膜的功能损伤或丧失[6].GPx可以催化GSH与各种内源性和外源性亲电子化合物反应,生成无毒性或毒性小的GSH硫结合物.CAT既能有效及时地消除体内细胞代谢产生的毒性物质过氧化氢,又可充当血红蛋白和其他含巯基蛋白的保护剂.这一系列抗氧化酶及脂质过氧化产物的相应变化反映了EAF具有强的清除自由基的能力,其主要成分黄酮类化合物含有的羟基具有很强的供氢能力,可以通过释放羟基上活泼H原子,使其与R·或ROO·结合,向活泼自由基提供H后,可与其他自由基结合成稳定的二聚体,而切断自由基的链式反应,发挥抗氧化作用[7].
2.3 EAF对小鼠肝组织病理学的影响
病理切片结果见图1.光镜所见正常组小鼠肝小叶结构正常、清晰,细胞排列整齐,大小均匀,细胞核位于细胞中央,圆而边界清.模型组小鼠肝细胞明显水肿、气球样变,肝索排列紊乱,肝细胞解离,肝小叶内点状坏死,中央静脉和汇管区出现弥漫性的炎

图1 EAF对急性肝损伤小鼠肝组织病理改变的影响(HE×400)Fig.1 The histopathological analysis for effect of EAF on acute liver injure in mice(HE,×400)
细胞浸润.低、高剂量组肝细胞仍出现部分空 泡、变性,较模型组有所改善,但效果不明显.中剂量组细胞核结构清晰,体积正常,水肿、坏死、气球样变、炎细胞浸润程度明显减轻,较模型组有显著改善.
结果表明,中剂量(100mg/kg)的柿叶黄酮有较好的保肝效果,而200mg/kg的剂量对肝细胞氧化损伤的保护作用减弱,这一结果与生化测定所得结果一致,也与文献[8-9]报道的较高剂量的酚酸类物质对肝细胞有损害作用的结论一致.
3 结论
EAF对CCl4致小鼠急性肝损伤有一定的保护作用,100mg/kg的EAF效果较好.其机理可能与降低脂质过氧化反应,清除自由基,保护肝细胞膜,维持膜的正常通透性等有关.这一结果表明,废弃的柿叶可以用来制备对肝脏有一定保护作用的EAF.
[1]Mallavadhani U V,Panda A K,Rao Y R.Pharmocology and chemotaxonomy of diospyros[J].Phytochemistry,1998,49(4):901-951.
[2]郭玫,董晓萍.柿叶的研究概况[J].重庆中草药研究,1999(40):164-166.
[3]林娇芬,林河通,谢联辉.柿叶的化学成分、药理作用、临床应用及开发利用[J].食品与发酵工业,2005,31(7):90-96.
[4]Lee K J,Jeong H G.Protective effect of platycodi radix on carbontetrachloride-induced hepatotoxicity[J].Food and Chemical Toxicology,2002,40:517-525.
[5]Han J,Kang S,Choue R,et al.Free radical scavenging effect of diospyros kaki,Laminaria japonica and Undaria pinnatifida[J].Fitoterapia,2002,73(7/8):710-2.
[6]林志椿,聂松青.细胞膜的流动性[J].生理科学进展,1998,18(1):83-89.
[7]Mitchell J H,Gaxdex P T,McPhail D B.Antioxidant efficacy of phytoestxogens in chemical and biological model systems[J].Archives of Biochemistry and Biophysics,1998,36(1):142-148.
[8]Joshua D L,Mary J K,Shengmin S,et al.Hepatotoxicity of high oral dose(-)-epigallocatechin-3-gallate in mice[J].Food and Chemical Toxicology,2010,48:409-416.
[9]Giuseppe G,Alison L,Amira M S,et al.Cellular and in vivo hepatotoxicity caused by green tea phenolic acids and catechins[J].Free Radical Biology &Medicine,2006,40:570-580.
