结缔组织生长因子基因RNA干扰复制缺陷型腺病毒载体的构建及鉴定
2013-10-29郝春秋彭梅娟谢玉梅周云魏欣马力王素娜李瑞娟张岩白雪帆贾战生
郝春秋,彭梅娟,谢玉梅,周云,魏欣,马力,王素娜,李瑞娟,张岩,白雪帆,贾战生
第四军医大学 唐都医院感染病诊疗中心,陕西 西安 710038
腺病毒具有宿主范围广、感染率高、包装容量大、繁殖滴度高、安全性好、性质稳定、载体制备较容易等特点[1],已成为应用最广泛的载体系统之一。结缔组织生长因子(connective tissue growth factor,CTGF)是重要的促组织纤维化蛋白,与肝、肺、肾等许多器官的纤维化密切相关[2],是促进胶原沉积致肝纤维化的主要细胞因子。RNA干扰(RNA interfer⁃ence,RNAi)可以在转录后水平阻断基因表达,使靶基因沉默,是研究特定基因功能的可靠技术[3]。我们试图利用RNAi原理,构建能介导CTGF基因沉默的复制缺陷型腺病毒载体,为肝纤维化的防治提供一个有用的工具。
1 材料和方法
1.1 材料
腺病毒载体系统(穿梭质粒pShuttle-H1、骨架质粒pAdEasy-1及包装细胞AD-293)由德国学者Reske教授惠赠;大鼠肝星状细胞系HSC-T6购自ATCC;大肠杆菌BJ-5183和DH5α由本实验室保存。
限制性内切酶、T4DNA连接酶、Taq DNA聚合酶、dNTP、PCR产物回收试剂盒及Plasmid Purifica⁃tion Kit均为Promega公司产品;脂质体Lipo⁃fectAMINE2000、DMEM、RPMI1640及胎牛血清均为Gibco公司产品;抗CTGF单克隆抗体、抗β-actin抗体购自Abcam公司;山羊抗鼠IgG-HRP抗体购自Santa Cruz公司。
1.2 靶向CTGF短发夹RNA的设计
根据小干扰 RNA(siRNA)设计原则[4-5],参考GenBank公布的大鼠 CTGF(NM-022266)核苷酸序列,利用Ambion公司在线(http://www.ambion.com)设计工具,设计4对针对CTGF基因的siRNA序列(TS1~TS4)和1对无关阴性对照序列(TS5),并进行BLAST同源性分析,保证序列的惟一性。为方便克隆与鉴定,在其5'和3'端分别引入BglⅡ和HindⅢ酶切位点,反义片段以后接终止信号TTTTTT以终止转录,形成BglⅡ酶切位点+19nt正义靶序列+9nt loop接头序列+19nt反义靶序列+终止信号+HindⅢ酶切位点的结构(寡核苷酸由上海吉凯基因技术有限公司合成)。见表1。
1.3 腺病毒穿梭质粒p-shuttle-CTGF的构建及鉴定
将合成的单链寡核苷酸退火形成双链DNA并检测无误。用HindⅢ、BglⅡ双酶切穿梭质粒pShut⁃tle-H1(图1),酶切产物纯化后,用T4噬菌体DNA连接酶于16℃连接线性化的pShuttle-H1及退火后的双链DNA 12 h,转化DH5α感受态细菌,在卡那霉素抗性LB平板上于37℃培养过夜,筛选扩增转化的阳性菌落,提取质粒并纯化后获得腺病毒穿梭质粒p-shuttle-CTGF,用EcoRⅠ酶切鉴定,并将酶切后获得的小片段回收进行测序分析。
1.4 复制缺陷型腺病毒载体Ad.H1-CTGF的包装和滴定
培养腺病毒包装细胞AD-293,达80%~90%汇合时加入1 μg鉴定无误的腺病毒穿梭质粒p-shut⁃tle-CTGF 与 4 μg 骨 架 质 粒 pAdEasy-1,用 Lipo⁃fectAMINE2000脂质体转染,使之进行同源重组,第2 d传代;转染7~10 d后,75%~80%的细胞出现CPE时收集细胞,-80℃和37℃反复冻融3次释毒,离心冻融液收集上清,即为第一代腺病毒载体Ad.H1-CTGF毒种,作为随后大量病毒扩增的原液,3次扩增后获得病毒保存液。同法获得无关阴性对照病毒Ad.H1-Con原液及保存液,均于-80℃保存。病毒滴定采用TCID50法,即将病毒原液梯度稀释至1/10-6~1/10-12,分别接种生长于96孔培养皿中的AD-293细胞,37℃培养72 h,用X-gal染色,计算病毒滴度。
1.5 空斑实验检测腺病毒载体的感染性
将肝星状细胞系HSC-T6细胞低密度铺于6孔板中,培养1 d后达60%~70%融合,用感染复数(MOI)为100的腺病毒载体Ad.H1-CTGF和阴性对照病毒Ad.H1-Con感染细胞,未感染病毒的细胞为对照,加甲基纤维素覆盖液后37℃培养7 d,吸除覆盖液加结晶紫染色,清洗后观察空斑形成情况。
1.6 Western印迹检测病毒载体对CTGF基因的沉默效果
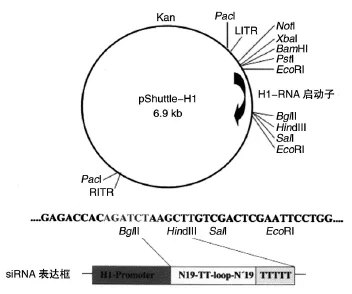
图1 腺病毒穿梭质粒pShuttle-H1图谱及构建示意图
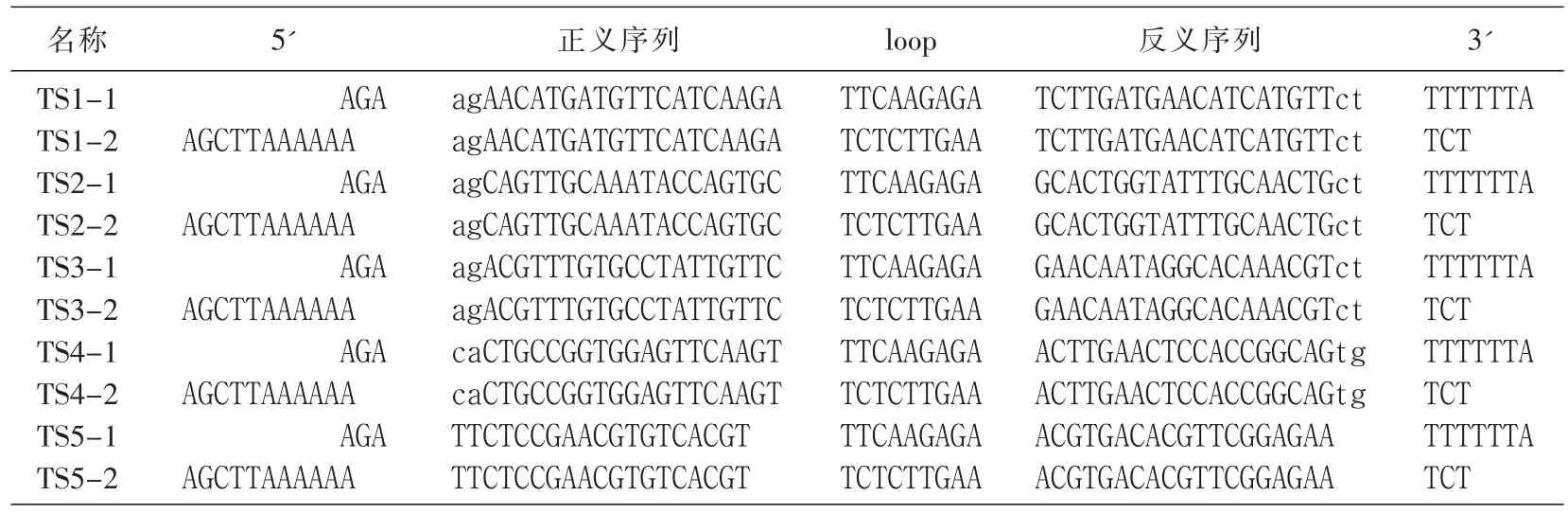
表1 编码siRNA的DNA双链
HSC-T6细胞于6孔板中培养1 d达60%~70%融合后,用MOI为100的腺病毒载体Ad.H1-CTGF和阴性对照病毒Ad.H1-Con感染细胞,37℃培养48 h后裂解细胞、提取蛋白,进行SDS-PAGE,然后将蛋白条带电转移到硝酸纤维素膜上,以抗CTGF单克隆抗体为一抗(1∶10)、山羊抗鼠IgG-HRP抗体为二抗(1∶100)进行 Western印迹,检测腺病毒载体对CTGF基因的沉默效果。
2 结果
2.1 含靶序列的单链寡核苷酸退火产物检测
将合成的4对含靶序列、1对阴性对照序列的单链寡核苷酸于90℃温育4 min、70℃温育10 min,缓慢冷却至室温进行退火,用12%非变性PAGE检测退火形成双链DNA的效率,均达90%以上(图2),提示退火产物合格,可用来构建腺病毒穿梭质粒。
2.2 腺病毒穿梭质粒p-shuttle-CTGF的鉴定
由腺病毒穿梭质粒pShuttle-H1图谱(图1)可看出,MCS中含有2个EcoRⅠ酶切位点,EcoRⅠ酶切后形成2个片段,大片段6600 bp,小片段为300 bp的H1启动子序列。在BglⅡ和HindⅢ位点间插入合成的寡核苷酸靶序列后,小片段长度则变为360 bp。电泳结果(图3)显示,阴性对照质粒p-shut⁃tle-H1酶切小片段为300 bp,阳性克隆质粒p-shut⁃tle-CTGF酶切小片段为360 bp,大片段均为6600 bp,初步证明重组腺病毒穿梭质粒构建正确。回收360 bp小片段进行测序,证实序列完全正确(基因序列略)。
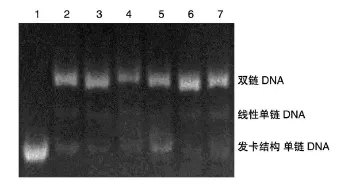
图2 退火产物电泳图谱

图3 重组腺病毒穿梭质粒p-shuttle-CTGF的酶切鉴定
2.3 腺病毒载体的滴定和感染性鉴定
采用TCID50法对病毒进行滴定,测出病毒保存液滴度为4×1010PFU/mL。用MOI为100的目标病毒Ad.H1-CTGF和阴性对照病毒Ad.H1-Con感染HSC-T6细胞,7 d后目标病毒Ad.H1-CTGF组和阴性对照病毒组Ad.H1-Con均有大量空斑形成,未感染病毒的HSC-T6细胞未见空斑形成,说明构建的目标病毒和阴性无关对照病毒均具有较好的感染性(图4)。
2.4 腺病毒载体对CTGF基因沉默效果的Western印迹鉴定
Western印迹检测发现,内参照蛋白β-actin的表达水平在6组之间无明显差异;而CTGF蛋白表达在包装的4组目标病毒感染HSC-T6细胞后均有不同程度降低,其中含靶序列TS3的病毒感染组降低最显著;无关序列阴性对照病毒感染组CTGF蛋白表达与未感染细胞组一样,未见降低(图5)。提示构建的含TS3靶序列的腺病毒载体具有较好的沉默CTGF基因的效果,将其命名为Ad.H1-CTGF,可作为以后抗纤维化研究的工具。
3 讨论
我国是肝病大国,随着慢性肝病病程的延续,其纤维化的进程也一直持续,由于目前缺乏行之有效的根治办法,这些人都面临着肝硬化的潜在威胁,这已成了严峻的社会问题。因此,寻找有效的抗纤维化方法,阻止慢性肝病患者的肝硬化趋势,已成为我国乃至全球亟待解决的问题。
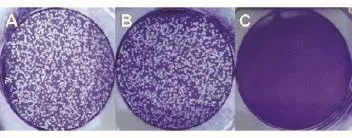
图4 包装的腺病毒感染滴定
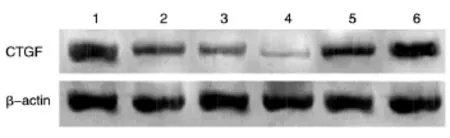
图5 各组病毒对CTGF表达的影响
肝纤维化的成因,普遍认为与肝星状细胞(HSC)的活化有关[6],转化生长因子β(TGF-β)是目前公认的致纤维化最强的细胞因子之一,其促纤维化作用主要是通过诱导其下游因子CTGF的表达,活化HSC来完成。业已证明,CTGF与肝、肺、肾等器官的纤维化、皮肤瘢痕形成、创伤修复及动脉粥样硬化密切相关[7]。由于CTGF的生物学效应相对单一,主要介导TGF-β的促细胞增殖和细胞外基质(ECM)合成等作用,因此,阻断CTGF表达或抑制其活性,可能是一种更特异、更有效的防止肝纤维化的手段。
RNAi技术具有高效性和高特异性,作为关闭基因的新技术,已被广泛应用[8]。RNAi的产生需要向细胞内导入siRNA或在细胞内表达siRNA,前者是将体外合成的siRNA直接导入细胞,虽简单,但导入的siRNA易降解,且以瞬时表达为主,目前已较少使用;后者通过表达siRNA的质粒或病毒载体在靶细胞内转录siRNA,发挥RNAi作用,因方便、稳定和高效而成为主流方法。腺病毒载体可以直接、高效、稳定地感染细胞,避免了质粒转染效率低而带来的不便,逐渐成为该领域的研究热点[9-13]。
我们根据siRNA设计原则[4-5],设计了4对针对CTGF基因的siRNA序列和1对无关阴性对照序列,退火形成双链DNA后定向克隆至pShuttle-H1的H1启动子下游,获得腺病毒穿梭质粒p-shuttle-CTGF1-5,经酶切、测序鉴定无误后与骨架质粒pAdEasy-1共转染AD-293细胞,同源重组后获得4株腺病毒载体和1株阴性对照病毒,空斑实验证实它们均具有较好的感染性,Western印迹检测发现4组目标病毒对HSC-T6细胞CTGF的表达均有不同程度的抑制,其中Ad.H1-CTGF3的抑制效果最好,抑制率达85%,达到了设计要求。该腺病毒载体的构建成功,将为抗纤维化的研究提供可行的工具,为肝纤维化和肝硬化的防治奠定基础。
[1]Caruso M,Khiem P N,Kwong Y L,et al.Adenovirus-mediat⁃ed interleukin-12 gene therapy for metastatic colon carcinoma[J].Proc Natl Acad Sci USA,1996,93:11302-11306.
[2]Ito Y,Goldschmeding R,Bende R,et al.Kinetics of connec⁃tive tissue growth factor expression during experimental prolif⁃erative glomerulonephritis[J].J Am Soc Nephrol,2002,12:472-484.
[3]Hannon G L.RNA inteference[J].Nature,2002,418:244-251.
[4]Tuschl T.Expanding small RNA interference[J].Nat Biotech⁃nol,2002,20(5):446-448.
[5]Reynolds A,Leake D,Boese Q,et al.Rathonal siRNA de⁃sign for RNA interference[J].Nat Biotechnol,2004,22(3):326-330.
[6]Bedosa P,Paradis V.Approaches foe treatment of liver fibro⁃sis in chronic hepatitis C[J].Lin Liver Dis,2003,7:195-210.
[7]Paradis V,Dargere D,Bonvoust F,et al.Effect and regula⁃tion of connective tissue growth factor on hepatic stellate cells[J].Lab Invest,2002,82:767-774.
[8]Elbashir S M,Lendeckel W,Tuschl T,et al.Duplexes of 21-nucleotideRNAsmediateRNA interferencein cultured mammalian cells[J].Nature,2001,411:428-429.
[9]Sumimoto H,Yamagata S,Shimizu A,et al.Gene therapy for human small-celllungcarcinomabyinactivation ofSkp-2 with virally mediated RNA interference[J].Gene Thera,2005,12:95-100.
[10]Xia H,Mao Q,Paulson H L,et al.siRNA-mediated gene si⁃lencing in vitro and in vivo[J].Nat Biotechnol,2002,20:1006-1010.
[11]Shen C,Buck A K,Liu X,et al.Gene silencing by adenovi⁃rus-delivered siRNA[J].FEBS Lett,2003,539:111-114.
[12]Zhao Ling-Jun,Jian Heng,Zhu Henghu.Specific gene inhibi⁃tion by adenovirus-mediated expression ofsmallinterfering RNA[J].Gene,2003,316:137-141.
[13]Kewal K J.RNAi and siRNA in target validation[J].Drug Dis⁃covery Today,2004,9:307-309.
