重组SCIRR39多克隆抗体的制备及检测
2013-10-29倪艳丽李欣刘少君
倪艳丽,李欣,刘少君
军事医学科学院 基础医学研究所,蛋白质组学国家重点实验室,北京 100850
脊髓损伤与修复反应受多种因素影响,是有多种分子参与的复杂的病理过程,目前其分子机理仍不明确,因而无法找到有效干预措施。脊髓损伤与修复蛋白39(spinal cord injury and regeneration re⁃lated protein 39,SCIRR39)基因是我们克隆到的在大鼠脊髓损伤及修复过程中上调表达的基因[1],是大鼠核糖核酸酶抑制因子基因的突变体[2-4],其编码的蛋白以前只发现存在于胞浆内,而近年有报道显示该蛋白还存在于细胞核及线粒体中[5],但功能不详。为进一步研究该蛋白在中枢神经系统和其他组织中的分布,及其在脊髓损伤修复过程中可能的作用,我们制备了针对该蛋白的特异性抗体,为中枢神经系统损伤与修复机理研究提供有效的临床干预线索。
1 材料与方法
1.1 材料
雄性成年日本大耳白兔(体质量2.5 kg)购自军事医学科学院动物中心;大肠杆菌BL21(DE3)由本室保存;克隆载体pGEM-T/T easy、琼脂糖、质粒提取试剂盒购自Promega公司;EcoRⅠ、BamHⅠ等常用限制性内切酶,DL2000 DNA marker,T4DNA连接酶,LA Taq、Pyrobest DNA 聚合酶,IPTG,X-gal,dNTP均购自TaKaRa公司;Super ScriptⅡ反转录酶、TRIzol试剂购自Invitrogen公司;琼脂糖凝胶回收试剂盒购自Qiagen公司;其他试剂均为国产分析纯。
1.2 PCR扩增Scirr39基因
从大鼠全横断损伤脊髓提取RNA,反转录成cDNA,以此为模板扩增Scirr39基因片段。两端引物分 别 为 39-ORF-5'(ATGTCTCTGGACATCCAGTC)和 39-ORF-3'(TCAGGAGATGACCCTCAGGGATG GC)。PCR 条件:94℃ 2 min,然后以 94℃ 20 s、60℃ 30 s、72℃ 2 min 进 行 30 个 循 环 ,72℃ 7 min。PCR产物行1%琼脂糖凝胶电泳,用胶回收试剂盒回收后,T-A克隆入pGEM-T easy载体中,将重组载体转化感受态大肠杆菌DH5α,以EcoRⅠ酶切鉴定重组克隆后进一步测序鉴定,保存含有正确重组载体的菌种。
1.3 pGEX-GST-SCIRR39-C融合表达载体的构建
以构建的Scirr39 ORF载体为模板PCR扩增SCIRR39-C端抗原表位编码DNA序列,引物分别为E39-N(CGTGGATCCGGCGGCGGCGGCAGCGGCG GCGGCGGCAGCGCGGAACTGTGCCAGGGCCCG)和E39-C(CGGGAATTCTCAGCTAATCACGCGCAGGC TCGGTTTATCT),两端分别引入BamHⅠ和EcoRⅠ酶切位点(下划线序列)及保护碱基,并在上游引物的5'端引入10个甘氨酸接头。PCR条件:94℃ 5 min,然后以 94℃ 30 s、60℃ 30 s、72℃ 1 min 进行25个循环,72℃ 7 min。PCR产物行1%琼脂糖凝胶电泳,用胶回收试剂盒回收后,BamHⅠ和EcoRⅠ双酶切回收目的片段,与经相同酶消化的表达载体pGEX-4T-2连接,转化大肠杆菌DH5α,获得表达载体 pGEX-GST-SCIRR39-C,经 BamHⅠ、EcoRⅠ双酶切和测序验证,表明目的基因已插入pGEX-4T-2。
1.4 GST-SCIRR39-C融合蛋白的原核表达和纯化
把pGEX-GST-SCIRR39-C转化表达菌株BL21(DE3),阳性克隆用LB培养基于37℃振摇过夜,取100 μL菌液加入10 mL氨苄西林抗性的LB培养基中,继续培养,D600nm达0.6~0.8时加入0.2 mmol/L IPTG诱导12~16 h,收集菌体,PBS洗3次,超声波破碎,收集上清,用预装谷胱甘肽琼脂糖凝胶的GST rap FF柱亲和纯化,再用还原性谷胱甘肽洗脱GST-SCIRR39-C融合蛋白,所有纯化操作均在GE Health公司ÄKTA Prime蛋白纯化系统上进行,最后用SDS-PAGE鉴定融合蛋白的纯化结果。
1.5 SCIRR39-C抗原表位蛋白的分离
用1 mL注射器,将80 μL凝血酶与920 μL 1×PBS的混合液注入GST rap柱,封闭柱两端,23~24℃放置16 h;采用1 mL注射器,用3 mL 1×PBS以1 mL/min的流速洗下柱中解离下来的SCIRR39-C蛋白(悬于冰上操作),随后用10 mL洗脱缓冲液以1 mL/min的流速洗脱柱中的GST蛋白(悬于冰上操作),以评价凝血酶酶切效率。纯化后的SCIRR39-C蛋白经冷冻干燥浓缩,以备检测抗体效价时使用。
1.6 抗体制备
取饲养1周、体质量为2.5 kg的纯种日本大耳白兔,免疫前从耳缘静脉取正常血清作为对照。将1 mg抗原与等体积弗氏完全佐剂混合直到形成乳浊液,采用背部多点皮下注射;2周后,取1 mg抗原与等体积弗氏不完全佐剂充分混匀,背部多点注射进行二次加强免疫;免疫后7~10 d从耳缘静脉取血,ELISA测定抗体效价,若滴度小于1∶1000,进一步加强免疫,要求每2周免疫一次,直到抗体效价达到所需滴度;到所需滴度后的第10 d从颈动脉采血,采集的血液室温斜置30 min,移到4℃冰箱待血清析出,收集血清后1000 r/min离心10 min,0.5 mL/支分装,-70℃保存备用。
1.7 ELISA测定抗体滴度
用pH9.6的包被缓冲液将免疫所用蛋白稀释至所需浓度(100 ng/100 μL),在酶标板每孔中加入100 μL,并将板置于湿盒中,4℃过夜或37℃保温4 h;用PBS-T洗板3次后每孔加入200 μL封闭液,于37℃保温1 h,随后用PBS-T洗板3次;一抗用生理盐水进行 1/10 梯度稀释,100 μL/孔,4℃过夜,用PBS-T洗板3次,接着进行二抗反应,37℃保温2 h,用PBS-T洗板3次;进行显色反应,用BIO-RAD 680酶标仪测定D492nm值。
1.8 Western印迹检测抗体特异性
取SCIRR39-C重组抗原表位蛋白进行SDSPAGE,采用预染蛋白标准以便于检测转移效率。15 V以下恒压转移45 min,于1%脱脂牛奶中室温封闭1 h,加入制备的一抗Anti-SCIRR39(1∶500)室温孵育1 h,用0.1%PBST洗3次,各10 min;以封闭液稀释HRP标记的二抗(1∶2000),与硝酸纤维素膜一起于室温共孵育1 h;用0.1%PBST洗3次,各10 min;ECL试剂显色。
2 结果
2.1 Scirr39基因的克隆及鉴定
以大鼠全横断损伤脊髓的总RNA为模板,加入上下游引物,PCR扩增得到特异目的片段,1%琼脂糖凝胶电泳分析表明扩增片段长1386 bp(图1)。
2.2 GST-SCIRR39-C融合表达载体的构建
为了免疫动物制备抗体,我们将Scirr39编码区C端的1077~1383 bp(图2)克隆到pGEX-4T-2原核表达载体中,转化大肠杆菌BL21(DE3),挑选阳性克隆,经过测序保证其序列正确。
2.3 GST-SCIRR39-C融合蛋白在大肠杆菌BL21(DE3)中的表达
在30℃、0.2 mmol/L IPTG诱导条件下表达GST-SCIRR39-C融合蛋白。GST相对分子质量(Mr)为 26×103,SCIRR39-C为 11.9×103,融合蛋白为37.9×103。图3显示表达的融合蛋白Mr与理论值一致。
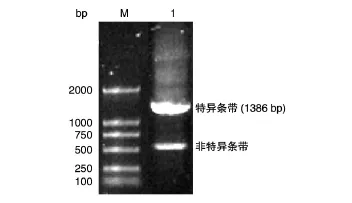
图1 Scirr39基因编码区的PCR扩增产物
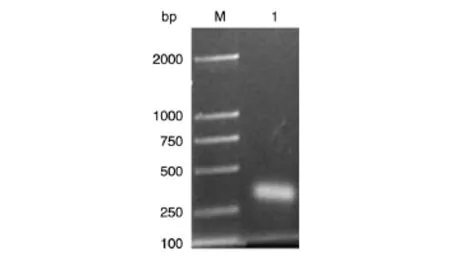
图2 SCIRR39-C端抗原表位编码DNA片段的扩增

图3 SDS-PAGE检测GST-SCIRR39-C的表达
2.4 融合蛋白的纯化
在GE Health公司ÄKTA Prime蛋白纯化系统上进行,图4为SDS-PAGE检验纯化结果。
2.5 融合蛋白的酶切
GST-SCIRR39-C融和蛋白经凝血酶消化后,SCIRR39-C蛋白流出液及GST洗脱液如图5所示,主要蛋白条带Mr分别约为 26×103和11.9×103。
2.6 抗SCIRR39蛋白兔抗血清的ELISA效价测定
干燥后的融合蛋白溶于0.1 mol/L PBS,终浓度1 mg/mL,采用背部多点皮内注射的方法免疫大耳白兔,多次加强免疫后第10 d抽取血清,用ELISA检测抗体滴度,以免疫前抽取的兔血清为对照,其效价达到1∶104,可以取血收集血清(图6)。
2.7 Western印迹检测兔抗血清的特异性
以兔抗血清对原核表达的SCIRR39-C蛋白进行Western印迹检测,图7显示该蛋白条带可被检测到,且其相对分子质量与预期的SCIRR39-C一致,说明制备的抗血清结合性较好。
3 讨论

图4 SDS-PAGE检测GST-SCIRR39-C的纯化

图5 SDS-PAGE检测GST-SCIRR39-C融合蛋白凝血酶切结果

图6 ELISA检测抗体效价

图7 Western印迹检测Anti-SCIRR39的抗体特异性
由于SCIRR39是新近发现的大鼠RNase抑制剂(RNH)的同源蛋白[6-7],目前尚无针对其的商业化特异性抗体,而为了研究SCIRR39在神经系统的分布及其在脊髓损伤/修复过程中可能的作用[8-10],以至其他功能,我们要制备针对其的特异性抗体。为此,我们采用GST融合蛋白表达系统表达重组SCIRR39。该表达系统可以高效表达融合蛋白,且产物易纯化,用凝血酶切除GST也比较容易。但由于原核细胞中缺乏真核生物中翻译后修饰所需酶类,以及在重组蛋白表达过程中缺乏某些蛋白质折叠的辅助因子,且表达环境不同于真核细胞,无法形成正确的次级键等原因,故使得表达的融合蛋白很难折叠成正确的空间构象。我们在表达SCIRR39全长蛋白时就遇到这方面的重重困难,由于蛋白序列中含有多达32个Cys残基,很可能在表达过程中发生二硫键错配,使得我们没有得到目的蛋白。而通过降低诱导温度和IPTG浓度等方法也没有提高蛋白的可溶表达量,这种极少量的目的蛋白对于抗体制备来说是远远不够的。因此,我们选择表达抗原表位的方法制备抗体。通过抗原表位分析,选择C端359~461位103个氨基酸残基作为SCIRR39的抗原表位,免疫家兔制备多克隆抗体。经过对宿主菌的选择及诱导条件的优化,我们将构建的重组质粒诱导表达;之后用纯化的SCIRR39免疫成年日本大耳白兔,得到了针对SCIRR39的多克隆抗体[11],该兔抗血清的ELISA效价约为1∶104,表明抗血清具有较好的特异性。SCIRR39重组蛋白多克隆抗体的成功制备,为进一步深入研究其生物学功能提供了良好的工具。
[1]李欣,阙海萍,马振莲,等.应用锚定消减杂交技术克隆分析大鼠脊髓原代神经元损伤、修复相关基因[J].解放军医学杂志,2005,30(12):1072-1075.
[2]Hofsteenge J,Kieffer B,Matthies R,et al.Amino acid se⁃quence of the ribonuclease inhibitor from porcine liver re⁃vealsthe presence ofleucine-rich repeats[J].Biochemistry,1988,27(23):8537-8544.
[3]Kobe B,Deisenhofer J.The leucine-rich repeats:a versatile binding motif[J].Trends Biochem Sci,1994,19:415-421.
[4]Kobe B,Kajava A.The leucine-rich repeats as a protein rec⁃ognition motif[J].Curr Opin Struct Biol,2001,11:725-732.
[5]Adriana F,Marco M,Elio P,et al.The ribonuclease/angio⁃genin inhibitor is also present in mitochondria and nuclei[J].FEBS Lett,2011,585:613-617.
[6]Chen C Z,Shapiro R.Site-specific mutagenesis reveals differ⁃ences in the structural bases for tight binding of RNase inhib⁃itor to angiogenin and RNase A[J].Proc Natl Acad Sci USA,1997,94(5):1761-1766.
[7]Hofsteenge J.Ribonuclease inhibitor[M]∥ D'Alessio G,Rior⁃dan J F,eds.Ribonucleases:Structures and Functions.New York:Academic Press,1997.
[8]Lee F S,Vallee B L.Modular mutagenesis of human placen⁃tal ribonuclease inhibitor,a protein with leucine-rich repeats[J].Proc Natl Acad Sci USA,1990,87(5):1879-1883.
[9]Lee F S,Shapiro R,Vallee B L.Tight-binding inhibition of angiogenin and ribonuclease A by placental ribonuclease inhib⁃itor[J].Biochemistry,1989,28(1):225-230.
[10]Shapiro R,Vallee B L.Human placental ribonuclease inhibi⁃tor abolishes both angiogenic and ribonucleolytic activities of angiogenin[J].Proc Natl Acad Sci USA,1987,84(8):2238-2241.
[11]黎燕.分子免疫学实验指南[M].北京:化学工业出版社,2008:20-28.
