合成及表征一种含BODIPY和蒽的新型荧光染料
2013-10-28金英芝李雪娇尹守春
李 琪,金英芝,陈 栋,徐 巧,李雪娇,刘 斌,尹守春
(杭州师范大学材料与化学化工学院,浙江 杭州 310036)
合成及表征一种含BODIPY和蒽的新型荧光染料
李 琪,金英芝,陈 栋,徐 巧,李雪娇,刘 斌,尹守春
(杭州师范大学材料与化学化工学院,浙江 杭州 310036)
本文通过钯催化偶联反应,成功地将蒽基引入到BODIPY母体结构的3-位上,合成了一种以蒽为供体和BODIPY为接受体的分子天线.采用1H NMR、13C NMR和MS等表征手段对化合物进行了结构表征,并对反应结果进行了讨论.
BODIPY;蒽;荧光染料;合成
0 引 言
50多年以来,能量转移一直引起科学界的广泛关注.这是因为能量转移在许多自然和人工过程中都扮演着重要作用,比如水氧化生成氧气,光合生物体内二氧化碳的固定,太阳能的光化学转换及信息处理等[1-2].很多科学家为此一直致力于设计合成可用于能量转移的分子天线,他们希望设计的分子天线中的两个或多个生色团间具有很好的匹配性.
在各种生色团中,BODIPY(4,4-二氟-4-硼-3a,4a-二氮杂-s-引达省)荧光染料引起人们广泛的兴趣,这主要是因为BODIPY荧光染料有许多优点,如在可见光波长范围内有明显的紫外吸收和荧光发射峰、较大的摩尔消光系数、相当高的荧光量子产率、较强的抗光和化学品以及分子结构易于修饰等[3].近年来,已有一些将BODIPY荧光染料作为分子天线中的接受体或供体的报道.比如BODIPY作为接受体,可以吸收来自多环芳香碳氢化合物[4-6],噻吩齐聚物[7],亚酞菁[8]等供体的能量;BODIPY也可作为供体,将自身吸收的能量传递到卟啉[9-10],苝二酰亚胺[11],亚酞菁[8-12],富勒烯[13],BODIPY[14-15]等接受体.
本文将报道一种BODIPY作为接受体和蒽作为受体的分子天线的合成及表征.将蒽共轭地连接在BODIPY接受体的3位,由于蒽和BODIPY间共平面,可使电子沿着供体蒽直接传递到受体BODIPY中,同时也可以有效地增加蒽和BODIPY各自的共轭长度,使它们的吸收和发射光谱都能发生一定的红移[16].
1 实验部分
1.1 主要实验仪器
ZF7三用紫外分析仪(杭州瑞佳精密科学仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(杭州瑞佳精密科学仪器有限公司);JBZ-14B型磁力搅拌器(上海志威电器有限公司);NMR由德国布鲁克公司生产的Bruker 300型核磁共振仪测定,以TMS为内标;ESI质谱由美国Agilent公司生产的Agilent 5975质谱仪测定.
1.2 主要实验试剂
1,4-二碘-2,5-双十二烷氧基苯[17]、9-乙炔蒽[18]和3,5-二氯BODIPY[19]按照相应的参考文献合成.二氯甲烷、石油醚、乙酸乙酯、盐酸、碳酸氢钠、氢氧化钠、无水硫酸钠均来自于杭州高晶精细化工有限公司;300-400目硅胶来自于青岛海洋化工厂;三乙胺、四氢呋喃、吡咯、对甲基苯甲醛、三氟化硼乙醚溶液来自于百灵威科技有限公司;N-氯代丁二酰亚胺、对四氯苯醌、2-甲基-3-丁炔-2-醇、碘化亚铜、Pd(PPh3)Cl2来自于ACROS公司;所有试剂均为分析纯.
2.1 目标产物的合成
1.2.1 合成过程
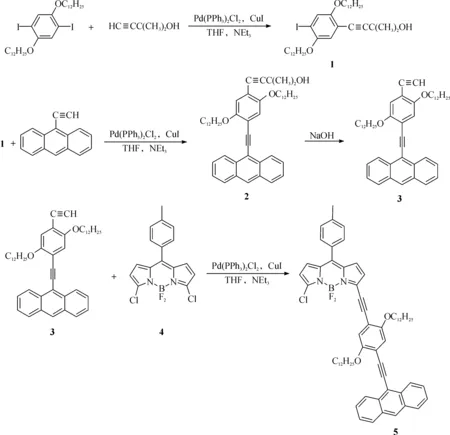
图1 目标产物的合成路线Fig. 1 Synthetic route of target product
1.2.2 4-(2,5-双十二烷氧基-4-碘苯基)-2-甲基-3-丁炔-2-醇 (1)的合成
氩气保护下,将3.49 g (5 mmol) 1,4-二碘-2,5-双十二烷氧基苯,0.42 g (5 mmol) 2-甲基-3-丁炔-2-醇,80 mL THF,5 mL Et3N,70 mg (0.1 mmol) PdCl2(PPh3)2和20 mg (0.1 mmol) CuI加入到250 mL圆底烧瓶中.室温下搅拌1 h后,加热至60 ℃反应4 h.旋干溶剂后,加入饱和碳酸氢钠溶液,用二氯甲烷萃取.二氯甲烷层用无水硫酸钠干燥.旋掉二氯甲烷后,粗产物经硅胶色谱柱分离,展开剂为CH2Cl2/CH3OH=(10:1, v/v),得到白色固体2.42 g,产率为74%.1H NMR (300 MHz, CDCl3),δ(ppm): 7.25 (1H, s), 6.80 (1H, s), 3.92 (4H, t,J=6.4 Hz, OCH2(CH2)10CH3), 2.07 (1H, s, OH), 1.77 (4H, m, OCH2CH2(CH2)9CH3), 1.62 (6H, s, C(CH3)2OH), 1.48 (4H, m, O(CH2)2CH2(CH2)8CH3), 1.26 (32H, m, O(CH2)3(CH2)8CH3), 0.88 (6H, t, J=6.4 Hz, O(CH2)11CH3).13C NMR (75 MHz, CDCl3),δ(ppm): 154.5, 151.9, 123.8, 116.3, 113.1, 98.7, 87.6, 70.2, 69.8, 65.9, 32.1, 31.6, 29.8, 29.5, 29.3, 26.2, 22.8, 14.3. ESI-MS: m/z 1331.7 [2M+Na]+.
1.2.3 4-(4-(2-(9-蒽基)乙炔基)-2,5-双十二烷氧苯基)-2-甲基-3-丁炔-1-醇 (2)的合成
氩气保护下,将8.18 g (12.5 mmol) 化合物1,2.83 g (14 mmol) 9-乙炔蒽,80 mL THF,10 mL Et3N,0.53 g (0.75 mmol) PdCl2(PPh3)2和 0.15 g (0.75 mmol) CuI加入到250 mL圆底烧瓶中.室温下搅拌1 h后,加热至60 ℃反应4 h.旋干溶剂后,加入饱和碳酸氢钠溶液,用二氯甲烷萃取.二氯甲烷层用无水硫酸钠干燥.旋掉二氯甲烷后,粗产物经硅胶色谱柱分离,展开剂为CH2Cl2/EtOAc=(1:1, v/v),得到6.83 g浅黄色固体,产率75%.1H NMR (300 MHz, CDCl3),δ(ppm): 8.78 (2H, d,J=8.4 Hz), 8.43 (1H, s), 8.02 (2H, d,J=8.4 Hz), 7.54 (4H, m), 7.18 (1H, s), 6.99 (1H, s), 4.08 (4H, t,J=6.3 Hz, OCH2(CH2)10CH3), 2.02 (2H, m, OCH2CH2(CH2)9CH3), 1.86 (2H, m, OCH2CH2(CH2)9CH3), 1.67 (6H, s, C(CH3)2OH), 1.54 (4H, m, O(CH2)2CH2(CH2)8CH3), 1.27 (36H, m, O(CH2)3(CH2)8CH3), 0.88 (6H, t,J=6.4 Hz, O(CH2)11CH3).13C NMR (75 MHz, CDCl3),δ(ppm): 153.8, 153.6, 132.6, 131.2, 128.6, 127.7, 127.1, 126.4, 125.7, 117.6, 116.7, 116.2, 114.0, 113.5, 99.3, 97.4, 92.1, 78.7, 69.7, 69.4, 65.8, 31.9, 31.5, 29.7, 29.6, 29.5, 29.4, 26.1, 22.7, 14.1. ESI-MS: m/z 1479.8 [M+Na]+.
1.2.4 10-(2-(2,5-二十二烷氧基-4-苯乙炔基)乙炔)蒽 (3)的合成
氩气保护下,将3.65 g (5 mmol) 化合物2和0.80 g (20 mmol) NaOH 溶于150 mL无水甲苯中,加热回流3 h.冷却至室温后,过滤不溶物,旋干溶剂,加入饱和碳酸氢钠溶液,用二氯甲烷萃取.二氯甲烷层用无水硫酸钠干燥.旋掉二氯甲烷后,粗产物经硅胶色谱柱分离,展开剂为EtOAc / petroleum ether=(1∶4, v/v),得到2.64 g深红色晶体,产率78.8%.1H NMR (300 MHz, CDCl3),δ(ppm): 8.78 (2H, d,J=8.7 Hz), 8.44 (1H, s), 8.02 (2H, d,J=8.1 Hz), 7.55 (4H, m), 7.21 (1H, s), 7.06 (1H, s), 4.11 (4H, t,J=6.3 Hz, OCH2(CH2)10CH3), 3.39 (1H, s, HC≡C), 2.02 (2H, m, OCH2CH2(CH2)9CH3), 1.86 (2H, m, OCH2CH2(CH2)9CH3), 1.26 (36H, m, O(CH2)2(CH2)9CH3), 0.88 (6H, t,J=6.4 Hz, O(CH2)11CH3).13C NMR (75 MHz, CDCl3),δ(ppm): 154.6, 154.1, 133.0, 131.6, 129.0, 128.2, 127.5, 126.9, 126.1, 118.0, 117.3, 117.1, 113.1, 97.7, 82.8, 70.3, 69.8, 32.3, 30.0, 29.9, 29.8, 26.4, 23.1, 14.5. ESI-MS: m/z 1364.0 [2M+Na]+.
1.2.5 4,4-二氟-8-(4-甲苯基)-3-氯, 5-[10-(2-(2,5-二十二烷氧基-4-苯乙炔基)乙炔)蒽]-4-硼-3a,4a-二氮-s-引达省(5)的合成
氩气保护下,将0.80 g (1.2 mmol)化合物3,0.35 g (1 mmol) 化合物4,42 mg (0.06 mmol) Pd(PPh3)2Cl2和11 mg (0.06 mmol) CuI溶于10 mL NEt3和65 mL THF溶液.室温下搅拌1 h后,加热至60 ℃反应4 h.旋干溶剂后,加入水溶液,用二氯甲烷萃取.二氯甲烷层用无水硫酸钠干燥.旋掉二氯甲烷后,粗产物经硅胶色谱柱分离,展开剂为EtOAc / petroleum ether=1:4,得到0.39 g绿色固体,产率40%.1H NMR (300 MHz, CDCl3),δ(ppm): 8.79 (2H, d,J=8.7 Hz), 8.44 (1H, s), 8.02 (2H, d,J=8.4 Hz), 7.52 (4H, m), 7.42 (2H, d,J=7.8 Hz), 7.32 (2H, d,J=7.8 Hz), 7.17 (2H, s), 6.89 (1H, d,J=4.5 Hz), 6.86 (1H, d,J=4.2 Hz), 6.74 (1H, d,J=4.5 Hz), 6.43 (1H, d,J=4.2 Hz), 4.16 (4H, t,J=6.3 Hz, OCH2(CH2)10CH3), 2.47 (3H, s, ArCH3), 1.99 (4H, m, OCH2CH2(CH2)9CH3), 1.57 (4H, m, O(CH2)2CH2(CH2)8CH3), 1.25 (32H, m, O(CH2)2(CH2)9CH3), 0.87 (6H, t,J=6.4 Hz, O(CH2)11CH3).13C NMR (75 MHz, CDCl3)δ(ppm): 153.5, 152.7, 142.8, 141.9, 140.1, 137.1, 134.9, 133.5, 131.6, 130.2, 129.6, 129.4, 128.2, 127.6, 126.9, 126.1, 125.5, 124.7, 123.4, 117.3, 116.5, 115.4, 115.3, 114.8, 111.8, 99.3, 96.7, 92.2, 87.4, 68.9, 68.4, 30.9, 28.7, 28.5, 28.3, 25.0, 21.7, 13.1. ESI-MS: m/z 1 007.7 [M+Na]+.
2 结果与讨论
2.1 目标化合物5的结构表征
采用1H NMR、13C NMR和MS对所合成的中间体和最终化合物进行了详细的结构表征.图2所示的是中间体3和4与目标化合物5的核磁氢谱对比图.从图2中可以看出,中间体3中蒽环上9个氢的吸收峰出现在8.78,8.43,8.02和7.54 ppm处;苯环上2个氢由于受到烷氧基供电效应的影响,出现在高场处,即7.21和7.06 ppm;特征的末端炔上氢的吸收峰出现在3.39 ppm处.中间体4(3,5-二氯BODIPY)中苯环上4个氢的吸收峰出现在7.39和7.33 ppm处,特征的BODIPY母体上4个氢出现在高场区6.87和6.44 ppm.中间体3和4经钯催化偶联反应生成目标产物5后,中间体3特征的末端炔上氢的吸收峰完全消失,同时由于分子对称性的增加,其苯环上2个氢由原来的两组吸收峰,7.21和7.06 ppm变成一组吸收峰7.17 ppm;并且中间体4特征的BODIPY母体上4个氢由原来的两组吸收峰(1,2),其氢的个数之比为2∶2变成4组吸收峰(11,12,21,22),其氢的个数之比为1∶1∶1∶1;中间体3和4中其它氢的吸收峰相应地都出现在目标化合物5的核磁氢谱上.这些结果充分说明通过钯催化偶联反应,成功地合成了以蒽为供体,BODIPY为接受体的分子天线5.

图2 化合物3、4和5的1H NMR谱对比图Fig. 2 1H NMR of 3, 4 and 5
2.2 目标化合物5合成讨论
Wim教授等曾报道3,5-二氯BODIPY在钯催化剂作用下,可以和末端炔进行偶联反应生成单取代和双取代的产物.利用这种方法,他们成功地合成了各种对称和非对称的3,5-二取代BODIPY化合物[20].然而,和他们报道不同的是,中间体3和4进行钯催化偶联反应,没有二取代的副产物生成,仅仅生成单取代产物5.这可能是因为发生单取代生成化合物5后,一方面由于化合物5分子中含有烷氧基供电子基团,使得第二个氯原子的反应活性降低;另一方面化合物5分子中两个烷氧基比较长,形成了较大的空间位阻,从而阻碍了第二个氯原子发生进一步偶联反应.
3 结 论
通过钯催化偶联反应,将蒽和BODIPY这两种不同的荧光染料分子引入到同一分子中,合成了一种以蒽为供体和BODIPY为接受体的分子天线.由于烷氧基供电子效应和长柔性链的空间位阻效应,3,5-二氯BODIPY在钯催化剂作用下,与末端炔中间体4进行的偶联反应仅能生成单取代产物5.今后的工作将研究目标化合物5分子内的能量转移过程及效率.
[1] Shammai S. Photophysics and mechanisms of intramolecular electronic energy transfer in bichromophoric molecular systems: Solution and supersonic jet studies[J]. Chem Rev,1996,96(6):1953-1976.
[2] Jean L B, David B, Veaceslav C,etal. Charge-transfer and energy-transfer processes in π-conjugated oligomers and polymers: A molecular picture[J]. Chem Rev,2004,104(11):4971-5004.
[3] Loudet A, Burgess K. BODIPY dyes and their derivatives: Syntheses and spectroscopic properties[J]. Chem Rev,2007,107(11):4891-4932.
[4] Raymond Z, Christine G, Gilles U,etal. Intramolecular energy transfer in pyrene-bodipy molecular dyads and triads[J]. Chem Eur J,2005,11(24),7366-7378.
[5] Laure B, Gilles U, Raymond Z. Tailoring the properties of boron dipyrromethene dyes with acetylenic functions at the 2,6,8 and 4-B substitution positions[J]. Org Lett,2008,10(11),2183-2186.
[6] Anthony H, Laura J M, Sébastien G,etal. Electronic energy transfer to the S2 level of the acceptor in functionalised boron dipyrromethene dyes[J]. Chem Eur J,2009,15(18):4553-4564.
[7] Samia Z, Pauline R, Bruno A,etal. Engineering tunable light-harvesting Systems with oligothiophene donors and mono- or bis-bodipy acceptors[J]. J Org Chem,2008,73(4):1563-1566.
[8] Liu Jianyong, Hoi S Y, Xu Wei,etal. Highly efficient energy transfer in subphthalocyanine-BODIPY conjugates[J]. Org Lett,2008,10(11):5421.
[9] Robin K L, Arounaguiry A, Thiagarajan B,etal. Structural control of photoinduced energy transfer between adjacent and distant sites in multiporphyrin arrays[J]. J Am Chem Soc,2000,122(31):7579-7591.
[10] Dewey H, David F B, Jonathan S L. Probing electronic communication in covalently linked multiporphyrin arrays: A guide to the rational design of molecular photonic devices[J]. Acc Chem Res,2002,35(1):57-69.
[11] Deniz Y, Altan B, Engin U. Light harvesting and efficient energy transfer in a boron-dipyrrin (BODIPY) functionalized perylenediimide derivative[J]. Org Lett,2006,8(10):2871-2873.
[12] Liu Jianyong, Eugeny A E, Beate R,etal. Switching the photo-induced energy and electron-transfer processes in BODIPY-phthalocyanine conjugates[J]. Chem Commun,2009(12):1517-1519.
[13] Francis D, Phillip M S, Melvin E Z,etal. Energy transfer followed by rlectron transfer in a supramolecular triad composed of boron dipyrrin, zinc porphyrin, and fullerene: A model for the photosynthetic antenna-reaction center complex[J]. J Am Chem Soc,2004,126(25):7898.
[14] Vladimir A A, Anna S, Francois D. Geometrically precisely defined multinanometer expansion/contraction motions in a resorcin arene cavitand based molecular switch[J]. Angew Chem Int Ed,2005,44(29):4635-4638.
[15] Anthony H, Laura J M, Kristopher J E,etal. Length dependence for intramolecular energy transfer in three- and four-color donor-spacer-acceptor arrays[J]. J Am Chem Soc,2009,131(37):13375-13386.
[16] Leen V, Breaken E, Luckermans K,etal. A versatile, modular synthesis of monofunctionalized BODIPY dyes[J]. Chem Commun,2009(30):4515-4517.
[17] Yasuhiro S, Zhao Yuming, Cheng Long,etal. Facile synthesis of multifullerene-OPE hybrids via in situ ethynylation[J]. Org Lett,2004,6(13):2129-2132.
[18] Alexander N, Andrei Y K, Ulrich N,etal. Anthracene-BODIPY dyads as fluorescent sensors for biocatalytic Diels-Alder reactions[J]. J Am Chem Soc,2010,132(8):2646-2654.
[19] Rohand T, Baruah M, Qin Wenwu,etal. Functionalisation of fluorescent BODIPY dyes by nucleophilic substitution[J]. Chem Commun,2006(3):266-268.
[20] Rohand T, Qin Wenwu, Boens N,etal. Palladium-Catalyzed Coupling Reactions for the Functionalization of BODIPY Dyes with Fluorescence Spanning the Visible Spectrum[J]. Eur J Org Chem,2006(20):4658-4663.
SynthesisandCharacterizationofaNewFluorescentDyewithBODIPYandAnthracene
LI Qi, JIN Yingzhi, CHEN Dong, XU Qiao, LI Xuejiao, LIU Bin, YIN Shouchun
(College of Material, Chemistry and Chemical Engineering, Hangzhou Normal University, Hangzhou 310036, China)
The papere introduction of the anthryl group to the BODIPY dyes at 3-position then synthesized a kind of molecular antenna with anthracene as the donor and BODIPY as the acceptor by palladium catalyzed coupling reactions. All the synthetic compounds were characterized by1H NMR,13C NMR and MS and the reaction results were discussed.
BODIPY; anthracene; fluorescent dye; synthesis
2012-07-16
国家重大研究计划培育项目(91127032);国家自然科学基金面上项目(21174035);浙江省自然科学基金项目(Y4100287);杭州师范大学优秀中青年教师支持计划资助项目(HNUEYT 2011-01-019);浙江省新材料及加工工程省重中之重学科开放课题资助项目(20121109).
尹守春(1976—),男,教授,主要从事超分子化学、光电功能高分子和荧光探针方面的研究.E-mail:yinsc@ustc.edu
10.3969/j.issn.1674-232X.2013.02.013
O626.32
A
1674-232X(2013)02-0150-06
