用于亲和分离的链霉亲和素磁性高分子微球的制备
2013-10-28梁媛媛温汉华郭卫强焦艳华
梁媛媛,温汉华,郭卫强,焦艳华
(杭州师范大学生物医药与健康研究中心,浙江 杭州 311112)
用于亲和分离的链霉亲和素磁性高分子微球的制备
梁媛媛,温汉华,郭卫强,焦艳华
(杭州师范大学生物医药与健康研究中心,浙江 杭州 311112)
本文使用戊二醛作为偶联剂在氨基磁性高分子微球P(St-GMA-NH2)/Fe3O4的表面引入链霉亲合素(streptavidin,SA),制备得到链霉亲和素磁性高分子微球(P(St-GMA-SA)/Fe3O4).使用扫描电镜(SEM)、紫外光谱(UV)表征了P(St-GMA-SA)/Fe3O4的形貌与结构,探讨了反应时间,微球用量对微球表面SA引入量的影响,并考察了P(St-GMA-SA)/Fe3O4对生物素化羊抗人抗体(BIgG)的亲和吸附能力.结果表明当反应时间为12 h,P(St-GMA-NH2)/Fe3O4用量为75 mg时,SA的引入量可达到2.7 μg/mg,P(St-GMA-SA)/Fe3O4在室温下能快速和BIgG结合,最大结合量为7.4 μg/mg,P(St-GMA-SA)/Fe3O4与BIgG形成的复合物对热、酸、碱都表现出很好的稳定性.
链霉亲和素;磁性高分子微球;亲和分离
0 前 言
链霉亲和素(streptavidin,SA)是由链霉菌分泌的一种蛋白质,分子量65 kD.链霉亲和素分子由4条相同的肽链组成,肽链中的色氨酸残基能和生物素中的活性基团形成特异性结合.一个链霉亲和素分子能结合4个生物素分子,二者的亲和常数可达到2.5×1013(mol/L)-1[1],且与其他分子非特异性结合率很低,因此,表面修饰链霉亲和素的磁性高分子微球可用于捕获生物素标记的生物分子,包括生物素标记的抗原抗体和核酸、蛋白质等,在免疫检测、DNA分离检测、细胞分离、蛋白质纯化等领域显示出广阔的应用前景[2].
本文将以自制的氨基化磁性高分子微球P(St-GMA-NH2)/Fe3O4为原料,戊二醛为偶联剂,制备表面修饰链霉亲合素的磁性高分子微球P(St-GMA-SA)/Fe3O4,对其结构和性能进行表征,并考察其对生物素化羊抗人抗体(BIgG)的亲和吸附能力.
1 实验部分
1.1 试 剂
苯乙烯(St)(上海凌峰化学试剂有限公司,化学纯,减压蒸馏除去阻聚剂后使用),甲基丙烯酸缩水甘油酯(GMA)(上海静超化工有限公司,化学纯,减压蒸馏除去阻聚剂后使用),偶氮二异丁腈(AIBN)(上海试四赫维化工有限公司,化学纯,用乙醇重结晶后使用),聚乙烯吡咯烷酮(K-30)(天津天泰精细化学品有限公司),己二胺(国药集团化学试剂有限公司,分析纯),链霉亲和素(美国NEB公司),生物素化羊抗人抗体(鼎国生物试剂公司),油酸钠,乙醇,氯化铁,氯化亚铁,氨水皆为市售品.
1.2 链霉亲和素修饰的磁性高分子微球的制备
(1) P(St-GMA-NH2)/Fe3O4的制备.在5 g自制冻干的P(St-GMA)/Fe3O4磁性微球[3]中加入50 mL水和50 mL己二胺,超声10 min混合均匀后转移到250 mL三颈瓶中,机械搅拌,在80 ℃时反应12 h.将反应后的混合液进行磁分离后,用纯水洗涤多次除去多余乙二胺,冻干得到棕黄色的粉末,即P(St-GMA-NH2)/Fe3O磁性微球.
(2) SA溶液的配置.用纯水配制磷酸盐(PB)缓冲液(0.1 mol/L,pH=7.0),进行高压灭菌,将1 mg的SA溶于1 mL的PB溶液中,取200 μL装于EP管中待用.
(3) P(St-GMA-NH2)/Fe3O4分散液的配置.将50 mg P(St-GMA-NH2)/Fe3O4微球放入灭菌水中浸泡,用PB缓冲液清洗3次后,再加入2.5 mL PB,超声分散10 min后待用.
(4) SA在P(St-GMA-NH2)/Fe3O4表面的偶联.取2.5 mL P(St-GMA-NH2)/Fe3O4分散液,加入2 mL的戊二醛室温震荡反应6 h,进行磁分离,多次用大量纯水清洗多余的戊二醛后,将磁性微球重新悬浮在2.5 mL PB缓冲液中,然后再加入到装有200 μL的上述链霉亲和素溶液的EP管中,室温震荡培养6 h.最后将P(St-GMA-SA)/Fe3O4分散在5 mL PB缓冲液中(浓度为10 mg/mL),4 ℃保存待用.
1.3 P(St-GMA-SA) /Fe3O4形貌观察
采用扫描电子显微镜(SEM)观察微球的形貌,应用 SEM 照片分析微球的平均粒径E(D).按式1计算微球的平均粒径,其中,di表示微球的粒径,ni表示粒径为di时的微球个数.

(1)
1.4 链霉亲合素含量测定
(1) 配制不同浓度的链霉亲和素标准溶液,用紫外分光光度计测定其在280 nm处的吸光度值,绘制浓度-吸光度标准曲线,如图1所示.
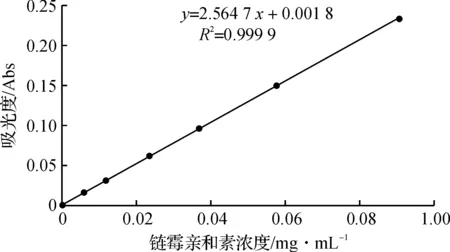
图1 链霉亲合素的浓度-吸光度标准曲线Fig. 1 Standard curve of SA solution
(2) 将一定质量的P(St-GMA-NH2)/Fe3O4微球分别放入EP管A中,加入灭菌水浸泡,用PB缓冲液清洗3次,加入2.5 mLPB超声混均后加入2 mL的戊二醛室温震荡6 h,进行磁分离,然后多次用大量水清洗多余的戊二醛.再用PB缓冲液洗涤二次,磁分离除去上清液.将1 mg的SA溶于1 mL的PB溶液中,分别取200 μL装入EP管B中,加入2.5 mL PB溶液,混合均匀,用紫外分光光度计测定其在在280 nm处的吸光度值,计为a.将上述SA溶液加入到EP管A中,室温震荡反应6 h,磁分离取上清,测定其280 nm处吸光度值,计为b.则P(St-GMA-NH2)/Fe3O4中SA的含量用式2计算.
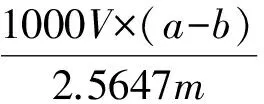
(2)
式中:ω: P(St-GMA-SA)/Fe3O4微球SA含量(μg/mg);
V: 溶液的体积(mL);
m: P(St-GMA-SA)/Fe3O4微球的质量(mg).
1.5 P(St-GMA-SA)/Fe3O4对BIgG吸附量的测定
(1) 配制不同浓度的BIgG标准溶液,用紫外分光光度计测定其在275 nm处的吸光度,绘制其浓度-吸光度标准曲线,如图2所示.

图2 BIgG的浓度-吸光度标准曲线图Fig. 2 Standard curve of BIgG solution
(2) 分别取1、2、3、4、5 mL自制的P(St-GMA-SA)/Fe3O4,装入5个EP管中(编号为1-5),磁分离除净上清液.把200 μL一定浓度的BIgG装在5个EP管中,加入2 mL PB溶液,混合均匀,用紫外分光光度计测定其在在275 nm处的吸光度,计为a;然后把它们分别加入到1-5号EP管中,室温培养0.5 h,磁分离取上清液,测定其275 nm处吸光度,计为b.则P(St-GMA-SA)/Fe3O4对BIgG的吸附量用式3计算.

(3)
式中:ω: P(St-GMA-SA)/Fe3O4微球BIgG的吸附量 (μg/mg );V:溶液的体积 (mL);m:P(St-GMA-SA)/Fe3O4微球的质量 (mg).
2 结果与讨论
2.1 SA在P(St-GMA-NH2)/Fe3O4表面的引入
使用戊二醛作为偶联剂,利用其醛基和P(St-GMA-NH2)/Fe3O4微球表面的氨基以及链霉亲合素的氨基之间发生的亲核加成反应,在磁性微球表面引入链霉亲合素,制备链酶亲和素磁性高分子微球P(St-GMA-SA)/Fe3O4.反应示意图如图3所示.

图3 P(St-GMA-NH2)/Fe3O4 表面修饰链霉亲合素示意图Fig. 3 Illustration of preparation of P(St-GMA-SA) /Fe3O4
图4是 P(St-GMA -NH2)/Fe3O4和P(St-GMA-SA) /Fe3O4的SEM照片,从图中可以看出修饰前后的磁性微球粒径和形貌未发生明显变化,说明通过戊二醛偶联反应在磁性微球表面引入链霉亲和素,对微球的形貌不会产生破坏,可满足后续实验要求.从SEM照片中选取100个微球进行统计分析,按式1计算可知P(St-GMA-SA) /Fe3O4平均粒径为2.2μm.

图4 P(St-GMA-NH2)/Fe3O4(a)和P(St-GMA-SA)/Fe3O4(b)的SEM照片Fig. 4 The SEM photographs of P(St-GMA-NH2)/Fe3O4(a) and P(St-GMA-SA)/Fe3O4(b)

图5 反应前(a)后(b)溶液的紫外吸收图谱Fig. 5 Changes of UV-Vis(a,b) spectra before and after SA entrapment
由于SA在波长280 nm处存在紫外吸收,故可以通过检测反应前后溶液在该处波长的吸光度值变化确定SA是否在P(St-GMA-NH2)/Fe3O4表面引入以及引入量,反应后残液的吸光度值越低,说明SA在P(St-GMA-NH2)/Fe3O4表面的引入量越高.反应前后的溶液紫外光谱如图5所示.从图中可以看出,反应后溶液在280 nm处的紫外吸收峰强度下降,说明溶液中游离的SA浓度下降,即部分SA引入到了P(St-GMA-NH2)/Fe3O4表面,按式2可计算得到P(St-GMA-NH2)/Fe3O4表面的SA的引入量为2.7 μg/mg.
反应结束后,去除上层残液后,再加入等量PB,震荡12 h后上清液的吸光度基本不变,说明SA通过戊二醛偶联作用共价连接于P(St-GMA-NH2)/Fe3O4,而不是以物理吸附方式作用于微球表面[4].
2.3 反应条件优化
2.3.1 反应时间
考察反应时间对SA在P(St-GMA-SA)/Fe3O4表面引入量的影响,将P(St-GMA-NH2)/Fe3O4与戊二醛的反应时间计为t1,进一步偶联SA的反应时间计为t2,实验结果如表1所示.从表1中可看出,当t2保持2 h不变,适当延长t1,SA的引入量有所增加,但延至6 h后不再增加.保持t1为6 h,随着t2的增加,SA的引入量增加,当t2等于6 h时,再延长反应时间,残液的吸光度值基本保持不变,说明SA已和P(St-GMA-NH2)/Fe3O4反应完全.故t1和t2均为6 h时,可获得具有最大SA修饰量P(St-GMA-NH2)/Fe3O4微球.
2.3.2 磁性微球用量
图6是不同用量的P(St-GMA-NH2)/Fe3O4微球对SA引入量的的影响.从中可看出,随着微球用量增加,SA的引入量增加,当微球用量为75 mg时,SA在微球表面的引入量已到达饱和,P(St-GMA-NH2)/Fe3O4表面SA的最大修饰量为2.7 μg/mg.

表1 SA引入量和反应时间的关系
t1——P(St-GMA-NH2)/Fe3O4和戊二醛的反应时间;
t2——进一步偶联SA的时间;
a——反应前SA溶液的吸光度值;

图6 SA引入量和P(St-GMA-NH2)/Fe3O4用量的关系Fig. 6 Effect of quantity of the P(St-GMA-NH2)/Fe3O4 on the SA entrapment
b——反应后上层残液的吸光度值.
2.3.3 P(St-GMA-SA)/Fe3O4对BIgG吸附作用
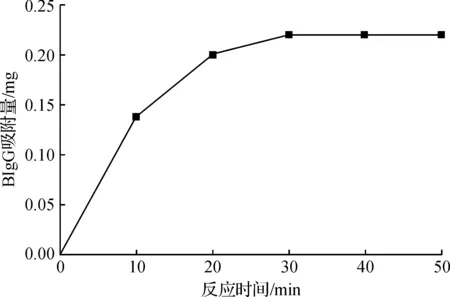
图7 P(St-GMA-SA)/Fe3O4对BIgG的吸附量与时间的关系Fig. 7 Effect of contact time on BIgG adsorption on the P(St-GMA-SA)/Fe3O4
链霉亲和素分子由4条相同的肽链组成,肽链中的色氨酸残基能和生物素中的活性基团形成特异性结合,为了考察P(St-GMA-SA)/Fe3O4对BIgG有特异亲和作用能力,考察了P(St-GMA-SA)/Fe3O4对BIgG的结合量与时间的关系,结果如图7所示.从图7中可看出,在30 min内,P(St-GMA-SA)/Fe3O4对BIgG结合量可达到7.4 μg/mg,再延长反应时间,结合量无明显变化.说明P(St-GMA-SA ) /Fe3O4微球能在较短时间内捕获溶液中游离的BIgG,其吸附容量与市售的Dynabeads® M-280磁珠相当.
为了考察P(St-GMA-SA)/Fe3O4与BIgG形成复合物的稳定性,将其分别进行如下处理:
(1) 加入PBS,在50 ℃震荡6 h.
(2) 加入HCl,调节pH值为1.0,震荡6 h.
(3) 加入NaOH,调节pH值为13.0,震荡6 h.
磁分离除去复合物,检测上层清液的紫外吸光度值,均未发生明显变化,说明P(St-GMA-SA)/Fe3O4与BIgG形成复合物未发生解离,对热、酸、碱均表现出良好的稳定性,也进一步说明了BIgG是通过与微球表面的链霉亲和素特异亲和作用而固定于微球表面,而不是通过非特异的物理吸附作用与磁性微球结合.
3 结 论
(1) 用戊二醛作交联剂,在P(St-GMA-NH2)/Fe3O4表面引入链霉亲合素,微球平均粒径为2.2 μm,粒径分布均匀.
(2) 考察了反应时间和P(St-GMA-NH2)/Fe3O4磁性微球用量对SA引入量的影响,当P(St-GMA-NH2)/Fe3O4微球偶联戊二醛,再偶联链霉亲合素的反应时间均为6 h,磁性微球用量为75 mg时,SA引入量可达到2.7 μg/mg.
(3) 考察了P(St-GMA-SA)/Fe3O4对BIgG的亲和结合能力,结果表明(St-GMA-SA)/Fe3O4能快速与BIgG结合,0.5 h内即可反应完全,BIgG最大结合量为7.4 μg/mg,所形成的P(St-GMA-SA)/Fe3O4-BIgG复合物对热、酸、碱都表现出很好的稳定性.
[1] Green N M. Avidin and strptavidin[J]. Methods Enzymol, 1990,184(3):51-67.
[2] 沈关心,周汝麟. 现代免疫学实验技术[M].武汉:湖北科学技术出版社,2002:223.
[3] 温汉华,梁媛媛,黄志坚,等.分散聚合法制备含环氧基团的磁性高分子微球[J].杭州师范大学学报:自然科学版,2011,10(2):141-144.
[4] Savage D, Mattson G, Desai S,etal. Avidin-Biotin Chemistry: A Handbook[M]. Rockford: Pierce Chemical Co,1992:79.
PreparationofStreptavidinMagenticPolymerMicrospherefortheAffinitySeparation
LIANG Yuanyuan, WEN Hanhua, GUO Weiqiang, JIAO Yanhua
(Research Centre of Biomedicine and Health, Hangzhou Normal University, Hangzhou 311121, China)
Streptavidin magnetic polymer microsphere P(St-GMA-SA)/Fe3O4was prepared by introducing bimolecular streptavidin (SA) into the surface of P(St-GMA-NH2)/Fe3O4with the aid of glutaraldehyde as crosslinking agent. The paper characterized the appearance and structure of P(St-GMA-SA)/Fe3O4by SEM and UV, discussed the influences of reaction time and microsphere amount on the intake of SA, and investigated the affinity adsorption ability of P(St-GMA-SA)/Fe3O4to BIgG.The results show that the intake of can reach to 2.7 μg/mg in 12 hours when the (St-GMA-NH2)/Fe3O4dosage is 75 mg. P(St-GMA-SA)/Fe3O4is able to combine with BIgG to form stable complexes under mild conditions, which are stabile to heat, acid and alkali, and the maximum BIgG binding capacity is 7.4 μg/mg.
streptavidin; magnetic polymer microsphere; affinity separation
2012-11-20
浙江省公益计划项目(2010C33132);杭州科技计划发展项目(20101133N04);杭州师范大学科研启动项目(PD10002004001040).
梁媛媛(1980—),女,助理研究员,博士,主要从事多功能纳米复合材料研究.E-mail:liangyy@hznu.edu.cn
10.3969/j.issn.1674-232X.2013.02.012
TB34
A
1674-232X(2013)02-0145-05
