硫化氢联合阿托伐他汀钙对血管平滑肌细胞凋亡的影响
2013-10-27曾力群沈长银袁正强
曾力群 ,沈长银 , 任 腾, 袁正强, 刘 丹
(1.遵义医学院第三附属医院 心内科,贵州 遵义 563002; 2.遵义医学院附属医院 心内科,贵州 遵义 563099)
硫化氢联合阿托伐他汀钙对血管平滑肌细胞凋亡的影响
曾力群1,沈长银2, 任 腾1, 袁正强1, 刘 丹1
(1.遵义医学院第三附属医院 心内科,贵州 遵义 563002; 2.遵义医学院附属医院 心内科,贵州 遵义 563099)
目的观察硫化氢联合阿托伐他汀钙对血管平滑肌细胞凋亡的影响。方法培养兔血管平滑肌细胞(VSMCs)3~8代,分为对照组、硫化氢组、阿托伐他汀钙组以及硫化氢联合阿托伐他汀钙组(简称联合干预组),共4组,分别给予相应干预,TUNEL法检测VSMCs的凋亡情况。结果VSMCs凋亡率:与对照组相比,硫化氢组、阿托伐他汀钙组以及联合干预组VSMCs的凋亡率均增加(P<0.01);与硫化氢组相比,联合干预组VSMCs凋亡率增加(P<0.01),阿托伐他汀钙组VSMCs凋亡率减少(P<0.01)。结论硫化氢、阿托伐他汀钙以及两者联合均可促进VSMCs的凋亡,其中以两者联合效果最为明显,硫化氢的作用强于阿托伐他汀钙。
血管平滑肌细胞凋亡;硫化氢;阿托伐他汀钙
硫化氢因其具有臭鸡蛋气味一直以来被认为是一种有毒物质,直到2002年Rui Wang等[1]报道硫化氢可能是继NO、CO的第3类内源性生理性气体信号分子,在干预动脉粥样硬化(artery atherosclerosis,AS)研究中具有独特的优势,其作用尤其表现在抑制血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增殖,诱导其凋亡方面[2]。阿托伐他汀钙是人工合成的羟甲基戊二酸单酰辅酶A(hydroxy methylglutaryl coenzyme A,HMG-CoA)还原酶抑制剂。目前阿托伐他汀钙因其具有调脂的作用,而用于心脑血管AS性疾病等的治疗中[3]。VSMCs增殖是AS性疾病形成的重要一环,阿托伐他汀钙是否可以抑制VSMCs增殖,诱导其凋亡尚存在争议,另外硫化氢联合阿托伐他汀钙对VSMCs生长的影响以及机制国内外报道较少。综上所述,本实验拟通过观察硫化氢联合阿托伐他汀钙对VSMCs生长的影响,探讨两者联合对AS形成可能存在的新的药理作用机制,为抗AS药物的研究以及临床治疗提供进一步的帮助。
1 材料与方法
1.1 实验动物和分组 健康雄性大白兔,平均体重2.2±0.4 kg(遵义医学院动物实验中心提供)将3~8代VSMCs做成细胞爬片,待细胞融合后开始干预,分为4组:A 对照组:2 mL培养液;B 阿托伐他汀钙组:浓度为1×10-6mol/L的阿托伐他汀钙1 mL+培养液1 mL干预培养的VSMCs;C 硫化氢组:浓度为1×10-6mol/L的硫氢化钠1 mL+培养液1 mL干预培养的VSMCs;D 联合干预组:浓度为1×10-6mol/L的硫化氢1 mL+浓度为1×10-6mol/L阿托伐他汀钙1 mL干预培养的VSMCs。
1.2 VSMCs原代培养 空气栓塞法处死兔子,无菌操作下取出胸主动脉, 立即置于盛有PBS的培养皿中。转入经过紫外线灭菌超净工作台内, 用PBS反复漂洗血管, 移入盛有20%胎牛血清以及双抗的DMEM完全培养液的培养皿中, 弃去血管外膜, 将血管中膜移入另一盛有完全培养液的培养皿中,用虹膜剪反复剪切中膜成针尖样大小,把组织块移入培养瓶中,以约5 mm间距将组织块均匀贴于瓶底,将培养瓶直立沿着瓶侧壁注入2.5 mL完全培养液,盖上瓶盖,将瓶底朝上放入37℃、5% CO2细胞培养箱内,拧松瓶盖使得气体可自由进入瓶中,绝对静置4~5 h后组织块与瓶底贴服不易移动,将培养瓶慢慢翻平,使得培养液完全浸没组织块,绝对静置孵育4~5 d。见有呈梭形细胞从组织块边缘游出后更换培养液, 每2天换液1次, 半量或2 /3量换液。
1.3 VSMCs传代培养 当大部分组织块长出细胞晕, 相互间融合占培养瓶70%~80%时即可传代。吸弃培养液, 用PBS液清洗生长有细胞的培养瓶瓶底2 次, 再向瓶底加入2~3滴0.25% 胰蛋白酶液,在显微镜下观察细胞消化情况,见细胞收缩变圆,有的细胞漂浮后立即翻转培养瓶,加入2 mL完全培养液完全终止消化,并用吸管反复吹打瓶壁使细胞脱落,将细胞液转入离心管中, 1000 r/min离心5 min,倒掉上清液, 加入完全培养液2.5 mL, 吹打成细胞悬液, 镜下计数使接种细胞密度保持于1×106/L,继续37℃、5% CO2细胞培养箱培养,每天显微镜下观察细胞生长增殖情况,隔天换液1次。待细胞生长状况良好且铺满培养瓶底时再传代,组织块随第1次传代以及之前的换液而去除。
1.4 VSMCs的鉴定 细胞免疫化学染色:将3~5代细胞做成细胞爬片,待细胞融合后弃培养液, PBS洗涤5 min×2次;4%多聚甲醛固定30 min,用PBS洗涤5 min×2次;0.3% Triton- X- 100孵育30 min,以增加细胞膜的抗原通透性,用PBS洗涤5 min×2次;3%H2O2去离子水孵育10 min,用PBS洗涤5 min×2次;鼠抗兔α-平滑肌肌动蛋白抗体(1:300)4℃孵育,过夜,第2天复温 37℃,45 min,用PBS洗涤5 min×2次;山羊抗小鼠IgG抗体-HRP多聚体37℃孵育,30 min,用PBS洗涤5 min×2次;DAB染色约5 min(在显微镜下观察染色情况,待镜下见棕色)立即用PBS洗涤;苏木素复染15 min(显微镜下见核染成深蓝色),自来水冲洗,盐酸酒精返蓝,梯度酒精以及二甲苯脱水。烤干、用封片剂封片。
1.5 检测VSMCs凋亡 分组干预后24 h后用凯基一步法TUNEL细胞凋亡原位检测试剂盒检测各组VSMCs凋亡情况,重复实验3次。
2 结果
2.1 VSMCs的原代培养 在倒置显微镜下观察,原代培养3~5 d后见少量细胞从组织块周围游出,大小不等,形态各异(梭形、不规则形、多角形),可见少量成“铺路石”样改变的内皮细胞。再绝对静置3~5 d见细胞增多,组织块之间的细胞汇合,多数细胞生长呈梭形,平行排列成单层,部分区域可见细胞叠层排列,高低起伏,形成典型的“峰-谷”现象。
2.2 VSMCs的传代培养 传代培养后细胞的形态更趋向一致,呈梭形,按照接种密度为1×106/L传代后细胞生长较快,隔天换液1次,3 d即可铺满培养瓶底70%~80%,即可传代。
2.3 VSMCs的鉴定 用第6代细胞进行细胞免疫化学染色后,在高倍显微镜下见苏木素将胞核染成紫色,呈卵圆形居于细胞中央,胞质内有大量被染成棕色与细胞长轴平行的纤维细丝,即α-平滑肌肌动蛋白丝。
2.4 VSMCs凋亡的检测 荧光显微镜观察,淡绿色荧光为正常细胞,黄绿色荧光则为凋亡细胞,分别计数同一视野荧光显微镜下总的细胞数以及凋亡细胞数。凋亡率=凋亡细胞数/总的细胞数。与对照组相比,硫化氢组、阿托伐他汀钙组以及联合干预组VSMCs的凋亡率均增加(P<0.01);与硫化氢组相比,联合干预组VSMCs凋亡率增加(P<0.01),阿托伐他汀钙组VSMCs凋亡率减少(P<0.01)(见表1,图1)。
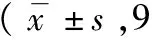
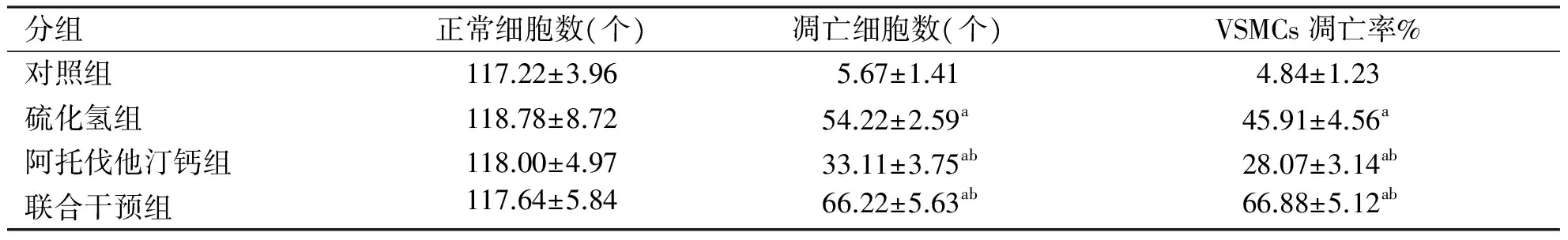
分组正常细胞数(个)凋亡细胞数(个)VSMCs凋亡率%对照组117.22±3.965.67±1.414.84±1.23硫化氢组118.78±8.7254.22±2.59a45.91±4.56a阿托伐他汀钙组118.00±4.9733.11±3.75ab28.07±3.14ab联合干预组117.64±5.8466.22±5.63ab66.88±5.12ab
注: 与对照组相比,aP<0.01;与硫化氢组相比,bP<0.01。

注:箭头所指即为凋亡细胞A:对照组;B:硫化氢组;C:阿托伐他汀钙组;D:联合干预组。 图1 TUNEL法检测各组平滑肌细胞的凋亡(×200)
3 讨论
VSMCs存在于血管中膜, 是构成血管并维持其正常生理功能的物质基础, 是决定血管活性、血管构型及维持血管张力的重要因素。VSMCs的代谢、功能的改变、表型转化、异常增殖、迁移与动脉粥样硬化、高血压、动脉成形术后血管再狭窄等的发生发展密切相关。而VSMCs体外培养是研究上述疾病和筛选相关治疗药物中必不可少的环节。目前, 原代培养VSMCs的方法主要有酶消化培养法和组织贴壁法。本实验采用组织贴壁法,通过细胞免疫组化染色进行鉴定,显示成功培养出了VSMCs。
既往的研究表明硫化氢可通过激活ERK和p21Cip/WAK-1的活性,来实现抑制细胞增殖的目的,研究的进一步深入发现,硫化氢是通过使ERK和p21Cip/WAK-1磷酸化,激活了caspase-3的活性诱导HASMCs的凋亡[4]。Li等[5]研究硫化氢对肺动脉高压时PASMCs凋亡的影响,用TUNEL法检测凋亡细胞,免疫化学染色检测PASMCs中Fas,bcl-2和caspase-3的表达,发现硫化氢通过激活Fas通路,抑制bcl-2通路,诱导PASMCs的凋亡。NF-κB是一种凋亡转录因子,Sen N等人新证实了催化生成硫化氢的CSE具有调节NF-κB的活性的作用[6]。关于他汀类药物抑制细胞增殖的作用,Diehtl等[7]研究发现他汀类药物可以抑制血管内皮细胞因子和VSMCs中NF-κB 的活性, 起到抗炎、抗增殖的作用。Min Li等[8]发现他汀类药物可抑制VSMCs细胞核的有丝分裂、迁移,从而诱导凋亡。Xu等[9]体外培养VSMCs,通过检测VSMCs凋亡率和VSMCs中的生存素(Survivin),结果发现阿托伐他汀钙组VSMCs凋亡显著增加,且和剂量以及时间呈正比,VSMCs中Survivin 6h开始下降,24~48h消失。故可以认为阿托伐他汀钙通过抑制Survivin的表达而诱导VSMCs的凋亡。本实验证实了硫化氢、阿托伐他汀钙,均具有促进VSMCs凋亡的作用,同时发现两者联合干预促进细胞的凋亡的作用更明显。硫化氢可能是通过上述的磷酸化ERK和p21(Cip/ WAK-1),激活NF-κB活性等来抑制VSMCs的增殖,诱导其凋亡;阿托伐他汀钙可能是通过激活凋亡基因Fas、抑制Survivin的表达、激活NF-κB活性等来抑制VSMCs的增殖,诱导其凋亡,故两者联合干预不仅加强了NF-κB活性,还分别从激活凋亡基因Fas、抑制Survivin的表达、磷酸化ERK和p21Cip/WAK-1等多个环节叠加作用,从而联合干预VSMCs的凋亡率是最高的。
[1] Wang,R.Two′s company, three's a crowd:Can H2S be the third endogenous gaseous transmitter[J]. FASEB J,2002,16(13):1792-1798.
[2] Lavu M, Bhushan S, Lefer D J.Hydrogen sulfide-mediated cardioprotection: mechanisms and therapeutic potential[J].Clin Sci (Lond),2011,120(6):219-229.
[3] Liu B, Cao H M, Li G Y, et al.Effects of rosuvastatin versus atorvastatin on rho-associated coiled-coil containing protein kinase activity and endothelial function in patients with atherosclerosis[J].J Int Med Res,2011,39(6):2314-2322.
[4] Yang G,Sun X,Wang R.Hydrogen sulfide-induced apoptosis of human aorta smooth muscle cells via the activation of mitogen-activated protein kinases and caspase-3[J].FASEB J,2004, 18(14).1782-1784.
[5] Li W, Jin H F,Liu D,et al.Hydrogen sulfide induces apoptosis of pulmonary artery smooth muscle cell in rats with pulmonary hypertension induced by high pulmonary blood flow[J].Chin Med J (Engl),2009,122(24):3032-3038.
[6] Sen N, Paul B D, Gadalla M M, et al.Hydrogen sulfide-linked sulfhydration of NF-κB mediates its antiapoptotic actions[J].Mol Cell,2012,45(1):13-24.
[7] Dichtl W, Dulak J , Frick M, et al. HMG-CoA reductase Inhibitors regulate Inflammatory.transcription factors in human endothelial and vascular smooth muscle cells[J]. Arterioscler Thromb Vasc Biol, 2003,23 (1):58-63.
[8] Li M,Liu Y,Dutt P,et al.Inhibition of serotonin-induced mitogenesis, migration, and ERK MAPK nuclear translocation in vascular smooth muscle cells by atorvastatin[J].Am J Physiol Lung Cell Mol Physiol,2007,293(2):463-471.
[9] Xu Y G, Zhou S H,Li Y G,et al.The mechanism underlying vascular smooth muscle cell apoptosis induced by atorvastatin may be mainly associated with down-regulation of survivin expression[J].Cardiovasc Drugs Ther,2007,21(3):145-153.
[收稿2013-10-31;修回2013-11-20]
(编辑:谭秀荣)
Effectofhydrogensulfideandatorvastatincalciumonrabbitsvascularsmoothmusclecells
Zengliqun1,Shenchangyin2,Renteng1,Yuanzhengqiang1,Liudan1
(1.Department of Cardiology,The Third Affiliated Hospital of Zunyi Medical University, Guizhou Zunyi 563002,China;2. Department of Cardiology,The Affiliated Hospital of Zunyi Medical University, Guizhou Zunyi 563099,China)
ObjectiveTo explored the effect of hydrogen sulfide (H2S) and atorvastatin calcium on apoptosis of rabbits vascular smooth muscle cells.MethodsCultured vascular smooth muscle cells (3-8 generations),were divided into 4 groups:control groups, H2S group,atorvastatin calcium group,the combination group. Vascular smooth muscle cells apoptosis was examined after 24 hours using TUNEL assay.Resultscompared with the control group, H2S group, atorvastatin calcium group, the combination group had increase vascular smooth muscle cells apoptosis (P<0.01); compared with H2S group, the combine group had increased vascular smooth muscle cells apoptosis, atorvastatin calcium group had reduced vascular smooth muscle cells apoptosis (P<0.01).ConclusionH2S, atorvastatin calcium and the combination of both can accelerate vascular smooth muscle cells apoptosis. The combination of both is the best, and the effect of H2S is better than atorvastatin calcium.
smooth muscle cells apoptosis; hydrogen sulfide; atorvastatin calcium
R363
A
1000-2715(2013)06-0542-04
