C-met和COX-2在非小细胞肺癌中的表达与临床意义
2013-10-26王风婷
王风婷
C-met和COX-2在非小细胞肺癌中的表达与临床意义
王风婷
(井冈山大学临床医学院,江西,吉安 343000)
探讨非小细胞肺癌中C-met和COX-2表达及其临床意义。收集2010年1月至2012年6月存档的NSCLC石蜡标本60例肺癌组织和20例相对应癌旁正常肺组织。采用免疫组化方法分别检测肺癌组织及癌旁正常肺组织中C-met和COX-2的表达情况。C-met和COX-2在NSCLC中的表达显著高于癌旁正常组织;C-met和COX-2在NSCLC中的过表达和病理类型、有无淋巴结结转移以及TNM分期有密切相关性;C-met还与病理分级相关;C-met和COX-2两者在NSCLC中的表达呈正相关性。C-met和COX-2可能在NSCLC的发生、发展过程中起了重要的作用,C-met和COX-2可能成为肺癌早期诊断、预后评估的生物标志物。两者的显著相关性提示C-met和COX-2两者在NSCLC的发生、发展中存在相互作用,为探讨非小细胞肺癌发病机制以及探寻非小细胞肺癌治疗新途径提供实验依据。
C-met; COX-2;非小细胞肺癌;免疫组织化学
根据世界卫生组织2006年公布的资料显示,每年因肺癌死亡的人数超过120万,肺癌已经成为威胁人类健康的主要癌症杀手,而非小细胞肺癌(non-small cell lung cancer, NSCLC)占全部肺癌的80%~85%[1]。目前,围绕肺癌相关基因所展开的研究以及以抑制肿瘤血管生成的治疗策略已成为肺癌领域备受关注的热点,为肺癌的筛查和早期诊断以及治疗提供了新方向。C-met是一种由C-met原癌基因编码的蛋白产物,为肝细胞生长因子(hepatocyte growth factor,HGF)上皮特异性受体,可调控一种“侵袭性生长”的侵袭遗传程序[2]。HGF通过激活C-met完成多种功能,例如促进细胞增殖、转移、以及调节血管形成和形态发生等[3-4]。环氧化酶(circle- oxidationase ,COX)是前列腺素(PGs)合成过程中的重要限速酶,目前已发现两种同工酶:COX-1和COX-2。COX-2为诱导酶,在正常组织中很少表达,当细胞受到各种刺激因素如细胞因子、生长因子、促癌剂等刺激后开始表达,参与炎症或肿瘤等病理过程。C-met和COX-2两者在肺癌中的相互作用,迄今尚未见文献报道。本研究意探讨非小细胞肺癌中C-met和COX-2表达及其临床意义。
1 材料与方法
1.1 材料
本研究60例肺癌组织和20例相对应癌旁正常肺组织均取自井冈山大学附属医院及南昌大学第一附属医院病理科2010年1月至2012年6月存档的NSCLC石蜡标本。所有标本均来自胸外科住院的NSCLC病例,临床资料完整,且术前均未接受过化疗、放疗或生物学治疗;经胸外科手术切除,均有对应的HE染色切片明确病理诊断。对照组为20例癌旁正常肺组织。
所用兔抗人C-met多克隆抗体和兔抗人COX-2单克隆抗体(编号ZA-0412)均为Santa Cruz公司产品;DAB显色液购自北京中衫金桥生物技术公司。
1.2 方法
1.2.1 取材
将选好石蜡标本均4 µm厚度连续切片,将载玻片置于烤箱中烘烤,60 ℃,30 min。
1.2.2 C-met 和COX-2检测
本实验采用Elivision免疫组化法,按下列操作步骤进行:脱蜡、水化:阻断灭活内源性过氧化物酶:3%H2O2;高压煮沸抗原修复;滴加一抗(C-met/COX-2)(用PBS缓冲液代替一抗作阴性对照);滴加生物素标记二抗 37 ℃孵育30 min;DAB显色;复染、1%盐酸酒精分化、脱水、透明、封片、镜检。阳性对照:C-met为乳腺癌标本,COX-2为肺癌标本。用PBS缓冲液代替一抗作阴性对照。
1.2.3 结果判断
在光学显微镜,棕黄色颗粒或棕褐色颗粒为阳性信号,均无背景着色。为每张切片在高倍镜下随机选择5个不同的视野,根据染色强度和阳性细胞数,按Fromowitz阳性细胞半定量分级法, 先计算阳性细胞所占百分率并打分:<6%为0分;6%~25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。然后根据阳性细胞染色强度打分:阴性为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。最后将两者分数相加,0~1分为阴性(-),2~3分为弱阳性(+),4~5分为中度阳性(++),6~7分为强阳性(+++)(部分病例见附图1-4)。
1.2.4 统计学处理
采用SPSS 12.0 软件进行统计学处理,计数资料数据以±表示,均数比较采用检验,率的比较采用χ2检验,采用Spearman进行相关性分析,< 0.05为差异有统计学意义。
2 结果
2.1 C-met和COX-2在正常肺组织和NSCLC组织中的表达
实验组和对照组在年龄(= 1.241 ,= 0.218)和性别(χ2= 0.00,= 1.00)构成上的差异无统计学意义,数据具有可比性。
2.1.1 C-met在正常肺组织和NSCLC组织中的表达

表1 C-met在NSCLC组织和癌旁正常肺组织中的表达情况
2.1.2 COX-2在正常肺组织和NSCLC组织中的表达

表2 COX-2在NSCLC组织和癌旁正常肺组织中的表达情况
2.2 C-met和COX-2在NSCLC组织中表达与临床、病理参数的关系
2.2.1C-met在NSCLC组织中表达与临床、病理参数的关系

表3 c-met在NSCLC组织中表达与临床、病理参数的关系
*病理分级不包括6例分级不详病例:肺泡癌3例、鳞腺癌2例、大细胞未分化癌1例。
2.2.2 COX-2在NSCLC组织中的表达与临床、病理参数的关系

表4 COX-2在NSCLC组织中表达与临床、病理参数的关系
*病理分级不包括6例分级不详病例:肺泡癌3例、鳞腺癌2例、大细胞未分化癌1例。
2.3 C-met和COX-2表达的相关性
通过比较分析资料可知37例C-met阳性病例和43例COX-2阳性病例中,有33例为同一标本C-met和COX-2两者共同表达阳性。采用Spearman相关性分析显示,C-met和COX-2在NSCLC中表达呈正相关性(= 0.981,= 0.000)。
3 讨论
目前,HGF/C-met通路被认为是人类肿瘤最常发生异常的信号通路之一。研究显示,在肝癌、胃癌等大多数实体瘤及血液恶性肿瘤中均观察到异常的HGF/C-met信号转导通路[5-6]。Ponzo[7]等通过在大鼠实验模型中种植恶性肿瘤细胞,观察到C-met基因突变,提示C-met基因突变在肿瘤发生过程中可能起重要作用。C-met与肺癌的作用还处于研究阶段。Lutterbach等[8]通过检测C-met在NSCLC细胞系中的表达情况,观察到C-met在非小细胞肺癌细胞系中过度表达,而且表达水平高于对照组约2.5倍。Tsao[9]等通过检测非小细胞肺癌中C-met表达,结果显示C-met在NSCLC中呈高表达,腺癌表达率高于鳞癌。Masuya[10]等研究报道C-met与NSCLC临床分期明显相关。艾婷等[11]则观察到NSCLC中C-met的表达与组织分化程度有关,与性别、年龄、吸烟、病理类型、肿瘤大小、淋巴结转移情况以及TNM分期均无关。本研究运用Elivision免疫组化法检测60例NSCLC组织和20例癌旁正常组织中C-met表达情况。60例NSCLC组织中37例表现为阳性,所占比为61.7%,20例正常组织中仅4例为(+),所占比为20%,两组表达有显著差异(χ2= 10.432,= 0.001)。实验结果显示,腺癌23例病例中18例表达阳性,阳性率78.3%,其中(+)、(++)、(+++)分别为1例、5例、12例;34例鳞癌病例中17例阳性,阳性率50.0%,其中(+)、(++)、(+++)分别为3例、11例、3例,两者有统计学差异(χ2= 4.623,= 0.032)。结果显示C-met表达与NSCLC组织学类型有相关性,提示C-met对腺癌的影响大于鳞癌。和Tsao[9]等研究结果一致。表3中C-met阳性表达分配结果显示腺癌表达强度似乎比鳞癌更强,有待于进一步研究证实。本研究结果显示非小细胞肺癌中C-met表达与病理分级、淋巴结转移、TNM分期亦相关,病理分级Ⅲ级,TNM分期Ⅲa期,淋巴结转移阳性的NSCLC组织中C-met的表达阳性率更高,提示C-met在NSCLC侵袭、转移中起一定作用,参与了NSCLC的进展。非小细胞肺癌患者伴有淋巴结转移和较高临床分期意味着预后不良,C-met的表达可能和NSCLC患者的预后有一定的关系,可作为一个潜在的肺癌分期及预后标志物。
COX-2存在于多种恶性肿瘤中。Richardsen等[12]研究显示COX-2在原发性前列腺癌组织中存在高表达。Balraj Singh等[13]研究提示COX-2与乳腺癌形成有关。国内外很多研究[14-15]报道COX-2在NSCLC中的高表达,表达率为70%-93.58%,以腺癌表达更显著。本研究结果如表2所示20例正常组织中仅2例COX-2表达为(+),阳性率为10%;60例NSCLC组织中43例表现为阳性,阳性率为71.7%。结果提示COX-2表达与NSCLC有关。进一步分析显示COX-2在NSCLC中表达和病理类型、淋巴结转移、TNM分期相关。腺癌、有淋巴结转移、Ⅲa期的病例均明显高于鳞癌、无淋巴结转移、I~II期的病例。结果还显示,病理分级Ⅲ级病例比I~II级病例表达率高,分别为78.3%和67.7%,但无统计学意义(χ2= 0.728,= 0.393)。结果提示COX-2和NSCLC的发生、发展及预后相关,可能参与了NSCLC肿瘤的形成和转移,可作为一个潜在的肺癌分期及预后标志物。可能的机制是COX-2可促进新生血管的形成,为肿瘤的生长提供了营养从而加速肿瘤细胞的生长并侵犯血管进入血液循环向远处转移。
研究表明C-met和COX-2在胃癌、肝癌等多种恶性肿瘤中存在相互作用,Chen JH[16]等通过检测30例胃癌组织标本C-met、COX-2的表达,结果显示两者均高表达且明显相关。Herrera等[17]研究报道在COX-2过表达的食管癌细胞中,抑制COX-2导致C-met的表达相应下降。上述研究表明,在肿瘤细胞中COX-2和C-met二者存在相互作用。目前C-met和COX-2两者在肺癌中的相互作用,尚未见文献报道。本研究通过免疫组化检测60例NSCLC组织中C-met和COX-2表达情况,结果显示37例C-met阳性病例和43例COX-2阳性病例中,有33例为同一标本C-met、COX-2两者共同表达阳性。应用Spearman相关性分析显示,C-met和COX-2在NSCLC中表达呈正相关性(r = 0.981,= 0.00)。可能的机制为HGF激活C-met, 增强了HGF/C-met 信号转导,进而影响COX-2表达,COX-2再激活VEGF表达,促进血管生成。即可能通过HGF-C-met-COX-2-VEGF途径促进肺癌肿瘤血管生成,从而促进肿瘤生长、浸润和转移。两者的显著相关性提示两者在NSCLC的发生、发展中存在相互作用,为进一步探讨NSCLC发病机制以及探寻非小细胞肺癌治疗新途径提供实验依据。
附图:

图1 24#病例低分化鳞癌(病理号439729)C-met表达(+++) Nikon 55i 10×10

图2 25#病例低分化腺癌(病理号439177)C-met表达(+++) Nikon 55i 40×10

图3 25#病例低分化腺癌(病理号439177)COX-2表达(+) Nikon 55i 10×10
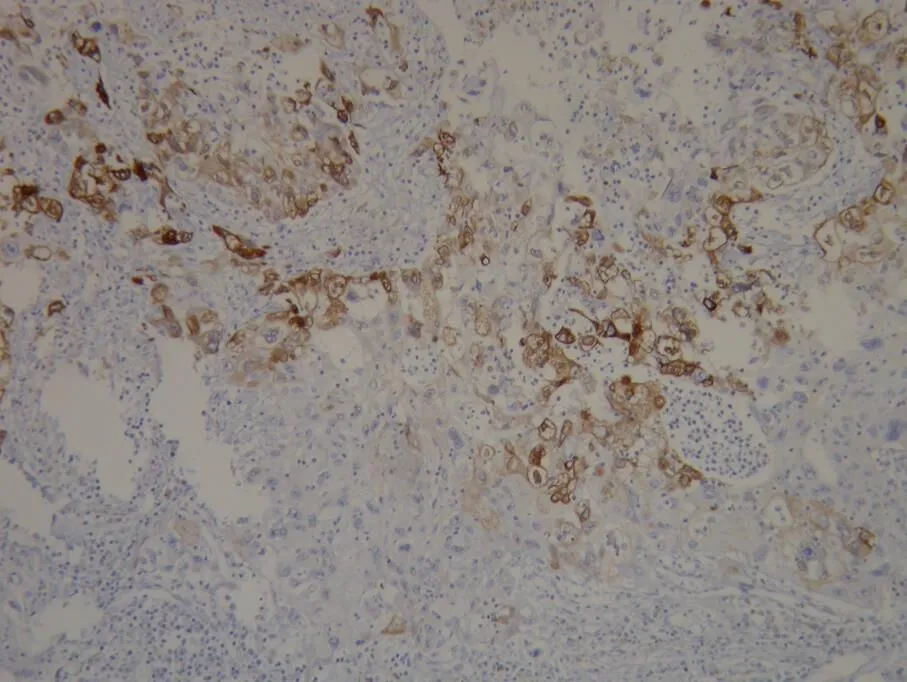
图4 18#病例低分化鳞癌(病理号452811)COX-2表达(++) Nikon 55i 10×10
[1] 刘又宁.呼吸内科学高级教程[M].北京:人民军医出版社,2009:390-416.
[2] Stella M C,Trusolino L,Pennacchietti S,et al .Negative feedback regulation of Met-dependent invasive growth by Notch[J].Molecular and Cellular Biology,2005,25: 3982-3996.
[3] Ma P C, Maulik G, Christensen J, et al .C-met: structure, functions and potential for therapeutic inhibition[J]. Cancer Metastasis Rev,2003,22(4):309-325.
[4] Maulik G,Shrikhande A,Kijina T,et al.Role of the hepatocyte growth factor receptor,c-Met,in oncogenesis and potential fou therapeutic inhibition[J].Cytokine Growth Factor Rev,2002, 13(1):41-59.
[5] Parkin D M,Bray F,Ferlay J,et al ,Global cancer statistics,2002[J].CA Cancer J Clin,2005,55;74-108.
[6] Christensen JG,Burrows J,Salgia R.C-met as a target for human cancer and characterization of inhibitors for therapeutic intervention[J].Cancer Lett,2005,225(1):1-26.
[7] Ponzo MG,Lesurf R,Perkiewicz S,et al.Met induces mammary tumors with diverse histologies and is associated with poor outcome and human basal breast cancer[J].Proc Natl Acad Sci U S A,2009,106(31); 12903-12908.
[8] Lutterbach B,Zeng Q,Davis LJ,et al,Lung cancer cell lines harboring Met gene amplification are dependent on Met for growth and survival[J].Cancer Res March,2007, 67:2081-2088.
[9] Tsao MS ,Yang Y,Marcus A,et al.Hepatocyte growth factor is predominantly expressed by the carcinoma cells in non-small-cell lung cancer[J].Hum Pathol,2001,32(1);57-65.
[10] Masuya D,Huang C,Liu D,et al.The tumour–stromal interaction between intratumoral c-Met and stromal hepatocyte growth factor associated with tumour growth and prognosis in non-small-cell lung cancer patients[J].British Journal of Cancer, 2004,90(8); 1555-1562.
[11] 艾婷,王宁.表皮生长因子受体和肝细胞生长因子受体在非小细胞肺癌中的表达及其预后的关系[J].中华肿瘤杂志,2010,32(11):825-829.
[12] Richardsen E,Uglehus R D,et al. COX-2 is overexpressed in primary prostate cancer with metastatic potential and may predict survival.A comparison study between COX-2,TGF-β,IL-10 and Ki67[J].Cancer Epidemiology, 2010,34:316-322.
[13] Balraj Singh,P h.D.,Kendra R,et al.Role of COX-2 in Tumorospheres Derived from a Breast Cancer Cell Line[J].Journal of Surgical Research, 2011,168:39-49.
[14] Fang H Y,Lin T S,Lin J P,et al. Cyclooxygenase-2 in human non-small cell lung cancer[J].Eur J Surg Oncol, 2003,29(12):171-177.
[15] Petkova D K,Clelland C,Ronan J,et al.Overexpression of cyclooxygenase-2 in non-small cell lung cancer [J].Respir Med,2004,98(2);164-172.
[16] Chen J H,Wu CW,Kao H L,et al.Effects of COX-2 inhibitor on growth of human gastric cancer cells and its relation to hepatoxyte growth factor[J].Cancer Lett,2006, 239(2):263-270.
[17] Herrera L J,EL-Hefnawy T,Queiroz de Olieira P E,et al.The HGF receptor c-MET is overexpressed in esophageal adenocarcinoma[J].Neoplasia,2005,7(1):75- 84.
EXPRESSION AND CLINICAL SIGNIFICANCE OF C-MET AND COX-2 IN NON-SMALL CELL LUNG CANCER
WANG Feng-ting
(School of Clinical medicine, Jinggangshan University, Ji’an, Jiangxi 343000, China)
: To discuss the expressions and clinical significance of C-met and COX-2 in NSCLC.: 60 samples of NSCLC tissue and 20 samples of normal lung tissue were selected from January in 2010 to June in 2011. The expressions of C-met and COX-2 in NSCLC and normal lung tissue were detected by immunohistochemical method.: C-met and COX-2 expression in NSCLSC were significantly higher than that in peri-cancer normal lung tissue. The over-expression of C-met and COX-2 in NSCLC was close correlative with pathological types, metastasis, TNM stage; The correlation for expression of C-met and COX-2 in NSCLC was positive.: C-met and COX-2 play a very important role in the occurrence and progress of NSCLC. C-met and COX-2 may become biomarker of early diagnosis and prognostic evaluation. The significant correlation between them shows their interaction in NSCLC happen and development, which provides experimental data for exploring a new method of the therapy of NSCLC.
C-met; COX-2; Non-Small Cell Lung Cancer (NSCLC); immunohistochemistry
R734.2
A
10.3969/j.issn.1674-8085.2013.01.021
1674-8085(2013)01-0095-06
2012-06-12;
2012-10-28
王风婷(1976-),女,江西吉安人,副主任医师、讲师,硕士,主要从事呼吸内科、肺部肿瘤研究(E-mail: 7666wft@sina.com)
