海洋真菌Penicillium oxalicum SCSGAF 0023的次生代谢产物及其抗污损和酶抑制活性研究
2013-10-25孙玉林徐新亚张晓勇郑智慧农旭华漆淑华
孙玉林,陈 茵,徐新亚,张晓勇,郑智慧,农旭华,鲍 洁,漆淑华*
1中国科学院南海海洋研究所中国科学院海洋生物资源可持续利用重点实验室广州 510301;2中国科学院大学,北京 100049;3深圳市第九人民医院,深圳 518116;4华北制药集团新药研究开发有限责任公司,石家庄 050011
海洋是生命的起源,蕴藏着丰富的微生物资源。海洋微生物由于受其特殊的生存环境影响(高盐、高压、低温及寡营养等),在进化过程中形成了特异的遗传背景和代谢途径 ,从而产生并积累了大量的具有特殊化学结构和生理活性的物质,是开发新药的重要资源[2]。海洋真菌是海洋微生物的重要组成部分,其次生代谢产物的化学研究工作虽然起步较晚,但发展迅速。1945年,Giuseppe Brotzu从一株海洋来源的顶头孢霉 (Acremonium chrysogenum)中分离得到了具有抗菌活性的化合物cephalosporin C标志着海洋真菌次级代谢产物研究的开始[3]。从1991开始,海洋真菌次级代谢产物的研究进入一个活跃时期,到2002年已发现新天然产物272个,2005年约达到400个,2011年则已经超过1300个,化合物的类型涉及到聚酮、生物碱、萜类、肽类、甾体等[4,5],其中一些表现出良好的抗菌、抗肿瘤、抗病毒等生物活性。基于结构和生物活性的多样性,本实验对南海柳珊瑚Dichotella gemmacea的一株共附生真菌Penicillium oxalicum SCSGAF 0023的次生代谢产物进行了研究。有研究表明:柳珊瑚栖息在海洋而不被其它污损生物附着,与其共附生微生物分泌的次生代谢产物有关,这些代谢产物有可能成为开发成天然的防污剂[6]。此外,酶抑制剂作为一种工具,能更好的理解疾病的代谢途径和确定靶标位点,如蛋白质酪氨酸磷酸酶PTPIB在胰岛素信号传导过程中起负调节作用[7],次黄嘌呤单磷酸脱氢酶(IMPDH)能特异地抑制T B淋巴细胞的增值,对各种有丝分裂素引起的细胞分裂也具有抑制作用[8],组织蛋白酶Cathepsin B存在各种动物组织的细胞内,起到催化苯甲酰-L-精氨酰胺的水解和具有内切酶的作用[9]。本文对分离到的化合物进行了上述的活性测试,期望能寻找到具有较好活性的先导化合物。
1 材料与方法
1.1 仪器与材料
Brucker Avance DRX 500型核磁共振波谱仪(500/125 MHz,TMS为内标);高效液相色谱仪:岛津LC-20A,YMC-Pack,ODS S-5μ 250×10 mm i.d,SPD-M20A检测器;SephadexLH-20(Pharmacia Biotech Sweden);柱色谱用硅胶 (100~200目,200~300目)、TLC及PTLC(GF254)硅胶板均为烟台江友硅胶开发有限公司生产,所用试剂均为分析纯产品。
真菌Penicillium oxalicum SCSGAF 0023从南海柳珊瑚Dichotella gemmacea中分离得到,该样品采自于中国海南三亚 (18°11'N,109°25'E),水深5~10 m,菌种保存于中国科学院海洋微生物中心,保藏号为:JN850988。
PDA液体培养基:葡糖糖2%,土豆20%,3%海盐,121℃灭菌30 min备用。
1.2 实验方法
1.2.1 菌株的鉴定
真菌 Penicillium oxalicum SCSGAF 0023的总DNA按照文献[10]被提取出来,分别用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3'),ITS4(5'-TCCTCCGCTTATTGATATGC-3')对总DNA中的ITS序列进行PCR扩增,回收纯化PCR产物,在连接到PCR2.1载体(Invitrogen)中,16S rRNA基因序列由上海美吉生物医药科技有限公司测定,将测出来的16S rRNA基因序列进行BLAST分析(http://blast.ncbi.nlm.nih.gov/)发现与Penicillium oxalicum strain F3(JF793525.1)相似度为99%。
1.2.2 菌株的发酵培养
从PDA固体培养基的平板上,用接种环刮取2环该菌株的孢子于500 mL的三角瓶中 (内含150 ml的PDA液体培养基),共接种200瓶,28℃静置30 d。
1.2.3 发酵产物的提取与分离
将30 L发酵液用八层纱布过滤,分成菌液和菌丝体两部分,菌液直接用乙酸乙酯进行萃取浓缩,菌丝体先用80%丙酮-水浸泡,接着用细胞破碎仪进行破壁,之后超声30 min,减压浓缩,将剩下的水相再用乙酸乙酯进行萃取,最后将两部分的乙酸乙酯浓缩产物合并称重,共得到浸膏16 g。
将乙酸乙酯萃取的浸膏16 g经硅胶(80~100目)柱层析,以氯仿/甲醇 (1∶0~0∶1)系统进行梯度洗脱,结合薄层色谱 (TLC)点板情况,合并为六个流分 (Fr 01~Fr 06)。
流分Fr 01(3 g)经硅胶 (100~200目)柱层析,以氯仿/丙酮 (20∶1~0∶1)梯度进行洗脱,得到4个亚流分 (Fr 0101~Fr 0104),亚流分Fr 0101经反相硅胶 (RP-18,80~100 μ)柱层析,以甲醇/水(v/v 20∶80~80∶20)进行梯度洗脱得到化合物1(v/v 80∶20,6 mg),亚流分 Fr 0102 经硅胶 (200 ~300目)柱层析,以石油醚/氯仿(v/v 9∶1)进行等度洗脱,得到化合物2(46 mg)。
流分Fr 03(2.4 g)经硅胶(100~200目)柱层析,以氯仿/丙酮 (9∶1~0∶1)系统进行梯度洗脱,得到5个亚流分 (Fr 0301~Fr 0305),亚流分Fr 0302(478.6 mg)再经过Sephadex LH-20柱层析,得到化合物 3(6 mg)和 4个亚流分 (Fr 030202~Fr 030205);亚流分Fr 030202~Fr 030205分别经半制备HPLC进一步纯化,得到化合物6(YMC-Pack,ODS S-5μ 250 × 10 mm i.d.,3 mL/min,甲醇/水(v/v 77∶23),tR=9.5 min,2.5 mg)、5(甲醇/水(v/v 74∶26),tR=8.9 min,3.5 mg)、4(甲醇/水(v/v 78∶24),tR=21.5 min,3.5 mg);亚流分 Fr 0303(717.2 mg)经Sephadex LH-20柱层析,得到4个亚流分 (Fr 030301~Fr 030304),亚流分 Fr 030302经反相硅胶(RP-18,80 ~100 μ)柱层析,以甲醇/水(v/v 15∶85~45∶55)进行梯度洗脱,在甲醇/水(v/v 35∶65)流分中得到化合物16(4.5 mg),亚流分Fr 030304经半制备HPLC进一步纯化得到化合物 7(乙腈/水(v/v 70∶30),tR=21.5 min,3 mg);亚流分Fr 0304通过制备型薄层板进行制备,得到化合物8(氯仿∶甲醇 =20∶1展开,Rf=0.55,10 mg);亚流分Fr 0305通过重结晶得到化合物10(3.5 mg),
流分 Fr 04(3 g)经反相硅胶 (RP-18,80~100 μ)柱层析,以甲醇/水 (v/v 15∶85 ~75∶25)6 个梯度进行洗脱,得到6个亚流分 (Fr 0401~Fr0406)。亚流分Fr 0402~Fr0404经半制备HPLC进一步纯化,得到差向异构体11和12 1:1)的混合物(乙腈/水(v/v 15∶75),tR=34.0 min,9.4 mg)、差向异构体13和14(1:1)的混合物(乙腈/水(v/v 20∶80),tR=33.5 min,21.6 mg)、以及化合物15(乙腈/水(v/v 20∶80),tR=29.3 min,21.6 mg),亚流分 Fr 0405通过重结晶得到化合物9(8 mg)。
1.2.4 抗污损和酶抑制剂活性测定
抗草苔虫幼虫附着活性测定方法参考文献[6],蛋白质酪氨酸磷酸酶PTPIB抑制率测定方法参考文献[7],次黄嘌呤单磷酸脱氢酶 (IMPDH)抑制率测定方法参考文献[8],组织蛋白酶Cathepsin B抑制率测定方法参考文献[9]。
2 结构鉴定
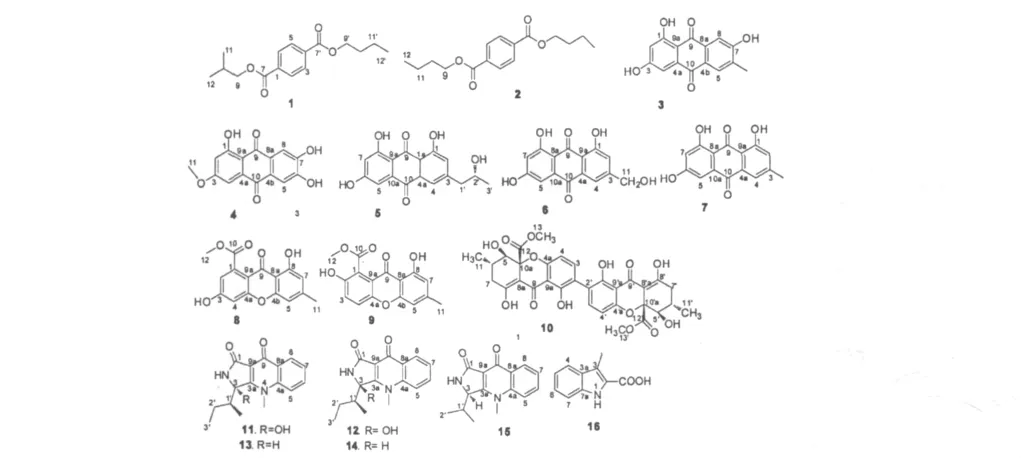
图1 化合物1~16的化学结构Fig.1 Structures of compounds 1-16
化合物1 n-butyl isobutyl terephthalate:为黄色油状物;UV(max)(MeOH)220,251,314 nm;1H NMR(500 MHz,CDCl3)δH7.55(1H,dd,J=2.0,5.5 Hz,H-2),7.75(1H,dd,J=2.0,5.5 Hz,H-3),7.75(1H,dd,J=2.0,5.5 Hz,H-5),7.55(1H,dd,J=2.0,5.5 Hz,H-6),4.10(2H,d,J=6.5 Hz,H-9),4.32(2H,t,J=6.5 Hz,H-9'),2.06(1H,m,H-10),1.72(2H,m,H-10'),1.02(3H,d,J=6.5 Hz,H-11),1.45(2H,m,H-11'),1.01(3H,d,J=6.5 Hz,H-12),0.98(3H,t,J=7.5 Hz,H-12');13C NMR(125 MHz,CDCl3)δC132.5(C,C-1),130.9(CH,C-2),128.9(CH,C-3),132.5(C,C-4),128.9(CH,C-5),130.9(CH,C-6),167.7(C,C-7),167.7(C,C-7'),71.8(CH2,C-9),65.6(CH2,C-9'),27.8(CH,C-10),30.7(CH2,C-10'),19.2(CH3,C-11),30.7(CH2,C-11'),19.2(CH3,C-12),13.7(CH3,C-12');(+)-HRESIMS m/z[M+H]+279.1615(calcd.for C16H23O4,279.1591)。经查阅文献[11,12]发现该化合物与 dibutyl terephthalate唯一的区别在于C-9位取代基的不同,故鉴定该化合物为n-butyl isobutyl terephthalate。
化合物2 dibutyl terephthalate:为黄色油状物;UV(max)(MeOH)219,255,315 nm;1H NMR(500 MHz,CDCl3)δH7.52(1H,dd,J=3.5,6.0 Hz,H-2),7.70(1H,dd,J=3.5,6.0 Hz,H-3),7.70(1H,dd,J=3.5,6.0 Hz,H-5),7.52(1H,dd,J=3.5,6.0 Hz,H-6),4.21(4H,m,H-9,9'),1.68(4H,m,H-10,10'),1.40(4H,m,H-11,11'),0.90(6H,t,J=7.0 Hz)。上述氢谱数据与文献[12]一致,故鉴定该化合物为dibutyl terephthalate。
化合物3 1,3,7-trihydroxy-6-methylanthraquinone:为黄色粉末;UV(max)(MeOH)221,250,279 and 439 nm;1H NMR(500 MHz,CDCl3)δH6.67(1H,s,H-2),7.05(1H,s,H-4),7.47(1H,s,H-5),7.62(1H,s,H-8),2.31(3H,s,H-11),12.29(1H,brs,OH-1),12.12(1H,brs,OH-3 or OH-7);(+)-ESIMS m/z 227.4[M+Na]+。上述氢谱和质谱数据与文献报道的数据[13]一致,故鉴定该化合物为 1,3,7-trihydroxy-6-methylanthraquinone。
化合物4 1,6,7-trihydroxy-3-methoxy-anthraquinone:为黄色粉末;UV(max)(MeOH)225,274 and 442 nm;1H NMR(500 MHz,DMSO-d6)δH6.09(1H,s,H-2),6.81(1H,s,H-4),7.63(1H,s,H-5),8.10(1H,s,H-8),4.11(3H,s,H-11),12.90(1H,brs,OH-1),12.30(1H,brs,OH-6 or OH-7)。上述氢谱数据与文献[14]比对,确定该化合物为 1,6,7-trihydroxy-3-methoxy-anthraquinone。
化合物5 Isorhodoptilometrin:为桔黄色粉末;[α]20D+16.8(c 0.19,MeOH),UV(max)(MeOH)225,290,and 450 nm;1H NMR(500 MHz,DMSO-d6)δH7.17(1H,d,J=1.0 Hz,H-2),7.53(1H,d,J=1.0 Hz,H-4),7.10(1H,d,J=2.5 Hz,H-5),6.57(1H,d,J=2.5 Hz,H-7),2.72(2H,m,H-1'),3.89(1H,m,H-2'),1.09(3H,d,J=6.0 Hz,H-3');13C NMR(125 MHz,DMSO-d6)δC161.0(C,C-l),113.8(C,C-1a),124.6(CH,C-2),149.5(C,C-3),120.8(CH,C-4),132.5(C,C-4a),109.8(CH,C-5),162.4(C,C-6),107.9(CH,C-7),164.6(C,C-8),189.0(C,C-9),112.6(C,C-9a),181.4(C,C-10),134.8(C,C-10a),45.0(CH2,C-1'),66.5(CH,C-2'),23.4(CH3,C-3');(+)-ESIMS m/z 315[M+H]+,m/z 337.1[M+Na]+,分子式为C17H14O6。上述数据与文献[15]一致,故鉴定该化合物为isorhodoptilometrin。其中C-2'的绝对构型可通过比较化合物5和化合物(1,3,6,8-tetrahydroxyanthraquinoe congener)[16]的旋光数据得以确定:化合物5的[α]20D+16.8(c 0.19,MeOH),1,3,6,8-tetrahydroxyanthraquinoe congener的[α]20D+151.5(c 0.1,EtOH),两者的旋光值均为+,故推测 C-2'的绝对构型为 R,本文是第一次报道 isorhodoptilometrin中2-羟基丙基片段上C-2'的绝对构型。
化合物6 Citreorosein:为桔黄色粉末;UV(max)(MeOH)221,253,266,289 and 425 nm;1H NMR(500 MHz,DMSO-d6)δH7.21(1H,s,H-2),7.61(1H,s,H-4),6.99(1H,s,H-5),6.36(1H,s,H-7),4.59(2H,brs,H-11)。上述氢谱数据与文献[15]一致,故鉴定该化合物为 citreorosein。
化合物7 Emodin:为桔黄色粉末;UV(max)(MeOH)202,231,250,270 and 430 nm;1H NMR(500 MHz,DMSO-d6)δH7.52(1H,s,H-2),7.20(1H,s,H-4),7.13(1H,d,J=2.0 Hz,H-5),6.61(1H,d,J=2.0 Hz,H-7),2.38(3H,s);(-)-ESIMS m/z 269.1[M-H]-,分子式为C15H10O5。上述数据与文献[15]一致,故鉴定该化合物为emodin。
化合物8 methyl-3,8-dihydroxy-6-methyl-9-oxo-9H-xanthene-1-carboxylate:为黄色粉末;UV(max)(MeOH)197,238,256,309 and 387 nm;1H NMR(500 MHz,DMSO-d6)δH6.93(1H,d,J=2.0 Hz,H-2),6.84(1H,d,J=2.0 Hz,H-4),6.86(1H,s,H-5),6.84(1H,s,H-7),2.38(3H,s,H-11),3.87(3H,s,H-12),12.29(1H,brs,OH-8);13C NMR(125 MHz,DMSO-d6) δC134.8(C,C-1),110.9(CH,C-2),165.0(C,C-3),107.1(CH,C-4),155.1(C,C-4a),157.6(C,C-4b),103.0(CH,C-5),148.3(C,C-6),105.6(C,C-7),160.4(C,C-8),108.3(C,C-8a),178.7(C,C-9),113.1(C,C-9a),168.2(C,C-10),21.7(CH3,C-11),52.4(CH3,C-12);(+)-ESIMS m/z 301.1[M+H]+;分子式为C16H12O6。上述数据与文献[17]一致,故鉴定该化合物为 methyl-3,8-dihydroxy-6-methyl-9-oxo-9H-xanthene-1-carboxylate。
化合物9 Pinselin:为黄色粉末;UV(max)(MeOH)197,238,266,297 and 393 nm;1H NMR(500 MHz,DMSO-d6)δH7.45(1H,d,J=9.0 Hz,H-3),7.60(1H,d,J=9.0 Hz,H-4),6.87(1H,s,H-5),6.63(1H,s,H-7),2.37(3H,s,H-11),3.83(3H,s,H-12),10.44(1H,brs,OH-2),12.15(1H,brs,OH-8);13C NMR(125 MHz,DMSO-d6)δC120.6(C,C-1),151.2(C,C-2),125.7(CH,C-3),117.5(CH,C-4),149.6(C,C-4a),155.9(C,C-4b),107.9(CH,C-5),149.3(C,C-6),106.4(CH,C-7),160.8(C,C-8),111.2(C,C-8a),180.7(C,C-9),117.7(C,C-9a),167.3(C,C-10),22.5(CH3,C-11),52.7(CH3,C-12);(+)-ESIMS m/z 323.1 [M+Na]+;分子式为C16H12O6。上述数据与文献[18]一致,故鉴定该化合物为pinselin。
化合物10 secalonic acid D:为黄色粉末;UV(max)(MeOH)244,269 and 388 nm;1H NMR(500 MHz,CDCl3)δH7.37(2H,d,J=8.5 Hz,H-3,3'),6.56(2H,d,J=8.5 Hz,H-4,4'),3.82(2H,d,J=10.5 Hz,H-5,5'),2.34(2H,m,H-6,6'),2.65(2H,dd,J=6.0,19.0 Hz,H-7a,7'a),2.25(2H,dd,J=10.5,19.0 Hz,H-7b,7b'),1.08(6H,d,J=6.6 Hz,H-11,11'),3.66(6H,s,H-13,H-1');13C NMR(125 MHz,CDCl3)δC159.2(C,C-1,1'),117.9(C,C-2,2'),140.1(CH,C-3,3'),107.5(CH,C-4,4'),76.8(CH,C-5,5'),29.5(CH,C-6,6'),36.2(CH2,C-7,7'),177.6(C,C-8,8'),187.1(C,C-9,9'),17.9(CH3,C-11,11'),170.6(C,C-12,12'),53.1(CH3,C-13,13'),158.5(C,C-4a,4a'),101.5(C,8a,8a'),106.7(C,9a,9a'),84.9(C,10a,10a')。上述数据与文献[15]一致,故鉴定该化合物为secalonic acid D。
化合物11 quinolactacin C1:为白色粉末;UV(max)(MeOH)215,248,259,315 and 328 nm;1H NMR(500 MHz,DMSO-d6)δH8.36(1H,brs,2-NH),7.87(1H,d,J=8.5 Hz,H-5),7.82(1H,dd,J=8.5,7.0 Hz,H-6),7.49(1H,dd,J=8.0,7.0 Hz,H-7),8.24(1H,d,J=8.0 Hz,H-8),4.04(3H,s,4-Me),7.03(1H,brs,OH-3),2.25(1H,m,H-1'),2.00(1H,m,H-2'a),1.13(1H,m,H-2'b),0.93(3H,d,J=7.0 Hz,H-3'),0.52(3H,d,J=6.5 Hz,1'-Me);13C NMR(125 MHz,DMSO-d6)δC167.1(s,C-1),89.3(s,C-3),163.9(s,C-3a),141.9(s,C-4a),117.8(d,C-5),133.3(d,C-6),125.2(d,C-7),126.2(d,C-8),128.9(s,C-8a),172.1(s,C-9),109.4(s,C-9a),35.2(q,4-CH3),41.4(d,C-1'),23.8(t,C-2'),12.8(q,C-3'),13.6(q,1'-CH3);(+)-HRESIMS给出的分子式为C16H19N2O3(m/z 287.1420[M+H]+,calcd.for C16H19N2O3,287.1390)。上述数据与文献[19]一致,故鉴定该化合物为quinolactacin C1。
化合物12 quinolactacin C2:为白色粉末;UV(max)(MeOH)215,248,259,315 and 328 nm;1H NMR(500 MHz,DMSO-d6)δH8.29(1H,brs,2-NH),7.87(1H,d,J=8.5 Hz,H-5),7.82(1H,dd,J=8.5,7.0 Hz,H-6),7.49(1H,dd,J=8.0,7.0 Hz,H-7),8.24(1H,d,J=8.0 Hz,H-8),4.04(3H,s,4-Me),7.03(1H,brs,OH-3),2.17(1H,m,H-1'),2.00(1H,m,H-2'a),1.13(1H,m,H-2'b),0.70(3H,d,J=7.0 Hz,H-3'),1.11(3H,d,J=6.5 Hz,1'-Me);13C NMR(125 MHz,DMSO-d6)δC166.9(s,C-1),89.0(s,C-3),163.9(s,C-3a),141.9(s,C-4a),117.8(d,C-5),133.3(d,C-6),125.2(d,C-7),126.2(d,C-8),128.9(s,C-8a),172.1(s,C-9),109.4(s,C-9a),35.2(q,4-CH3),41.2(d,C-1'),22.9(t,C-2'),11.9(q,C-3'),13.1(q,1'-CH3)。上述数据与文献[19]一致,故鉴定该化合物为quinolactacin C2。
化合物13 quinolactacin A1:为白色粉末;UV(max)(MeOH)216,250,259,316 and 329 nm;1H NMR(500 MHz,DMSO-d6)δH8.08(1H,brs,NH-2),4.89(1H,brs,H-3),7.80(1H,d,J=8.5 Hz,H-5),7.77(1H,dd,J=7.0,8.5 Hz,H-6),7.46(1H,dd,J=7.0,7.5 Hz,H-7),8.23(1H,d,J=7.5 Hz,H-8),3.81(3H,s,4-Me),2.15(1H,m,H-1'),1.58(1H,m,H-2'),1.40(1H,m,H-2'),0.99(3H,t,J=7.5 Hz,H-3'),0.43(3H,d,J=6.5 Hz,1'-Me)。上述数据与文献[20]一致,故鉴定该化合物为 quinolactacin A1。
化合物14 quinolactacin A2:为白色粉末;UV(max)(MeOH)216,250,259,316 and 329 nm;1H NMR(500 MHz,DMSO-d6)δH8.15(1H,brs,NH-2),4.82(1H,brs,H-3),7.82(1H,d,J=8.5 Hz,H-5),7.79(1H,dd,J=7.0,8.5 Hz,H-6),7.48(1H,dd,J=7.0,7.5 Hz,H-7),8.25(1H,d,J=7.5 Hz,H-8),3.84(3H,s,4-Me),2.18(1H,m,H-1'),0.80(1H,m,H-2'),0.85(1H,m,H-2'),0.63(3H,t,J=7.5 Hz,H-3'),1.12(3H,d,J=6.5 Hz,1'-Me)。上述数据与文献[20]一致,故鉴定该化合物为 quinolactacin A2。
化合物15 quinolactacin B1:为白色粉末;UV(max)(MeOH)214,249,259,316 and 327 nm;1H NMR(500 MHz,DMSO-d6)δH8.13(1H,brs,2-NH),4.81(1H,s,H-3),7.82(1H,d,J=8.5 Hz,H-5),7.81(1H,dd,J=8.5,7.0 Hz,H-6),7.48(1H,dd,J=8.0,7.0 Hz,H-7),8.25(1H,d,J=8.0 Hz,H-8),3.83(3H,s,4-Me),2.44(1H,m,H-1'),0.44(3H,d,J=7.0 Hz,H-2'),1.13(3H,d,J=7.0 Hz,1'-Me);13C NMR(125 MHz,DMSO-d6)δC168.7(C,C-1),58.6(C,C-3),164.3(C,C-3a),141.3(C,C-4a),117.1(CH,C-5),132.6(CH,C-6),125.2(CH,C-7),125.8(CH,C-8),128.0(C,C-8a),171.7(C,C-9),110.0(C,C-9a),36.0(CH3,4-CH3),29.0(CH,C-1'),13.7(CH3,C-2'),20.6(CH3,1'-CH3)。上述氢谱和碳谱数据与文献[20]一致,故鉴定该化合物为quinolactacin B1。
化合物16 3-methyl-1H-indole-2-carboxylic acid:为黄色粉末;UV(max)(MeOH)205,230 and 295 nm;1H NMR(500 MHz,DMSO-d6)δH9.04(1H,brs,NH-1),7.81(1H,d,J=6.5 Hz,H-4),6.75(1H,dd,J=7.0,6.5 Hz,H-5),7.40(1H,dd,J=7.0,7.5 Hz,H-6),6.86(1H,d,J=7.5 Hz,H-8),9.91(1H,s,2-COOH),1.91(3H,s,3-Me)。上述氢谱数据与文献[21]一致,故鉴定该化合物为3-methyl-1H-indole-2-carboxylic acid。
3 结果与讨论
活性筛选实验结果表明,化合物5和7有强抗草苔虫幼虫附着活性,其EC50值分别为3.8和6.0 μg/ml,且 LC50/EC50值分别为 >15.0 和 >16.5;化合物5,10,15对PTPlB有一定的抑制作用,其IC50值分别为67.8,24.0,185.2 μM;化合物5,6 对 IMPDH有一定的抑制作用,其 IC50值分别为318.5,122.7 μM;化合物10,差向异构体12 和13(1∶1)的混合物,以及15对cathepsin B有一定的抑制作用,其 IC50值分别为156.7,68.5,16.0 μM;而其它化合物则没有明显活性。通过比较化合物11~15的结构和酶抑制活性,推测在它们化学结构的基本骨架上C-3上的羟基取代将可能显著降低其对cathepsin B的抑制活性。
1 Saleem M,Ali MS,Hussain S,et al.Marine natural products of fungal origin.Nat Prod Rep,2007,24:1142-1152.
2 Newman DJ,Hill RT.New drugs from marine microbes:the tide is turning.J Ind Microbiol Biot,2006,33:539-544.
3 Newton GGF,Abraham EP.Cephalosporin-C,a New Antibiotic Containing Sulphur and D-Alpha-Aminoadipic Acid.Nature,1955,175:548-548.
4 Bugni TS,Ireland CM.Marine-derived fungi:a chemically and biologically diverse group of micro-organisms.Nat Prod Rep,2004,21:143-163.
5 Rateb ME,Ebel R.Secondary metabolites of fungi from marine habitats.Nat Prod Rep,2011,28:290-344.
6 Qi SH,Xu Y,Xiong HR,et al.Antifouling and antibacterial compounds from a marine fungus Cladosporium sp.F14.World J Microb Biot,2009,25,399-406.
7 Montalibet J,Skorey KI,Kennedy BP.Protein tyrosine phosphatase:enzymatic assays.Methods,2005,35,2-8.
8 Nimmesgern E,Black J,Futer O,et al.Biochemical Analysis of the Modular Enzyme Inosine 5'-Monophosphate Dehydrogenase.Protein Expres Purif,1999,17,282-289.
9 Halangk W,Lerch MM,Brandt-Nedelev B,et al.Role of cathepsin B in intracellular trypsinogen activation and the onset of acute pancreatitis.J Clin Invest,2000,106,773-781.
10 Lai X,Cao L,Tan H,et al.Fungal communities from methane hydrate-bearing deep-sea marine sediments in South China Sea.Isme J,2007,1:756-762.
11 Mark H,Huntersville NC,Phillip WT,et al.Low-melting mixtures of di-n-butyl and diisobutyl terephthalate.Patent US7361779.Apr 22,2008.
12 Niu F(牛锋),Xie GB(谢光波),Cui Z(崔征),et al.Chemical constituents from Roots of Semiaquilegia adoxoides.J Chin Pharm Sci(中国药学,英文版),2006,15:251-254.
13 Hosoe T,Nozawa K,Udagawa S,et al.An anthraquinone derivative from dihotomophthora-lutea.Phytochemistry,1990,29:997-999.
14 Wang DY,Ye Q,Li B G,et al.A new anthraquinone from Gladiolus gandavensis.Nat Prod Res,2003,17:365-368.
15 Ren H,Tian L,Guo QQ,et al.Secalonic acid D;A Cytotoxic Constituent from Marine Lichenderived Fungus Gliocladium sp.T3.Arch Pharm Res,2006,29:59-63.
16 Gernot B,Edrada RA,Ebel R,et al.Anthraquinones and Betaenone Derivatives from the Sponge-Associated Fungus Microsphaeropsis Species:Novel Inhibitors of Protein Kinases.J Nat Prod,2000,63:739-745.
17 Siddiqui IN,Zahoor A,Hussain H,et al.Diversonol and blennolide derivatives from the endophytic fungus Microdiplodia sp.:absolute configuration of diversonol.J Nat Prod,2011,74:365-373.
18 Mikio Y,Emi O.Isolation and Structures of Oxaphenalenone Dimers from Talaromyces bacillosporus.Chem Pham Bull,1980,28:3649-3655.
19 Clark B,Capon R J,Lacey E,et al.Quinolactacins revisited:from lactams to imide and beyond.Org Biomo Chem,2006,4:1512-1519.
20 Zhang XQ,Jiang WQ,Sui ZH.Concise enantioselective syntheses of quinolactacins A and B through alternative Winterfeldt oxidation.J Org Chem,2003,68:4523-4526.
21 Gutierrez-Lugo MT,Woldemichael GM,Singh MP,et al.Isolation of three new naturally occurring compounds from the culture of Micromonospora sp.P1068.Nat Prod Res,2005,19:645-52.