二苯乙烯苷对同型半胱氨酸诱导血管内皮细胞凋亡及bcl-2、bax、caspase-3表达的影响*
2013-10-25王国荣张秀芹牟艳玲姚庆强
李 军, 王国荣, 张秀芹, 王 燕, 牟艳玲, 姚庆强△
(山东省医学科学院 1药物研究所, 2山东省罕少见病重点实验室,山东 济南 250062)
二苯乙烯苷对同型半胱氨酸诱导血管内皮细胞凋亡及bcl-2、bax、caspase-3表达的影响*
李 军1,2, 王国荣1, 张秀芹1, 王 燕1, 牟艳玲1,2, 姚庆强1,2△
(山东省医学科学院1药物研究所,2山东省罕少见病重点实验室,山东 济南 250062)
目的研究何首乌二苯乙烯苷(TSG)对同型半胱氨酸(Hcy)诱导人脐静脉内皮细胞(HUVECs)凋亡及bcl-2、bax和caspase-3 mRNA表达的影响。方法建立Hcy (3 mmol/L)所致培养HUVECs核损伤模型,TSG(1和10 μmol/L)提前2 h预孵育,然后再以Hcy处理,作为TSG保护组。用Hoechst 33342核染色法观察HUVECs细胞核损伤状态,以流式细胞术检测细胞凋亡情况,用实时荧光定量RT-PCR法检bcl-2、bax和caspase-3 mRNA的表达。结果经3 mmol/L Hcy处理后,与正常培养的细胞相比,HUVECs核损伤加重,凋亡细胞比例升高,bcl-2表达降低(P<0.01),bax和caspase-3表达增加(P<0.01)。TSG 1 μmol/L和10 μmol/L预孵育后再经3 mmol/L Hcy处理,与单经3 mmol/L Hcy损伤模型组相比,HUVECs细胞核损伤降低,凋亡率下降,bcl-2的表达增加(P<0.05),bax和caspase-3表达降低(P<0.05)。结论TSG具有降低Hcy所致HUVECs的细胞损伤和抑制凋亡的作用,其机制可能与影响bcl-2、bax和caspase-3的表达有关。
二苯乙烯苷; 同型半胱氨酸; 细胞凋亡; Bcl-2; Bax; 半胱氨酸天冬氨酸蛋白酶3
血浆同型半胱氨酸(homocysteine, Hcy)水平升高是冠心病、脑血管疾病以及外周阻塞性血管疾病等心脑血管疾病的一个重要独立危险因素[1-2]。体外细胞培养显示Hcy 能诱导内皮细胞凋亡[3-4];Hcy可损伤血管内皮促进动脉粥样斑块形成[5]。
何首乌(Polygonummultiflorum)2,3,5,4’-四羟基反式二苯乙烯-2-O-β-D-吡喃葡萄糖苷(2,3,5,4’- tetrahydroxystilbene-2-O-β-D-glucoside, TSG)可有效抑制高血脂症模型大鼠的血脂升高,降低主动脉、冠状动脉和颈总动脉脂质条纹面积,减少肝脏中的脂质沉积。TSG还能促进血管内皮细胞释放一氧化氮(nitric oxide, NO)并具有很强的抗氧化特性[6],抑制单核细胞分泌黏附分子和抑制内皮细胞与单核细胞的黏附[7]。目前关于TSG抗凋亡分子研究报道较少。特别是其对Hcy所致血管内皮细胞的凋亡干预作用不明。
本实验通过对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)的培养,研究应用TSG干预对Hcy诱导HUVECs凋亡及凋亡相关基因表达的影响,初步探讨TSG抑制Hcy诱导HUVECs凋亡的可能分子作用机制。
材 料 和 方 法
1材料
HUVECs由山东省医学科学院药物所药理室提供。Hcy购自Sigma,DMEM培养基系Gibco产品,TSG为山东省医学科学院药物研究所分离,纯度99%,胰蛋白酶和EDTA 混合液由Gibco生产,胎牛血清由杭州四季青生物工程材料有限公司生产,Hoechst 33342细胞核凋亡检测试剂盒购自碧云天生物技术研究所,RNA提取试剂由Promega生产,逆转录及SYBR GreenⅠReal Time PCR试剂由大连宝生物公司生产,引物由上海博彩生物公司合成。
2方法
HUVECs的培养和传代方法同文献[8],实验使用复苏培养3~5代的细胞。
2.1细胞核形态学染色观察 将HUVECs 按2×104cells/well的密度接种于24孔板内,以含10% FBS DMEM培养液培养,待细胞长至50%时,改换为无血清培养基培养24 h,使细胞同步化于G0期(细胞同步化)后,进行以下实验。
实验分为以下5组:正常培养基组、Hcy 3.0 mmol/L组、TSG(1 μmol/L、10 μmol/L)预孵育2 h再各加Hcy 3.0 mmol/L处理组。Hcy培养36 h后进行Hoechst 33342核染色检测。实验重复4次。
2.2Annexin V-FITC/PI双染 取对数生长期细胞,调整浓度为1×109/L,种于25 mL培养瓶中。待细胞长至相互接触,改换为无血清培养基培养24 h,使细胞同步化于G0期(细胞同步化)后,按上一步的分组方法进行处理。加入Hcy作用36 h后,以0.25%胰蛋白酶消化细胞,1 200 r/min离心3 min,弃上清,PBS清洗,离心收集细胞,按照试剂盒说明,立即以Annexin V-FITC/PI双染,用流式细胞仪检测(激发波长为488 nm;发射波长为530 nm和575nm)细胞凋亡。CellQuest软件进行数据分析。
2.3实时荧光定量RT-PCR检测相关基因的表达 将HUVECs按1×105cells/well的密度接种于25 mL培养瓶,以含10% FBS的DMEM培养液培养,待细胞长至相互接触,改换无血清培养基培养24 h,使细胞同步化于G0期(细胞同步化)后,分为下列实验组:正常对照组、Hcy(3 mmol/L)模型组、TSG1组和TSG10组(1和10 μmol/L TSG预孵育2 h再各加Hcy 3 mmol/L继续培养12 h)。各处理组重复6次。
实验结束后倾去上清液,以PBS快速洗涤3次,参照TRIzol试剂说明裂解细胞备以提取总RNA。
引物序列如表1。实时荧光定量PCR 25 μL反应体系由以下成份组成:12.5 μL 2 × Power SYBR® Green PCR Master Mix,1.0 μmol/L 的上、下游引物(序列见表1),1 μL的逆转录产物,水。反应程序为:95 ℃ 10 min;循环反应为95 ℃ 8 s,60 ℃ 40 s,40个循环,在各循环的60 ℃ 40 s步骤进行荧光检测;最后为熔解曲线步骤。每个样品目的基因的表达阈值与内参照基因(mitochondrial ATP synthase 6,mATPsy6)表达阈值的差ΔCt为其相对表达量。各处理组目的基因的ΔCt与正常对照组目的基因的ΔCt差值计为ΔΔCt,以2-ΔΔCt表示为目的基因在药物处理组的表达量与在正常组表达量的比值。
3统计学处理
用SPSS 11.0统计软件进行分析,数据以均数±标准差(mean±SD)表示,多组比较采用单因素方差分析,两两比较方差齐者用LSD检验,方差不齐者用Dunnett’s T3检验。以P<0.05为差异有统计学意义。
结 果
1TSG对Hcy所致HUVECs细胞核形态学改变的影响
以Hoechst 33342染色,荧光显微镜下观察TSG 对Hcy所致HUVECs细胞核形态学改变的影响。结果显示与对照组相比,Hcy模型组以3 mmol/L Hcy孵育HUVECs 36 h,细胞核具凋亡形态特点,即胞核染色质凝集、边聚化、胞核呈亮蓝色荧光的细胞比例增多,见图1。
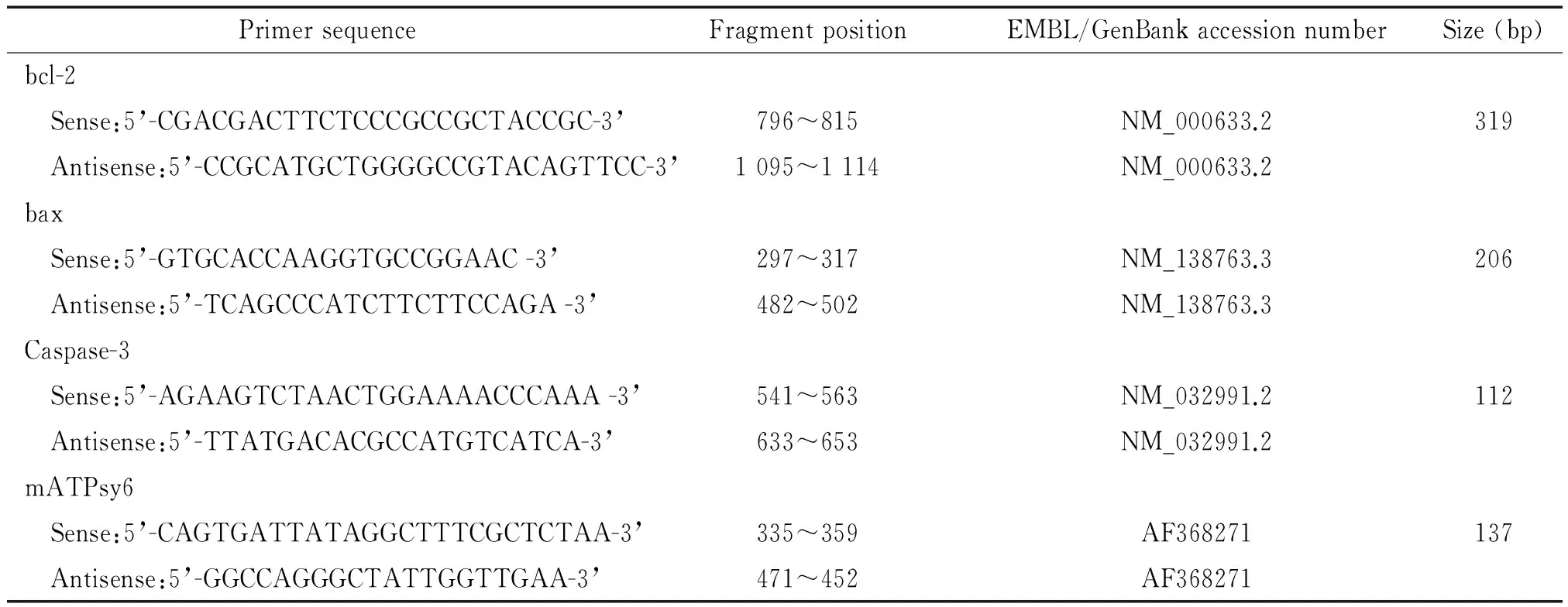
表1 实时荧光定量PCR的引物序列
分别以TSG 1 μmol/L和10 μmol/L预孵育HUVECs 2 h后,再以3 mmol/L Hcy孵育36 h,与Hcy处理相比,TSG处理可明显减轻Hcy诱发的内皮细胞核形态损伤,表现为细胞核中染色体凝集、边聚化的细胞比例减少,细胞核形态正常的细胞增多。显示了TSG抑制Hcy对HUVECs细胞核损伤的作用,TSG 10 μmol/L降低Hcy所致HUVECs的损伤作用更好,见图1。
Figure 1. Effect of TSG on HUVEC nuclear morphology damaged by Hcy. A:control; B:Hcy 3 mmol/L; C:TSG 1 μmol/L + Hcy 3 mmol/L; D:TSG 10 μmol/L + Hcy 3 mmol/L.
图1TSG对Hcy所致HUVECs细胞核形态学损伤的影响
2TSG对Hcy所致HUVECs细胞凋亡的影响
Annexin V与PI染色后,通过流式细胞仪检测TSG对Hcy所致HUVECs细胞凋亡的影响,结果显示,Hcy孵育36 h,细胞凋亡率为23.63%,而以TSG 1 μmol/L和10 μmol/L预孵育HUVECs 2 h后再以Hcy处理36 h,细胞凋亡率分别降为7.02%和2.95%,见图2。这说明TSG能抑制Hcy所致的HUVECs凋亡。

Figure 2. Effect of TSG on HUVEC apoptosis induced by Hcy.Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;##P<0.01vsHcy group.
图2TSG对Hcy所致HUVECs凋亡的影响
3TSG对Hcy所致HUVECs细胞凋亡相关分子表达的影响
3.1何首乌TSG对同型半胱氨酸致内皮细胞bcl-2 mRNA表达的影响 实时荧光定量RT-PCR结果检测显示, HUVECs模型组以3 mmol/L Hcy孵育12 h后,与对照组相比,其bcl-2 mRNA表达显著降低(P<0.01)。
HUVECs以何首乌TSG 1 μmol/L和10 μmol/L孵育2 h再给予3 mmol/L Hcy孵育12 h处理,与Hcy模型组相比,bcl-2 mRNA的表达显著增加。TSG的2个处理浓度与模型组相比差异均有统计学意义(P<0.05),见图3。
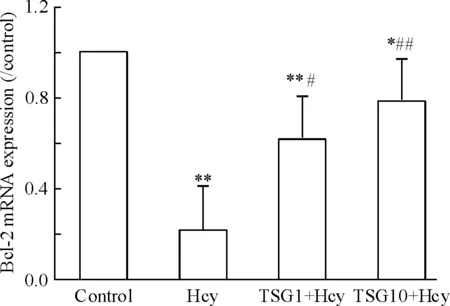
Figure 3. Effect of TSG on bcl-2 mRNA expression in HUVECs induced by Hcy.Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsHcy group.
图3TSG对Hcy所致HUVECsbcl-2mRNA表达的影响
3.2何首乌TSG对Hcy致血管内皮细胞bax mRNA表达的影响 Hcy模型组HUVECs bax mRNA表达较正常对照组显著升高(P<0.05)。
以10 μmol/L何首乌TSG孵育2 h再给予3 mmol/L Hcy孵育12 h处理HUVECs,与Hcy模型组相比,HUVECs bax mRNA表达降低(P<0.05),见图4。
3.3何首乌TSG对Hcy致血管内皮细胞caspase-3 mRNA表达的影响 Hcy模型组HUVECs的caspase-3 mRNA表达较正常对照组显著升高(P<0.01)。
HUVECs以1 μmol/L和10 μmol/L何首乌TSG孵育2 h再给予3.0 mmol/L Hcy孵育12 h处理,与Hcy模型组相比,caspase-3 mRNA表达降低(P<0.05),见图5。
讨 论
Hcy作为动脉粥样硬化独立危险因素之一近年来越来越受到重视,它可以通过损伤内皮细胞引起细胞凋亡、促进炎症介质释放等多方面引起动脉粥样硬化的发生和发展[9]。Hcy主要是通过激活细胞凋亡的细胞膜途径和线粒体途径进而促进了内皮细胞的凋亡。Hcy可抑制内皮细胞bcl-2[10-11]的表达,促进内皮细胞Bax[10-11]和Fas[12]的表达,进而激活caspase-3[9-10]、caspase-6和p38的表达,产生促凋亡作用。本实验结果证实Hcy诱导HUVECs凋亡时,HUVECs bax和casepase-3 mRNA表达较正常对照组显著升高;而bcl-2 mRNA的表达呈下降的趋势。
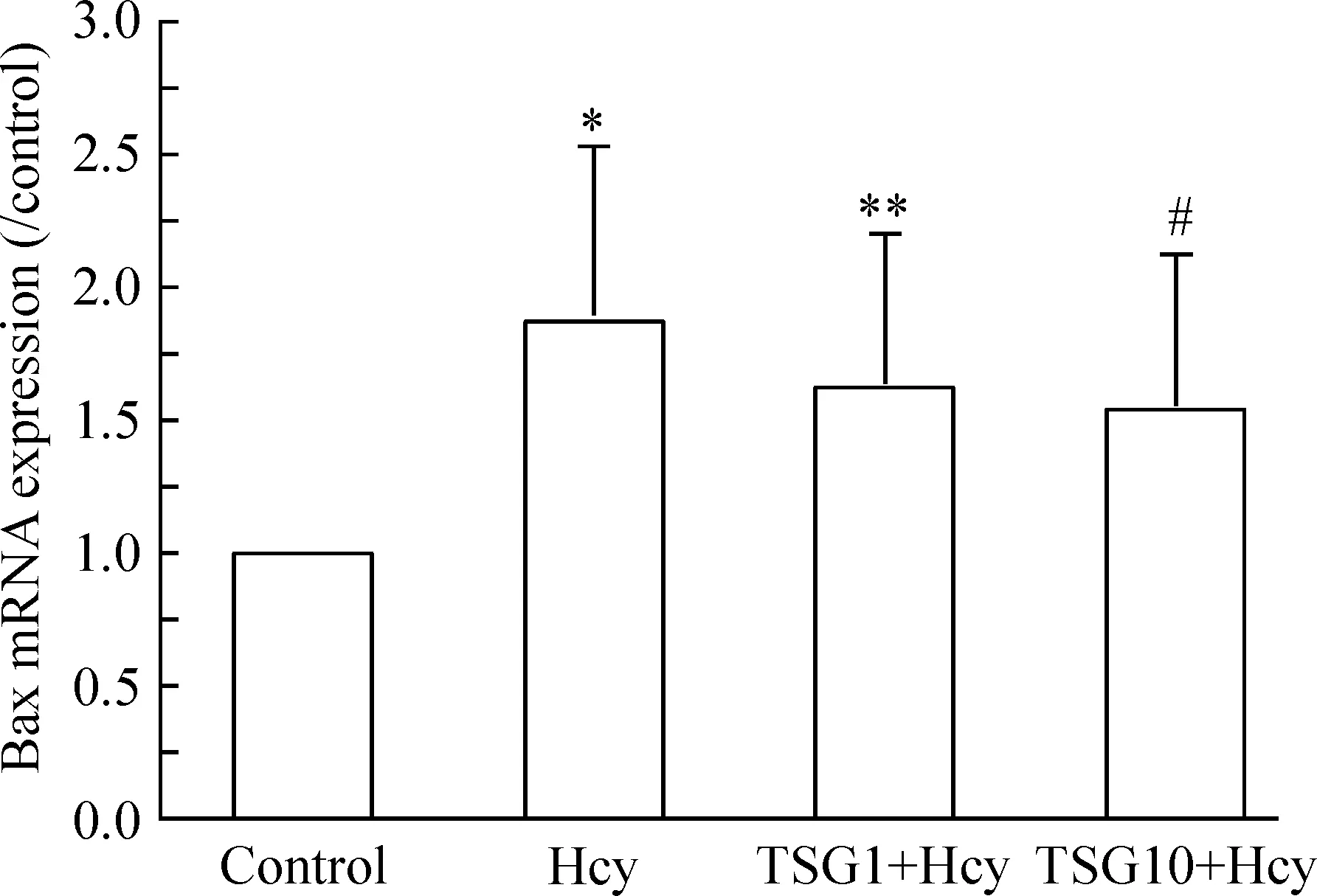
Figure 4. Effect of TSG on bax mRNA expression in HUVECs induced by Hcy.Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group;#P<0.05vsHcy group.
图4TSG对Hcy所致HUVECsbaxmRNA表达的影响
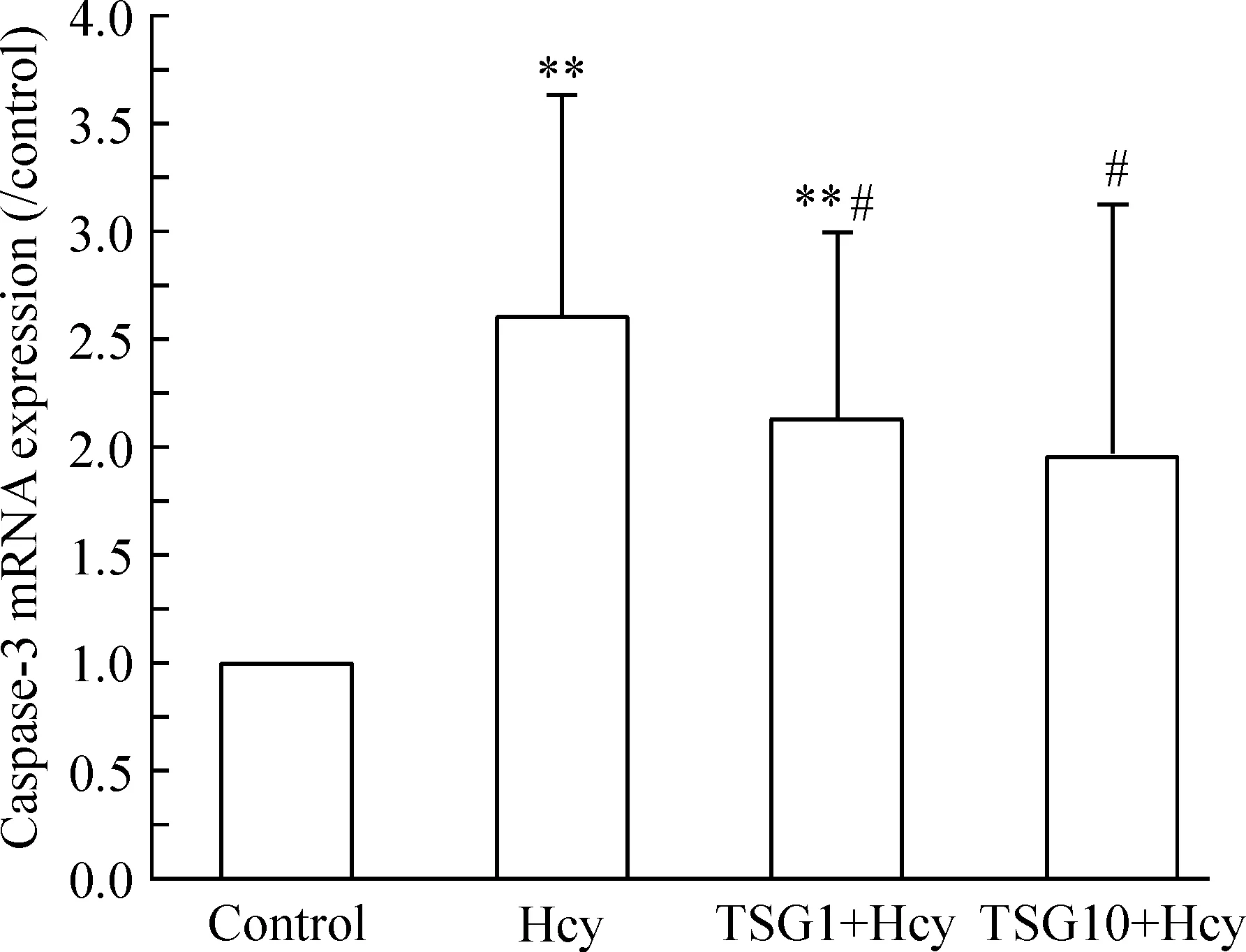
Figure 5. Effect of TSG on caspase-3 mRNA expression in HUVECs induced by Hcy.Mean±SD.n=6.**P<0.01vscontrol group;#P<0.05vsHcy group.
图5TSG对Hcy所致HUVECscaspase-3mRNA表达的影响
何首乌作为传统中药,其TSG具有降血脂、防治动脉粥样硬化、抗衰老、提高免疫功能作用[13-14]。TSG还能促进血管内皮细胞释放NO并具有很强的抗氧化特性[6],抑制单核细胞分泌黏附分子和抑制内皮细胞与单核细胞的黏附[7]。
本研究发现TSG预孵育可降低Hcy所致HUVECs细胞核损伤,降低凋亡细胞的比例。这一作用可能与何首乌TSG可提高Hcy损伤状态下HUVECs的凋亡抑制基因bcl-2的表达有关,同时还可能与TSG降低Hcy损伤状态下所致培养的HUVECs的促凋亡基因bax和caspase-3 mRNA的表达有关。推测TSG这一作用的原因可能与高浓度Hcy损伤内皮细胞主要是通过增加氧化损伤、而TSG具有抗氧化特性有关,但目前缺乏相关研究的直接证据,还需进一步研究证实。
本研究结果为临床应用TSG提供了一定的基础研究依据,为何首乌心血管活性的作用机制提供了一个新的补充,但TSG的抑制血管内皮细胞凋亡的活性有待从不同的角度进一步证实,且其抑制凋亡的机理亦需从多个途径展开。
[1] Kazemi MB, Eshraghian K, Omrani GR, et al. Homocysteine level and coronary artery disease[J]. Angiology, 2006, 57(1):9-14.
[2] Ciaccio M, Bellia C. Hyperhomocysteinemia and cardiovascular risk: effect of vitamin supplementation in risk reduction[J]. Curr Clin Pharmacol, 2010, 5(1):30-36.
[3] 何志勇, 张 雄, 王小同. 叶酸拮抗同型半胱氨酸诱导的内皮细胞凋亡的作用机制[J]. 中国病理生理杂志,2007,23(4):699-701.
[4] 陈燕铭, 吴 琳, 刘 勇, 等. 通心络对同型半胱氨酸损伤内皮细胞的基因表达谱的影响[J]. 中国病理生理杂志,2011,27(1):42- 47.
[5] Seo H, Oh H, Park H, et al. Contribution of dietary intakes of antioxidants to homocysteine-induced low density lipoprotein(LDL) oxidation in atherosclerotic patients[J]. Yonsei Med J, 2010, 51(4):526-533.
[6] Ye S, Tang L, Xu J, et al. Postconditioning’s protection of THSG on cardiac ischemia-reperfusion injury and mechanism[J]. J Huazhong Univ Sci Technolog Med Sci, 2006, 26(1):13-16.
[7] Yang PY, Almofti MR, Lu L, et al. Reduction of atherosclerosis in cholesterol-fed rabbits and decrease of expressions of intracellular adhesion molecule-1 and vascular endothelial growth factor in foam cells by a water-soluble fraction ofPolygonummultiflorum[J]. J Pharmacol Sci, 2005, 99(3):294-300.
[8] 何志勇, 叶小军, 邵胜敏. 同型半胱氨酸对内皮细胞凋亡及JNK表达的影响[J]. 心脑血管病防治, 2009, 9(2):100-102.
[9] Zeng XK, Remick DG, Wang X. Homocysteine induces production of monocyte chemoattractant protein-1 and interleukin-8 in cultured human whole blood[J]. Acta Pharmacol Sin, 2004, 25(11):1419-1425.
[10] Tyagi N, Ovechkin AV, Lominadze D, et al. Mitochondrial mechanism of microvascular endothelial cells apoptosis in hyperhomocysteinemia[J]. J Cell Biochem, 2006, 98(5):1150-1162.
[11] Dong F, Zhang X, Wold LE, et al. Endothelin-1 enhances oxidative stress, cell proliferation and reduces apoptosis in human umbilical vein endothelial cells: role of ETB receptor, NADPH oxidase and caveolin-1[J]. Br J Pharmacol, 2005, 145(3):323-333.
[12] Suhara T, Fukuo K, Yasuda O, et al. Homocysteine enhances endothelial apoptosis via upregulation of Fas-mediated pathways[J]. Hypertension,2004,43(6):1208-1213.
[13] 卫培峰,焦晨莉,陈丹丹.何首乌现代药理研究进展[J].现代中医药, 2004, 15(1):57-58.
[14] 陈万生. 何首乌活性成分及品质评价[D].上海:第二军医大学, 2000.
Effectsoftetrahydroxystilbene-2-O-β-D-glucosideonapoptosisandexpressionofbcl-2/bax/caspase-3inHUVECstreatedwithhomocysteine
LI Jun1, 2, WANG Guo-rong1, ZHANG Xiu-qin1, WANG Yan1, MU Yan-ling1, 2, YAO Qing-qiang1, 2
(1InstituteofMateriaMedica,2ShandongProvincalKeyLaboratoryofRareandUncommonDiseases,ShandongAcademyofMedicalSciences,Jinan250062,China.E-mail:yao_imm@163.com)
AIM: To explore the effects of tetrahydroxystilbene-2-O-β-D-glucoside (TSG) fromPolygonummultiflorumon the apoptosis and the mRNA expression of bcl-2, bax and caspase-3 in human umbilical vein endothelial cells (HUVECs) treated with homocysteine (Hcy).METHODSCultured HUVECs were treated with Hcy (3 mmol/L) to establish a Hcy-damaged model. HUVECs in TSG treated groups were pre-incubated with TSG at concentrations of 1 μmol/L and 10 μmol/L for 2 h before treated with Hcy. Cell nuclear damage was detected by Hoechst 33342 staining. Cell apoptosis was determined by flow cytometry. The mRNA expression of bcl-2, bax and caspase-3 was measured by real-time fluorescence quantitative RT-PCR.RESULTSAfter treatment with Hcy at concentration of 3 mmol/L, the nuclear damage and apoptotic rate of HUVECs were higher than that in normal group. The expression of bcl-2 was lower, and the expression of Bax and caspase-3 was higher than that in normal group. On the other hand, pre-incubation with TSG at concentrations of 1 μmol/L and 10 μmol/L decreased the nuclear damage and cell apoptosis, increased the expression of bcl-2, and decreased the expression of bax and caspase-3 as compared with the cells only treated with Hcy.CONCLUSIONTSG reduces the apoptosis of HUVECs induced by Hcy, and the mechanism might be associated with regulating the expression of bcl-2, bax and caspase-3.
Tetrahydroxystilbene-2-O-β-D-glucoside; Homocysteine; Apoptosis; Bcl-2; Bax; Caspase-3
R363
A
10.3969/j.issn.1000- 4718.2013.04.030
1000- 4718(2013)04- 0743- 05
2012- 07- 09
2013- 02- 28
山东省自然科学基金资助项目(No. ZR2008C317)
△通讯作者 Tel: 0531-82919960; E-mail: yao_imm@163.com
