阿霉素联合致敏树突状细胞对荷宫颈癌小鼠的治疗作用*
2013-10-25曾小平王红梅黄永红周晓燕蔡震宇徐方云
曾小平, 王红梅, 黄永红, 周晓燕, 蔡震宇, 徐方云
(南昌大学基础医学院 1病理生理学教研室, 2免疫学教研室, 江西 南昌 330006)
阿霉素联合致敏树突状细胞对荷宫颈癌小鼠的治疗作用*
曾小平2, 王红梅1△, 黄永红1, 周晓燕1, 蔡震宇1, 徐方云1
(南昌大学基础医学院1病理生理学教研室,2免疫学教研室, 江西 南昌 330006)
目的探讨阿霉素(adriamycin,ADM)联合冻融抗原致敏的树突状细胞(dendritic cells,DCs)对荷宫颈癌小鼠的免疫治疗作用。方法建立小鼠皮下移植瘤模型;应用反复冻融法处理小鼠宫颈癌U14细胞,并致敏小鼠骨髓来源的DCs,制备DCs疫苗;流式细胞术鉴定DCs成熟表型;荷瘤小鼠分为对照组(PBS组)、DCs疫苗组、ADM组和ADM联合DCs疫苗组,进行3个周期的治疗。观察肿瘤大小,第21 d取血,ELISA法检测小鼠血清IL-2、IL-12和IFN-γ含量;处死动物,称肿瘤重量。结果肿瘤冻融抗原致敏DCs后,可高表达白细胞分化抗原CD11c、CD80和CD86;经3个周期的治疗后,ADM联合DCs疫苗组平均瘤重及平均瘤体积均小于ADM组、DCs疫苗组和对照组(P<0.05),联合治疗组抑瘤率大于其它3组(P<0.05),且血清IL-2、IL-12和IFN-γ水平明显升高 (P<0.05)。结论ADM联合肿瘤抗原致敏的DCs疫苗可增强动物的抗肿瘤免疫应答,能有效抑制荷宫颈癌小鼠肿瘤的生长。
树突状细胞; 阿霉素; 肿瘤免疫疗法; 子宫颈癌
树突状细胞(dendritic cells, DCs)是1973年由Steinman和Cohn发现的,因为在它成熟时生出许多树突样或伪足样突起而得名[1],是目前所知唯一能激活初始T细胞的专职抗原提呈细胞(antigen presenting cells,APC),具有强大激活CD8+细胞毒性T淋巴细胞(cytotoxic T-lymphocyte, CTL)和CD4+辅助性T细胞(helper T-lymphocyte,Th)的能力,在免疫应答中居于中心地位,对机体克服肿瘤的免疫逃逸、增强机体对肿瘤的免疫清除等具有十分重要的作用。化疗药物治疗是抗肿瘤的重要手段之一,化疗药物可引起肿瘤细胞死亡,而这些死亡(包括坏死或凋亡)的肿瘤细胞有可能致敏DCs。在探讨化疗诱发免疫原性瘤细胞凋亡时,发现蒽环类抗生素在体内和体外均能引起免疫原性细胞死亡,阿霉素(adriamycin,ADM)处理的肿瘤细胞激发细胞毒性免疫应答特别有效,这种应答是由DCs介导的[2]。本文将重点探索化疗药物ADM联合DCs肿瘤疫苗对荷宫颈癌小鼠的联合治疗效应,观察经ADM处理荷瘤小鼠后,对DCs抗肿瘤免疫应答是否具有增强作用。
材 料 和 方 法
1动物
昆明(Kunming, KM)小鼠,雌性,6~8周龄,18~20 g,由南昌大学医学院实验动物部提供。小鼠宫颈癌U14细胞是由化学致癌物甲基胆蒽诱发的未分化鳞状细胞癌,在本研究室传代保存,复苏后常规传代培养。
2主要试剂
RPMI-1640培养基、胎牛血清购自HyClone,重组小鼠粒细胞-巨噬细胞集落刺激因子(recombinant murine granulocyte-macrophage colony-stimulating factor, rmGM-CSF)和重组小鼠白细胞介素 4(recombinant murine interleukin-4, rmIL-4)购自PeproTech,PE标记抗小鼠CD11c单克隆抗体、抗小鼠CD86单克隆抗体和FITC标记抗小鼠CD80单克隆抗体购自BioLegend,四甲基偶氮唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT]、胰蛋白酶和丝裂霉素C购自Sigma。阿霉素购自浙江海正药业有限公司。酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)试剂盒购自Westang Bio-Tech。
3主要方法
3.1荷瘤小鼠模型的建立 小鼠宫颈癌U14细胞常规复苏后传代培养。取处于对数生长期的U14细胞,磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤后,调整细胞浓度为1×1010cells/L,接种于小鼠右侧腋窝皮下,每只0.1 mL (1×106cells)。
3.2反复冻融法提取肿瘤抗原 收集U14细胞,经液氮迅速冷冻后,立即放入37 ℃水浴中至刚刚融化,即再次放入液氮迅速冷冻,反复5次冻融循环获得肿瘤细胞冻融裂解物, 10 000 r/min低温离心20 min,上清用0.22 μm针头滤器过滤,Lowry法测蛋白含量,-20 ℃保存。
3.3DCs的体外分离、培养和鉴定 在无菌条件下,从KM小鼠股骨和胫骨冲洗骨髓腔收集骨髓细胞,过200目钢网,1 000 r/min 离心 5 min,弃上清,以Tris-NH4Cl处理2~3 min去除红细胞,用PBS洗涤2次,RPMI-1640培养液洗1次后,将细胞悬于含rmGM-CSF(100 μg/L)和rmIL-4(100 μg/L)的含10% 胎牛血清的RPMI-1640完全培养液中(细胞浓度为1×109cells/L)培养。每2 d半量换液加全量细胞因子1次,第6 d时,用100 mg/L U14细胞冻融抗原刺激DCs 24 h,收集疏松贴壁细胞,流式细胞术检测细胞CD11c、CD86和CD80的表达。倒置显微镜每日观察细胞形态。
3.4ADM联合DCs瘤苗的体内抗肿瘤效应 KM小鼠皮下接种1×106个肿瘤细胞。第7 d平衡各组肿瘤体积,将荷瘤小鼠随机分为4组(n=6):对照组(PBS组)、ADM组、DCs疫苗组和ADM联合DCs治疗组。各组实验动物分别于接种肿瘤细胞后第 7、12、17 d给予相应治疗:PBS 对照组小鼠注射 PBS 0.1 mL, ADM组按6 mg/kg注射0.1 mL ADM,DCs 疫苗组注射DCs 1×106个(0.1 mL),联合治疗组在注射同剂量ADM后36 h注射相同剂量DCs。方法采用肿瘤周围多点注射。观察肿瘤生长情况。卡尺测量肿瘤的长径 a和短径 b,按V=1/2ab2算出肿瘤体积。接种肿瘤细胞第 21 d颈椎脱臼法处死动物,剥离肿瘤组织,滤纸吸干后称重,计算抑瘤率。抑瘤率(%)=1-治疗组肿瘤重量(或体积)/对照组肿瘤重量(或体积)×100%。总抑瘤率为重量及体积两组抑瘤率的均数。
3.5ELISA 法检测荷瘤小鼠血清中细胞因子的含量 荷瘤小鼠在颈椎脱臼法处死前,摘眼球取血,收集血清,ELISA检测血清中 IL-12、IL-2和干扰素γ(interferon γ,IFN-γ)的水平,操作步骤严格按照试剂盒说明书进行。
4统计学处理
用SPSS统计软件对数据作统计分析,数据以均数±标准差 (mean±SD)表示,多组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1荷瘤小鼠模型
小鼠皮下接种肿瘤后1~4 d生长较缓慢,以后迅速增长,多数呈类似椭圆形生长,第7 d时,注射部位出现明显质地较硬的结节,成瘤率达100%。
2DCs的形态学观察
小鼠骨髓细胞培养24 h后,可观察到部分细胞呈集落样生长,胞体为圆形,第3 d可见部分细胞形态出现不规则,体积增大,且形成的集落变大,数量增多,悬浮细胞增多;培养4~6 d,悬浮细胞数量逐渐增多,细胞表面毛刺状突起逐渐明显;培养6 d加入肿瘤冻融抗原继续培养24 h后,倒置显微镜下观察细胞表面毛刺状突起更加明显,形成典型的DCs形态特征,见图1。
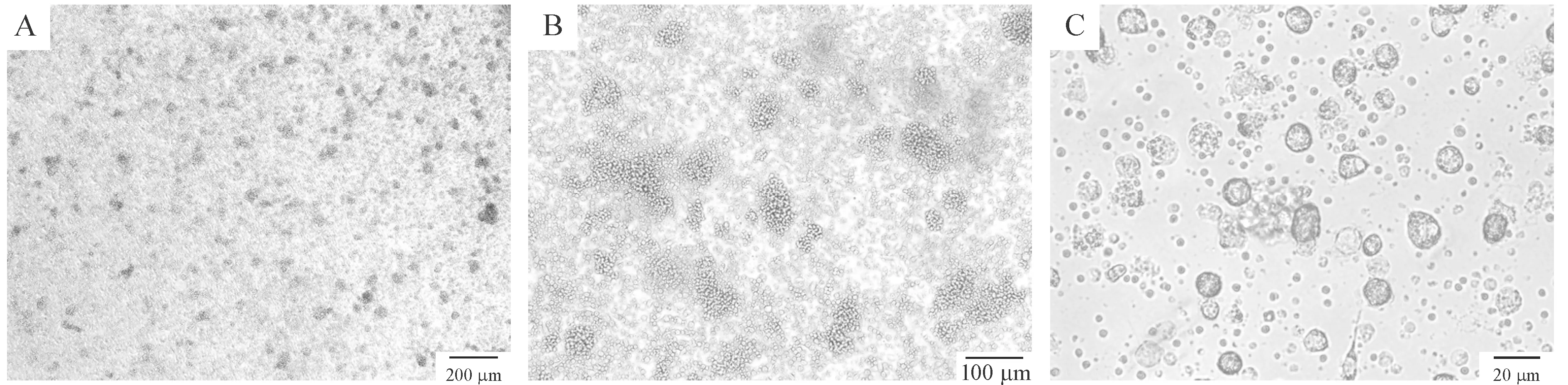
Figure 1. Morphology of the DCs under inverted microscope.A: the 3rd day; B: the 5th day; C: the 7th day.
图1倒置显微镜观察DCs的形态
3DCs表型测定
小鼠骨髓细胞培养7 d后,用吸管轻吹板底,收集细胞。应用流式细胞仪检测肿瘤抗原致敏的DCs,均高表达CD11c(74.37%±7.62%)、CD80(79.92%±6.58%)和CD86 (86.83%±7.31%)。
4荷瘤小鼠治疗效果
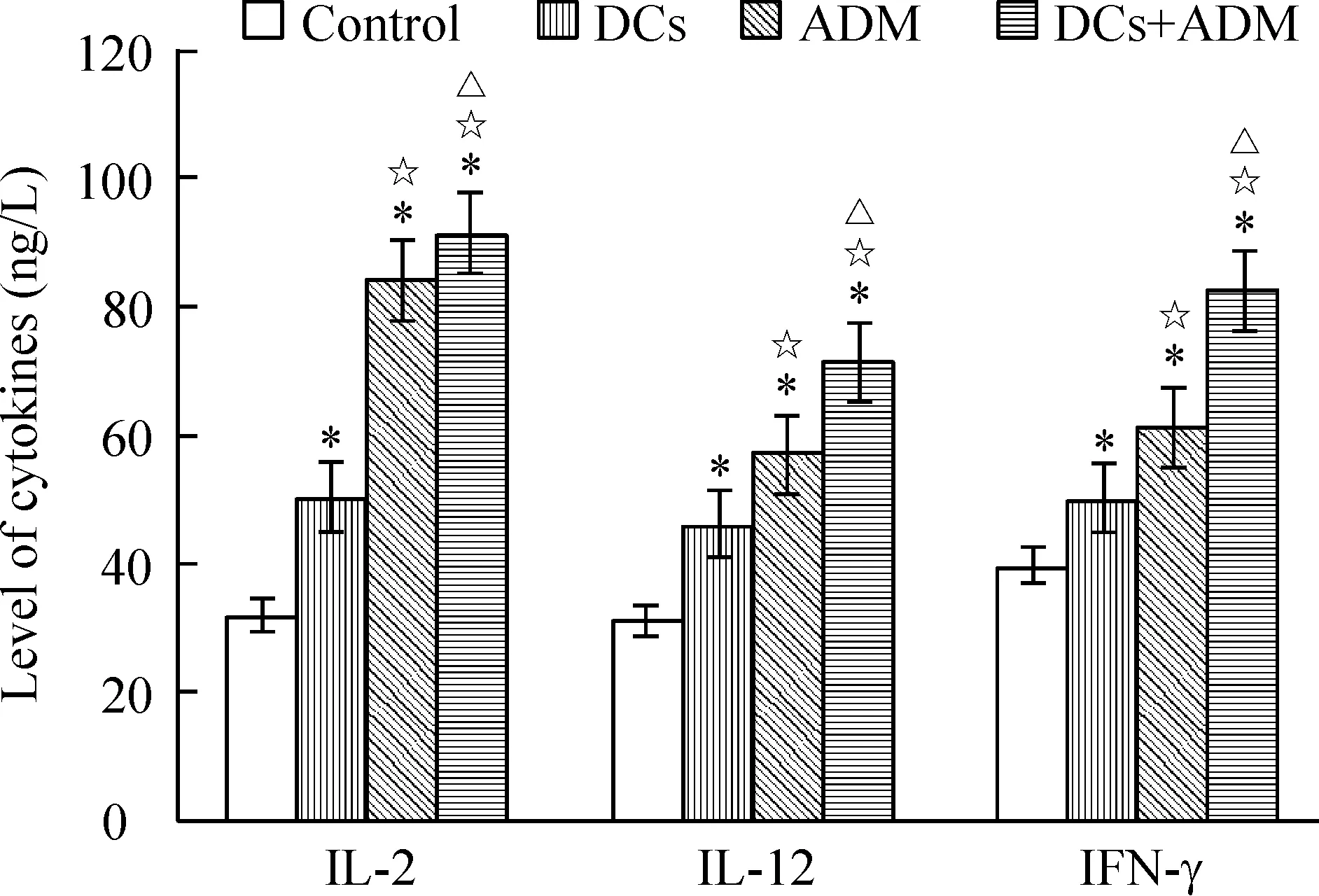
小鼠皮下接种肿瘤细胞建立荷瘤小鼠模型后,全部成瘤。接种后前5 d肿瘤生长较缓慢,以后肿瘤体积迅速增长,第7 d平均体积约0.4 cm×0.4 cm×0.4 cm左右,给予第1次治疗。接种肿瘤第17 d测量肿瘤体积,联合治疗组和ADM组小鼠肿瘤体积均小于对照组(P<0.05),第21 d时肿瘤体积大小为 ADM联合DCs疫苗组 5ELISA法检测荷瘤小鼠血清中细胞因子的含量 ELISA检测各实验组小鼠血清,显示联合治疗组荷瘤小鼠外周血血清中IL-2、IL-12和IFN-γ 高于ADM组、DCs治疗组和对照组(P<0.05),见图3。 表1荷瘤小鼠不同时间皮下肿瘤体积 Table 1. The tumor volume of tumor-bearing mice at different time points(cm3. Mean±SD.n=6) Group10d17d21dControl3.566±0.3985.492±0.7318.341±0.687DCs3.008±0.3673.914±0.7724.664±0.435*ADM2.297±0.2542.735±0.521*3.513±0.348*☆DCs+ADM2.138±0.3602.269±0.418*2.451±0.325*☆△ *P<0.05vscontrol;☆P<0.05vsDCs;△P<0.05vsADM. Figure 2. The weight of tumor on tumor-bearing mice in different groups.Mean±SD.n=6.*P<0.05vscontrol group;☆P<0.05vsDCs;△P<0.05vsADM. 图2各实验组荷瘤小鼠肿瘤的重量 Figure 3. Production of cytokines in the serum of tumor-bearing mice.Mean±SD.n=6.*P<0.05vscontrol;☆P<0.05vsDCs;△P<0.05vsADM. 图3各组小鼠血清细胞因子水平 DCs作为一种专职抗原提呈细胞,能摄取、加工及处理抗原,并将抗原提呈给T细胞,启动适应性免疫应答,从而诱导高效而特异的抗肿瘤免疫[3]。DCs通过酶解抗原,并以抗原肽-MHC复合物的形式表达于细胞表面,该复合物能被T细胞所识别,并能够刺激初始T细胞增殖,激发特异性的细胞毒性作用。因此,以 DCs 为基础的免疫疗法在当今肿瘤治疗中是最有价值的方法之一。 然而由于肿瘤患者体内肿瘤免疫抑制作用的影响,DCs处于失能状态,难以激发机体有效的抗肿瘤免疫反应[4],同时肿瘤细胞免疫原性低、宿主对肿瘤抗原缺乏反应是恶性肿瘤发生和发展的重要因素。目前DCs疫苗主要是通过人工合成某种已知抗原肽、核酸、肿瘤细胞等致敏自体DCs细胞制备而成,从而激活体内特异性细胞毒反应[5],是以 DCs 为基础肿瘤免疫治疗的基本原理,然而单一的免疫治疗效果并非如人们所期待的,近年来已有不少学者发现接受自体DCs疫苗治疗的患者,病情有所加重,生存期缩短[6],出现DCs功能抑制,引起机体对肿瘤抗原的免疫耐受并促进肿瘤生长[7],表明DCs疫苗的临床应用还存在许多亟待解决的问题[8]。 研究表明,免疫的最佳“危险信号”是渐进性坏死的肿瘤细胞或凋亡小体,这些细胞或小体可释放肿瘤相关抗原[9]。化疗药物是抗肿瘤治疗的重要手段之一,化疗药物可引起肿瘤细胞的死亡,其死亡方式包括坏死或凋亡。这些死亡的细胞或其产物可向DCs提供抗原。ADM在体内外都能诱导免疫原性瘤细胞死亡,而不影响DCs疫苗的免疫原性,且能增强其抗肿瘤作用[2]。本研究应用ADM联合肿瘤抗原致敏的DCs疫苗,研究其对荷瘤小鼠的抗肿瘤免疫效应,结果显示ADM联合DCs疫苗治疗后,能够抑制荷瘤小鼠肿瘤的生长,血清IL-2、IFN-γ和IL-12水平也较其它对照组高。IL-2、IL-12和IFN-γ在机体抗肿瘤免疫中发挥重要作用,如IL-2和IL-12刺激自然杀伤细胞或CTL的杀瘤活性,IFN-γ具有较强的抗肿瘤和免疫调节作用。IL-2和IFN-γ均为 Th1细胞直接分泌,IL-12主要由DCs等专职APC产生,是CD4+Th0细胞向Th1细胞分化的主要诱导因子。IL-2是CD4+T和CD8+T细胞增殖和分化的因子。本实验所检测的细胞因子结果间接说明了联合治疗组小鼠机体的免疫系统已处于活化状态[10]。 对于肿瘤细胞抗原的最适提呈,不仅需要尚未成熟的DCs对凋亡细胞的吞噬,且需要DCs通过与凋亡肿瘤细胞或其产物接触从而活化和成熟[11-12]。DCs与凋亡小体接触后,提供肿瘤相关抗原及活化/成熟的环境。研究表明,DCs注入到荷高自发凋亡率肿瘤的机体后,或DCs注入结合凋亡诱导治疗后,可诱导抗肿瘤应答的产生[13]。本实验结果亦证实了体外诱导成熟的DCs联合化疗药物能抑制肿瘤的生长,并刺激抗肿瘤免疫应答反应。ADM处理荷瘤小鼠后,死亡的肿瘤细胞有可能被髓细胞样的和浆细胞样的DCs高效率吞噬,从而诱导抗肿瘤免疫应答必需的抗原特异性CTL。研究发现,ADM可增加胃癌细胞热休克蛋白70的表达以及DCs对肿瘤细胞组分的摄取从而上调DCs分泌IL-12[14]。ADM处理的肿瘤细胞抗原冲击的DCs对T细胞刺激后,亦可引起IFN-γ释放增加,在本实验中得到证实。据报道,疫苗接种前一次性或反复给予ADM不会阻碍肽冲击DCs和可溶性抗原疫苗的免疫原性;这种结合疗法可诱导有效的T细胞反应[2]。DCs作为APC用于肿瘤生物治疗发挥了一定的疗效,但肿瘤机体内DCs数量少,功能缺陷,应用化疗药物和体外特异性肿瘤抗原致敏的DCs对肿瘤患者进行联合治疗,为DCs的应用及肿瘤治疗提供了研究思路与理论依据。 [1] Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution[J]. J Exp Med, 1973, 137(5):1142-1162. [2] Casati A, Zimmermann VS, Benigni F, et al. The immunogenicity of dendritic cell-based vaccines is not hampered by doxorubicin and melphalan administration[J]. J Immunol, 2005, 174(6):3317-3325. [3] 刘玉昆,刘梅兰,王蕴慧,等.母胎界面树突状细胞CCL17和CCL22表达在母胎免疫耐受中的作用[J].中国病理生理杂志,2012,28(6):1061-1065. [4] 梅林航,刘小孙,于吉人. 浆细胞样树突状细胞与实体肿瘤免疫逃逸[J]. 现代免疫学, 2011, 31(3):262-265. [5] Duios B, Lamy PJ, Chemin K, et al. Measles virus exploits dendritic cells to suppress CD4+T-cell proliferation via expression of surface viral glycoproteins independently of T-cell trans-infection[J].Cell Immunol, 2001, 214(2):173-183. [6] Wobser M, Voigt H, Houben R, et al. Dendritic cell based antitumor vaccination: impact of functional indoleamine 2, 3-dioxygenase expression[J]. Cancer Immunol Immunother,2007,56(7):1017-1024. [7] 韩超峰, 曹雪涛. 肿瘤诱导的树突状细胞功能缺陷及其机制[J].中国肿瘤生物治疗杂志,2005, 12(2): 89-93. [8] Osada T, Clay TM, Woo CY, et al. Dendritic cell-based immunotherapy[J]. Int Rev Immunol, 2006, 25(5-6):377-413. [9] 周忠信, 吕明德, 殷晓煜, 等. 微波消融后瘤内注射未成熟树突状细胞对细胞毒性 T淋巴细胞杀伤活性的影响[J].中国病理生理杂志, 2008,24(4):772-776. [10] Reinhard G, Märten A, Kiske SM, et al. Generation of dendritic cell-based vaccines for cancer therapy[J].Br J Cancer, 2002, 86(10):1529-1533. [11] 袁婷婷,刘艳荣. 树突状细胞生物学研究进展[J]. 中国实验血液学杂志, 2010, 18(4):1074-1078. [12] Feng H, Zeng Y, Graner MW, et al. Exogenous stress proteins enhance the immunogenicity of apoptotic tumor cells and stimulate antitumor immunity[J]. Blood, 2003, 101(1):245-252. [13] Choi GS, Lee MH, Kim SK, et al. Combined treatment of an intratumoral injection of dendritic cells and systemic chemotherapy (Paclitaxel) for murine fibrosarcoma[J]. Yonsei Med J,2005, 46(6): 835-842. [14] Zheng H, Li Z. Cutting edge: cross-presentation of cell-associated antigens to MHC class Ⅰ molecule is regulated by a major transcription factor for heat shock proteins[J]. J Immunol, 2004, 173(10):5929-5933. Effectofadriamycincombinedwithsensitizeddendriticcellsoncervicaltumor-bearingmice ZENG Xiao-ping2, WANG Hong-mei1, HUANG Yong-hong1, ZHOU Xiao-yan1, CAI Zhen-yu1, XU Fang-yun1 (1DepartmentofPathophysiology,2DepartmentofImmunology,BasicMedicalCollegeofNanchangUniversity,Nanchang330006,China.E-mail:wanghongmay@hotmail.com) AIM: To explore the immunotherapeutic effect of adriamycin (ADM) combined with frozen-thawed antigen-sensitized dendritic cells (DCs) on cervical tumor-bearing mice.METHODSThe U14 cervical cancer model of Kunming mice was established by subcutaneous implantion of U14 cells in axillary fossa. DCs vaccine was prepared by U14 cervical cancer cell frozen-thawed antigen-sensitized mouse bone marrow-derived DCs. Mature phenotype of sensitized DCs was identified by flow cytometry. Tumor-bearing mice were randomly divided into 4 groups and treated for 3 cycles with PBS (control), DCs vaccine, ADM and ADM combined with DCs vaccine, respectively. The tumor volume was evaluated. The tumor weight and the levels of interleukin-2 (IL-2), IL-12 and interferon γ (IFN-γ) in the serum were determined by ELISA on the 21st day.RESULTSCancer cell frozen-thawed antigen-sensitized DCs had higher expression levels of CD11C, CD80 and CD86. The volume and weight of the tumor in ADM combined with DCs vaccine group were less than those in ADM group, DCs vaccine group and control group. The tumor inhibitory rate in combination group was higher than that in the other 3 groups. Compared with the other 3 groups, the serum levels of IL-2, IL-12 and IFN-γ in combination group significantly increased.CONCLUSIONADM combined with tumor antigen-sensitized DCs vaccine can strengthen the animal antitumor immune response and effectively inhibit the growth of tumor in cervical tumor-bearing mice. Dendritic cells; Adriamycin; Tumor immunotherapy; Uterine cervical neoplasms R363 A 10.3969/j.issn.1000- 4718.2013.04.028 1000- 4718(2013)04- 0734- 05 2012- 09- 07 2013- 03- 08 江西省教育厅基金资助项目(No.GJJ08086);江西省卫生厅基金资助项目(No.20072015) △通讯作者 Tel: 0791-88608348; E-mail: wanghongmay@hotmail.com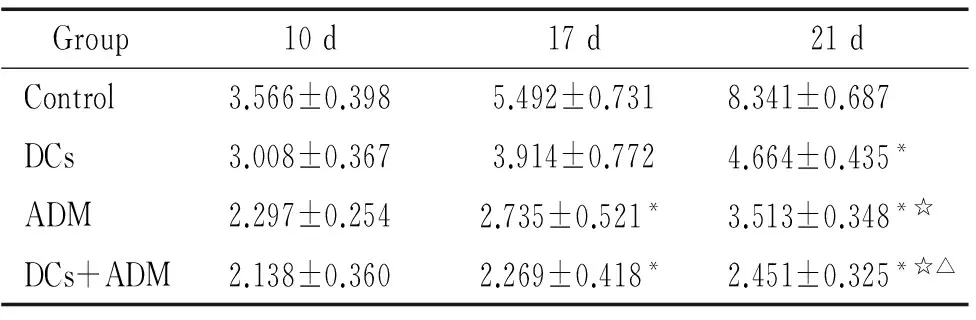

讨 论
