腺苷A2A受体激动剂CGS21680对脂多糖诱导的小鼠急性肺损伤的保护作用*
2013-10-25周伶萍吴庆国刘艳玲徐红蕾
卢 芳, 周伶萍, 吴庆国, 刘艳玲, 徐红蕾
(温州医学院附属第一医院呼吸内科,浙江 温州 325000)
腺苷A2A受体激动剂CGS21680对脂多糖诱导的小鼠急性肺损伤的保护作用*
卢 芳, 周伶萍, 吴庆国, 刘艳玲, 徐红蕾△
(温州医学院附属第一医院呼吸内科,浙江 温州 325000)
目的探讨腺苷A2A受体激动剂对脂多糖(LPS)诱导的急性肺损伤(ALI)小鼠的作用。方法采用LPS(10 mg/kg)气管内注射6 h后的ALI小鼠模型。实验动物随机分为生理盐水对照组、ALI组、CGS21680治疗组和CGS21680对照组。测定各组6 h后肺湿重/干重比值(W/D)。比色法测定各组肺组织中髓过氧化物酶(MPO)活性。Western blotting分析各组肺组织中细胞间黏附分子1(ICAM-1)和血管细胞黏附分子1(VCAM-1)的表达。酶联免疫吸附法(ELISA)检测各组小鼠血清中单核细胞趋化蛋白1(MCP-1)的浓度。观察各组肺组织病理改变。结果ALI组肺W/D、MPO活性、ICAM-1及VCAM-1表达和MCP-1浓度均较对照组显著升高。CGS21680治疗组前述各项指标较ALI组有显著下降。CGS21680组较对照组各项指标无显著差异。肺组织病理显示,ALI组可见肺间质明显充血水肿,大量炎症细胞浸润,部分肺泡腔内可见红细胞。CGS21680治疗组可显著改善肺组织的病理变化。结论腺苷A2A受体激动剂CGS21680可明显减轻LPS诱导的ALI小鼠肺组织的炎症反应及肺组织水肿,提示腺苷A2A受体激动剂在急性肺损伤中具有保护作用。
急性肺损伤; 脂多糖类; 受体,腺苷A2A
急性肺损伤(acute lung injury,ALI)是各种直接或间接肺损伤因素导致的急性呼吸衰竭,严重者可发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),临床上表现为肺部弥漫性渗出和难以纠正的低氧血症,并排除左心衰竭导致的肺充血水肿[1]。目前大量研究表明,体内失控性释放的大量促炎介质如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素8(interleukin-8,IL-8)、黏f附分子、趋化因子以及抗炎介质如白细胞介素10(interleukin-10,IL-10)的相对减少与ALI的发病密切相关[2]。其死亡率约为35%~60%[1],治疗手段有限。腺苷是一内源性嘌呤核苷,于1927年在心脏的研究中发现[3]。生理状态下细胞外的腺苷浓度较低,浓度为纳摩尔级,但在炎症或缺血缺氧组织中,其浓度能够增加到生理浓度的100倍[4]。腺苷是通过特异性的细胞表面受体发挥作用,研究已证实腺苷受体包括A1、A2A、A2B、A3四种亚型,均为G蛋白偶联受体,不同的受体发挥其不同的生理作用[5]。其中,腺苷A2A受体广泛分布于中枢神经系统、脾脏、白细胞以及血小板,在肺内也有中等量表达。目前已有大量研究认为,腺苷A2A受体的激活与抗炎作用密切相关。但腺苷A2A受体在急性肺损伤中的研究较少。基于此,我们建立了脂多糖(lipopolysaccharide,LPS)诱导的小鼠急性肺损伤模型,研究腺苷A2A受体激动剂CGS21680对小鼠急性肺损伤的作用。
材 料 和 方 法
1材料
1.1动物 健康雄性BALB/c小鼠24只,7~14周龄,体重16~25 g,由温州医学院实验动物中心提供。
1.2药品与试剂 大肠杆菌LPS(O55:B5)购于Sigma,CGS21680购于Tocris,髓过氧化物酶(myeloperoxidase,MPO)测定试剂盒购于南京建成生物工程公司,小鼠血清中单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)ELISA试剂盒以及细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)抗体和血管黏附分子1(vascular adhesion molecule 1,VCAM-1)抗体均购自武汉博士德公司,β-actin抗体购自联科生物技术有限公司。
2方法
2.1动物模型建立与分组 采用完全随机设计方法将小鼠分为4组,每组6只小鼠。ALI组:气管内注入LPS 10 mg/kg后,腹腔内注入等体积载体溶液(DMSO+NS)。CGS21680治疗组:气管内注入LPS后,腹腔内注入CGS21680 (DMSO溶解后用NS稀释)0.5 mg/kg。CGS21680对照组:在气管内注入等体积的生理盐水后,腹腔注射CGS21680 0.5 mg/kg。生理盐水对照组,气管内注入等体积的生理盐水后,腹腔内注入等体积的载体溶液。各组小鼠均在致伤6 h后处死。
2.2肺湿重/干重比值(wet weight/dry weight,W/D)测定 取右上肺称肺湿重后,将肺组织置于70 ℃烤箱内烘干72 h至完全脱水,称量肺干重,计算肺W/D,以估计肺组织水肿程度。
2.3MCP-1的测定 各组动物致伤6 h后,经眼眶采血,留取血清置-80 ℃冰箱冻存。采用ELISA测定血清中MCP-1的含量。
2.4测定中性粒细胞MPO的活性 通过供氢体邻连茴香胺供氢后生成黄色化合物,在460 nm处通过比色测定此产物的生成量,从而推算出MPO的活性。
2.5肺组织血管内皮细胞ICAM-1和VCAM-1蛋白表达的测定 取小鼠肺组织,匀浆,分离细胞膜浆蛋白,测定蛋白浓度,在12%SDS-PAGE中分离相等量蛋白,电转染到PVDF膜。Western blotting分析ICAM-1和VCAM-1的表达,以β-actin抗体作为对比。
2.6病理学检查 留取右下肺,固定于10%甲醛液中,进行石蜡切片及常规HE染色,观察光镜下肺组织形态学变化。
3统计学处理
SPSS统计分析软件进行统计学分析。数据用均数±标准差(mean±SD)表示。各组均数数据先行方差齐性检验。样本均数的比较采用方差分析。以P<0.05为差异有统计学意义。
结 果
1CGS21680对肺含水量的影响
ALI组肺W/D比值较NS对照组明显升高,其差异有统计学意义(P<0.05),表明出现肺水肿。CGS21680治疗组较ALI组有显著降低,但仍高于NS对照组,其差异有统计学意义(P<0.05)。NS对照组与CGS21680对照组W/D值无显著差异,提示CGS21680能减少急性肺损伤中肺的含水量,见表1。
2CGS21680对血清中MCP-1的影响
从表1可以看出,ALI组较NS对照组MCP-1的水平显著升高(P<0.05),CGS21680治疗组较ALI组有显著降低(P<0.05),但仍高于NS对照组,CGS21680对照组与NS对照组相比差异无统计学意义。
3CGS21680对肺组织中MPO蛋白的影响
从表1可以看出,ALI组较NS对照组MPO的水平显著升高(P<0.05),CGS21680治疗组较ALI组有显著降低,但仍高于NS对照组(P<0.05),CGS21680对照组与NS对照组相比差异无统计学意义。
4CGS21680对肺组织中的ICAM-1和VCAM-1蛋白表达的影响
从图1及表2可以看出,ALI组较NS对照组ICAM-1和fVCAM-1蛋白的表达水平显著升高(P<0.05),CGS21680治疗组较ALI组有显著降低(P<0.05),CGS21680对照组与NS对照组相比差异无统计学意义。
表1腺苷受体激动剂CGS21680对LPS诱导的急性肺损伤小鼠炎症的影响
Table 1. Effect of adenosine A2Areceptor agonist CGS21680 on inflammation of acute lung injury (ALI) mice induced by lipopolysaccharide(LPS)(mean±SD.n=6)

GroupLungW/DMCP-1(ng/L)MPOactivity[U/(gwettissue)]NS4.20±0.9039.51±22.571.35±0.35ALI5.57±0.97*259.00±110.75*2.56±0.79*CGS21680+LPS5.12±0.64#156.47±84.09#2.01±0.58#CGS216804.23±0.6524.93±12.541.48±0.36
*P<0.05vsNS;#P<0.05vsALI.
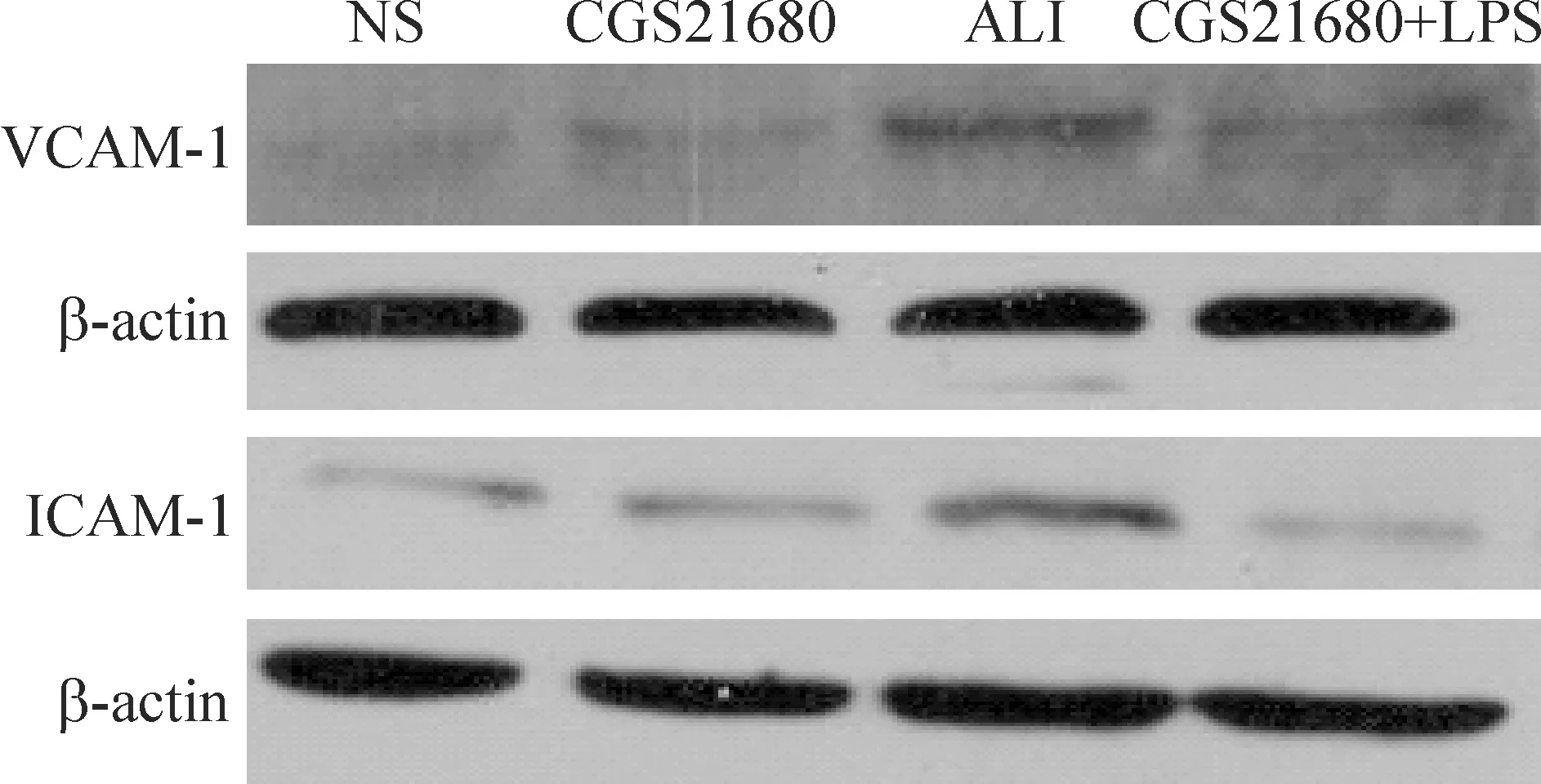
Figure 1. Effects of CGS21680 on VCAM-1 and ICAM-1 protein expression in lung tissues detected by Western blotting.
图1CGS21680对VCAM-1和ICAM-1蛋白表达的影响
表2CGS21680对VCAM-1和ICAM-1蛋白表达的影响
Table 2. Effects of CGS21680 on VCAM-1 and ICAM-1 protein expression in lung tissues(mean±SD.n=6)

GroupVCAM-1ICAM-1NS290.43±10.89289.34±14.81ALI710.55±46.14*580.10±15.58*CGS21680+LPS520.53±36.28#383.78±14.73#CGS21680298.43±16.16293.86±13.66
*P<0.05vsNS;#P<0.05vsALI.
5CGS21680对肺组织病理变化的影响
光镜下见NS对照组(图2A)和CGS21680组(图2C)肺组织结构清晰,肺泡腔及支气管腔未见炎症细胞及渗出物。ALI组(图2B)可见点、片状出血,大量中性粒细胞浸润,肺泡间隙边缘有轻度的透明膜存在,显示明显的炎症和轻度的肺水肿现象,肺泡间隔明显增厚,肺泡腔变窄。CGS21680治疗组(图2D)较模型组上述病理变化有明显改善。
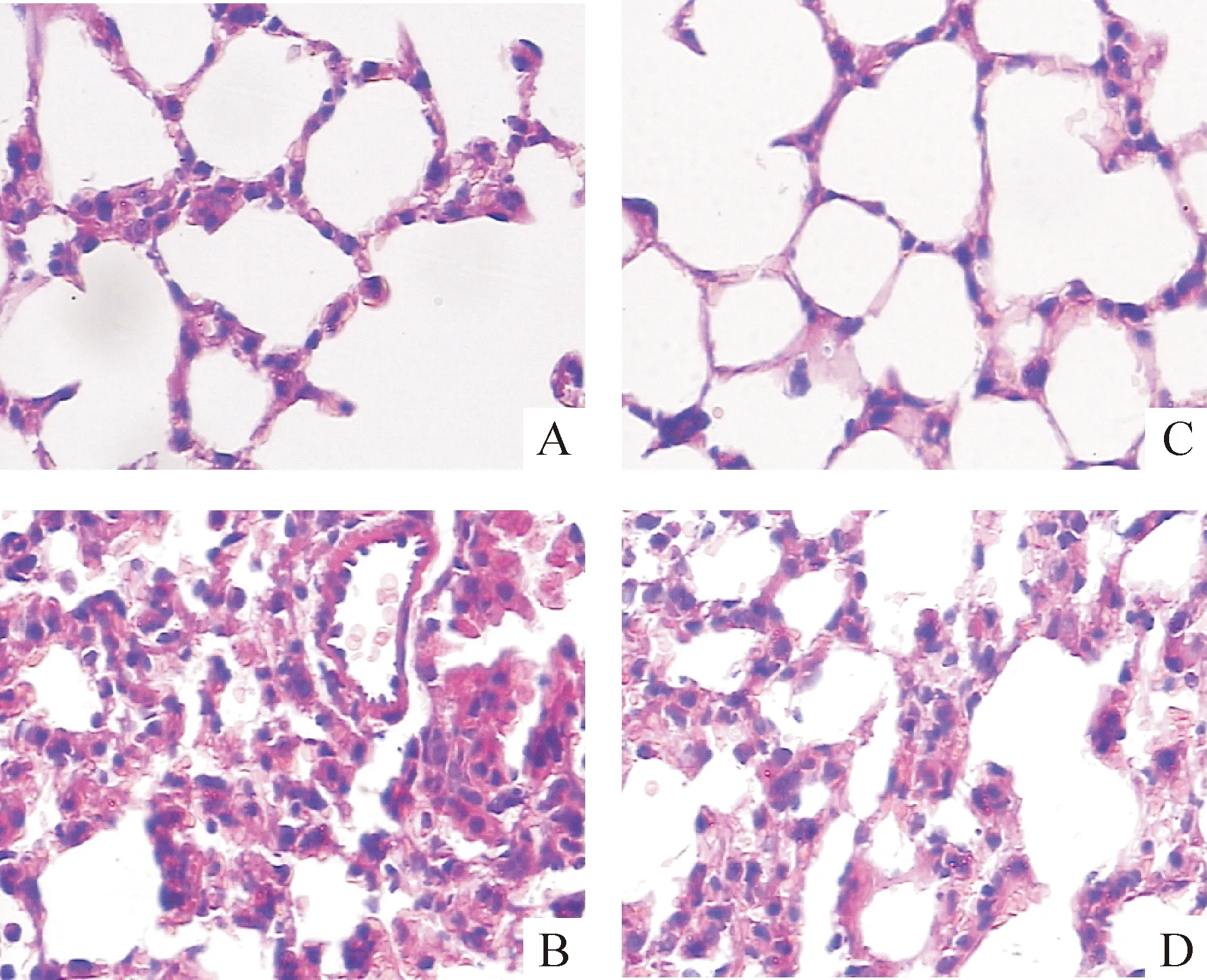
Figure 2. Effect of adenosine A2Areceptor agonist CGS21680 on lung histopathological changes in ALI mice induced by LPS(HE staining,×400).A:NS group;B:ALI group;C:CGS21680 group;D:CGS21680+LPS group.
图2CGS21680对LPS诱导的急性肺损伤小鼠肺组织病理学的影响
讨 论
ALI/ARDS是由各种肺内或肺外因素导致的肺泡毛细血管内皮细胞以及肺泡上皮细胞严重受损[6],引起肺部弥漫性的渗出,肺泡蛋白沉积,导致临床上难以纠正的严重的呼吸窘迫。目前已有大量研究表明急性肺损伤是由于机体炎症反应失控导致的临床综合征,主要以促炎因子明显升高,抑炎因子的下降以及凝血纤溶系统失衡为特征。参与这些炎症反应的细胞包括中性粒细胞、单核巨噬细胞、毛细血管内皮细胞、淋巴细胞等。其中中性粒细胞、单核巨噬细胞等在急性肺损伤中发挥了重要作用[2]。但我们的前期研究认为毛细血管内皮细胞可能是败血症中炎症反应的主要靶点[7]。所以我们推测在急性肺损伤中,毛细血管内皮细胞损伤后分泌大量黏附分子(ICAM-1和VCAM-1)、趋化因子(MCP-1)等,从而促进中性粒细胞、巨噬细胞等炎症细胞向炎症部位聚集,在败血症导致的急性肺损伤中可能发挥更为重要的作用,
腺苷来源于腺嘌呤核苷酸的分解代谢,在机体缺血缺氧、急性或者慢性炎症情况下大量生成。腺苷通过结合腺苷受体发挥作用。腺苷受体有A1、A2A、A2B、A3四种亚型,其中腺苷A2A受体基因定位于22q11.2,主要通过偶联霍乱毒素敏感的GS蛋白活化腺苷酸环化酶,提高细胞内cAMP的浓度发挥作用。腺苷A2A受体分布广泛,在纹状体、心、肺、肝、肾等组织均有表达,而在细胞上,如淋巴细胞、中性粒细胞、小胶质细胞、单核巨噬细胞、血小板、内皮细胞、成纤维细胞、自然杀伤细胞等,也呈高水平表达。Kumar等[8]研究认为,腺苷A2A受体活化能够抑制中性粒细胞黏附血管内皮并向炎症组织浸润,抑制氧自由基的形成,抑制内皮细胞活化,抑制单核巨噬细胞的增殖分化以及炎症因子的分泌而起到抗炎作用。大量研究证实,腺苷A2A受体的激活能明显减轻败血症的脏器损害,在胃肠炎、急性肝炎、肾小球肾炎方面也发挥有力的保护作用,但其在中枢神经系统方面的作用既有保护作用又能加重损伤。
CGS21680是腺苷A2A受体的高效激动剂。在对鼠的一系列体内研究中,CGS21680被证实能减轻通气相关性肺损伤[9],能预防创伤/失血性休克导致的肺损伤[10],能减轻角叉菜胶诱导的胸膜炎模型中的肺损伤[11]。此外,腺苷A2A受体激活还能增加小鼠肺泡中液体的清除[5]。但在LPS诱导的急性肺损伤中,在急性肺损伤毛细血管内皮细胞的功能方面,关于腺苷A2A受体的影响研究较少。本实验采用LPS气管内注入,结果显示LPS组相比于生理盐水对照组,ICAM-1、VCAM-1以及MCP-1的表达明显升高,肺组织病理显示肺组织中大量中性粒细胞浸润,肺泡内水肿液积聚,间质充血水肿,表明造模成功。CGS21680治疗组能够显著降低LPS诱导的急性肺损伤小鼠早期的ICAM-1、VCAM-1(间接反映毛细血管内皮细胞损伤)以及MCP-1(反映急性炎症过程中趋化因子的变化)的水平,降低中性粒细胞的肺组织浸润(MPO活性间接反映中性粒细胞浸润程度),减少肺泡内液体的积聚(间接反映毛细血管内皮细胞的机械性损伤)。肺组织病理同样显示CGS21680治疗组肺损伤程度较LPS组明显减轻。LPS是通过结合Toll样受体4,激活NF-κB途径导致的系统性炎症综合征。杨红等[12]研究认为LPS是通过损伤肺血管内皮细胞导致急性肺损伤。Murphree等[13]在体外腹膜内巨噬细胞研究中发现,在LPS刺激细胞后,细胞表面腺苷A2A受体数量增加约290倍,通过腺苷A2A激动剂ATL146e干预后,TNF-α释放明显减少,提示NF-κB途径能诱导腺苷A2A受体的生成。所以我们推测,激活腺苷A2A受体是通过抑制NF-κB途径,抑制毛细血管内皮细胞的损伤,从而抑制中性粒细胞以及巨噬细胞等炎症细胞的促炎效应,从而发挥抗炎及肺保护作用,但其具体的机制需要在以后的研究中进一步明确。值得注意的一点是,腺苷A2A受体的激活是过度炎症的机体负反馈调节,其过度激活可能导致机体的免疫保护作用受到限制,继而导致入侵病原体的扩散,最终加重肺损伤。故腺苷A2A受体的作用需要在以后的研究中进一步明确。
[1] Eckle T,Koeppen M,Eltzschig HK.Role of extracellular adenosine in acute lung injury[J].Physiology,2009,24(5):298-306.
[2] 许淑云,刘晓晴.细胞因子和急性肺损伤[J].国外医学:呼吸系统分册, 2001,21(4):197-199.
[3] Eltzschig HK.Adenosine:an old drug newly discovered[J].Anesthesiology,2009,111(4):904-915.
[4] Barletta KE,Ley K,Mehrad B.Regulation of neutrophil function by adenosine[J].Arterioscler Thromb Vasc Biol,2012,32(4):856-864.
[5] Schepp CP,Reutershan J.Bench-to-bedside review:adenosine receptors - promising targets in acute lung injury?[J].Crit Care,2008,12(5):226.
[6] 中华医学会重症医学分会.急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)[J].中国危重病急救医学,2006,18(12):706-710.
[7] Xu HL,Ye XB,Steinberg H,et al.Selective blockade of endothelial NF-κB pathway differentially affects systemic inflammation and multiple organ dysfunction and injury in septic mice[J].J Pathol,2010,220(4):490-498.
[8] Kumar V,Sharma A.Adenosine:an endogenous modulator of innate immune system with therapeutic potential[J].Eur J Pharmacol,2009,616(1-3):7-15.
[9] Chen CM,Penuelas O,Quinn K,et al.Protective effects of adenosine A2Areceptor agonist in ventilator-induced lung injury in rats[J].Crit Care Med,2009,37(7):2235-2241.[10] Hasko G,Xu DZ,Lu Q,et al.Adenosine A2Areceptor activation reduces lung injury in trauma/hemorrhagic shock[J].Crit Care Med,2006,34(4):1119-1125.
[11] Impellizzeri D,Di Paola R,Esposito E,et al.CGS21680,an agonist of the adenosine (A2A)receptor,decreases acute lung inflammation[J].Eur J Pharmacol,2011,668(1-2):305-316.
[12] 杨 红,斯 琴,孙红宇.肺血管内皮细胞在大鼠急性肺损伤发生中的作用[J].中国病理生理杂志,2000,16(9):831-834.
[13] Murphree LJ,Sullivan GW,Marshall MA,et al.Lipopolysaccharide rapidly modifies adenosine receptor transcripts in murine and human macrophages:roles of NF-κB in A2Aadenosine receptor induction[J].Biochem J,2005,391(3):575-580.
ProtectiveeffectofadenosineA2AreceptoragonistCGS21680onmicewithlipopolysaccharideinducedacutelunginjury
LU Fang, ZHOU Ling-ping, WU Qing-guo, LIU Yan-ling, XU Hong-lei
(DepartmentofRespiratory,theFirstAffiliatedHospitalofWenzhouMedicalCollege,Wenzhou325000,China.E-mail:xfhl2000@163.com)
AIM: To investigate the effect of adenosine A2Areceptor agonist on mice with acute lung injury (ALI) induced by lipopolysaccharide (LPS).METHODSThe mouse model of ALI was established by intraperitoneal injection of LPS. The mice were randomly divided into saline control group, ALI group, CGS21680 treatment group and CGS21680 control group. Six hours after LPS injection, the mice were sacrificed. The ratio of pulmonary wet weight to dry weight (W/D) was measured to assess the extent of pulmonary edema. Neutrophil infiltration was assayed by determining the myeloperoxidase(MPO) activity in lung tissues.The expression of intercellular adhesion molecule 1 (ICAM-1) and vascular cell adhesion molecule 1(VCAM-1) was detected by Western blotting. The level of monocyte chemoattractant protein 1 (MCP-1) in the serum was examined by ELISA. The pathological changes of the lung were observed.RESULTSThe lung W/D, MPO activity, the expression of ICAM-1 and VCAM-1 intercellular adhesion molecule 1 (ICAM-1) and vascular cell adhesion molecule 1(VCAM-1),and the concentration of MCP-1 in ALI group were significantly higher than those in control group. All indexes reduced significantly in CGS21680 treatment group as compared with ALI group. No statistical difference between CGS21680 group and control groups was observed. Marked pulmonary interstitial hyperemia, edema, and infiltration of a large number of inflammatory cells and red blood cells were observed in some alveolar space in ALI group. Treatment with CGS21680 greatly improved the pathological changes of the lung tissues.CONCLUSIONAdenosine A2Aagonist CGS21680 has a protective effect on mice with acute lung injury.
Acute lung injury; Lipopolysaccharides; Receptors,adenosine A2A
R563
A
10.3969/j.issn.1000- 4718.2013.04.029
1000- 4718(2013)04- 0739- 05
2012- 10- 15
2013- 03- 01
浙江省自然科学基金资助项目(No. LY12H01001)
△通讯作者 Tel: 0577-55579275; E-mail: xfhl2000@163.com
