脐血与成人外周血粒细胞Toll样受体表达的比较*
2013-10-25陈智聪廖继东谷景义杨晓蕾柳国胜李扬秋
刘 俊, 吴 瑕, 陈智聪, 廖继东△, 谷景义, 杨晓蕾, 柳国胜, 吴 慧, 李扬秋
(暨南大学 1医学院田家炳医学实验中心, 2第一临床医院, 3医学院血液病研究所,广东 广州 510632)
脐血与成人外周血粒细胞Toll样受体表达的比较*
刘 俊1, 吴 瑕2, 陈智聪1, 廖继东1△, 谷景义1, 杨晓蕾1, 柳国胜2, 吴 慧2, 李扬秋3
(暨南大学1医学院田家炳医学实验中心,2第一临床医院,3医学院血液病研究所,广东 广州 510632)
目的比较脐血与成人外周血粒细胞Toll样受体(TLRs)的表达情况,为新生儿相关疾病的临床治疗积累实验资料。方法取脐血和成人外周血,用密度梯度离心结合红细胞裂解法分离、收集粒细胞,流式细胞术鉴定粒细胞纯度,RT-qPCR检测TLRs 10个成员的mRNA表达水平,流式细胞术测定部分TLRs的蛋白荧光强度。结果(1)流式细胞术检测结果:采用密度梯度离心结合红细胞裂解法分离收集的脐血粒细胞CD19-CD24+为(95.66±1.73)%,CD3+为(4.27±1.22)%,成人外周血粒细胞CD19-CD24+为(95.48±2.13)%,CD3+为(4.82±1.07)%。(2)RT-qPCR结果显示:脐血粒细胞和成人外周血粒细胞TLR1(0.141±0.091vs0.691±0.447)、TLR2(0.388±0.337vs0.901±0.508)、TLR4(0.093±0.071vs0.254±0.147)、TLR6(0.056±0.045vs0.202±0.034)、TLR7(0.001±0.001vs0.004±0.003)和TLR8(0.046±0.040vs0.211±0.146)的表达差异有统计学意义(P<0.01),TLR3、TLR5、TLR9和TLR10的表达差异无统计学意义(P>0.05);其中TLR3、TLR7和TLR9在脐血和成人外周血粒细胞的相对表达水平均较低。(3)流式分析显示脐血与成人外周血粒细胞TLR2平均蛋白荧光强度(21.40±3.09vs30.50±5.69)差异有统计学意义(P<0.05);而TLR4平均蛋白荧光强度差异无统计学意义(P>0.05)。结论脐血粒细胞TLR1、TLR2、TLR4和TLR6 mRNA及TLR2蛋白表达低于成人外周血粒细胞,提示新生儿粒细胞识别细菌性病原微生物感染的能力可能存在缺陷或尚未完全成熟。这是否与新生儿急性细菌性毒血症发病及病死率较高有直接联系,有待进一步研究。
新生儿; 脐血; 粒细胞; Toll样受体; 基因表达
新生儿的感染性疾病发病率及病死率较高,天然免疫和获得免疫系统均未发育成熟是其主要原因。天然免疫系统是新生儿时期的主要保护屏障,粒细胞是主要的天然免疫功能细胞,在保护新生儿免受细菌等病原微生物的感染中起着重要作用[1-2]。新生儿粒细胞数量不足以及功能缺陷是导致新生儿细菌性败血症死亡的主要内因[3-4]。Toll 样受体(Toll-like receptors, TLRs) 是天然免疫受体超家族中重要一员,可识别病原相关分子模式(pathogen-associated molecular patterns, PAMP)结构,启动天然免疫应答和诱发调节获得免疫[5-6]。TLRs是粒细胞重要功能受体之一[7]。Prince等[8]发现除TLR3和TLR7外,TLRs家族成员在中性粒细胞均有表达。本研究对脐血与成人外周血粒细胞TLRs家族所有成员的基因表达水平进行全面的对比分析,为新生儿天然免疫状况研究及相关疾病的临床治疗提供第一手实验资料。
材 料 和 方 法
1材料
取暨南大学附属第一医院妇产科分娩的胎龄介于37~42周、体重介于2.5~4.0 kg间的正常新生儿17例,其中男10例,女7例,均征得产妇及家属的同意,其母在妊娠期无原发性高血压、冠心病、糖尿病、甲状腺疾病史、急慢性肾炎以及肿瘤等内外科合并症和妊娠并发症,无酗酒吸烟、吸毒等不良嗜好;剔除因任何疾病出生3 d内需转新生儿病房的新生儿;成人外周血13例,取自正常自愿者,最小年龄23岁,最大年龄54岁,中位年龄30岁,男6例,女7例。
2方法
2.1血液样本 采用2 mL EDTA-K2真空抗凝管收集,血量为4~6 mL,储存于4 ℃冰箱,并在1 d之内进行样本的处理。
2.2粒细胞分离与收集 采用淋巴细胞分离液(购自北京达科为生物技术有限公司)与红细胞裂解液[9]分离收集粒细胞。
2.3RT-PCR
2.3.1细胞总RNA提取与鉴定 RNA提取方法按天根RNAsimple Total RNA Kit说明书操作;取2 μL用微量核酸定量仪(Thermo)检测RNA纯度以及浓度。
2.3.2引物设计与合成 根据GenBank数据库,由Oligo 7.0设计,并用NCBI Primer-BLAST分析引物特异性满足要求之后由上海英维捷基贸易有限公司合成,所有引物均经过PCR扩增产物测序,Vector NTI比对分析验证证实合格,引物序列见表1。

表1 TLR1~TLR10 PCR引物序列
2.3.3cDNA合成 按东洋纺ReverTra Ace qPCR RT Kit操作指南进行。
2.3.4PCR 根据美津生物2×Taq MasterMix配置PCR反应体系,在PCR仪(东胜创新)上以94 ℃ 2 min,94 ℃ 30 s,61 ℃ 30 s,72 ℃ 30 s,72 ℃ 2 min,共35个循环。收集产物,取5 μL进行琼脂糖凝胶电泳(2%),观察条带大小与预期值是否一致,剩余产物送至北京六合华大基因科技股份有限公司进行测序,测序结果用Vector NTI进行比对分析。选取扩增片段序列与目标序列一致的引物作为样本分析用引物。
2.3.5RT-qPCR 根据东洋纺THUNDERBIRD SYBR qPCR Mix配置PCR反应体系,在荧光定量PCR仪(Bio-Rad PTC-200)上以95 ℃ 1 min,95 ℃ 15 s,61 ℃ 15 s,72 ℃ 30 s,读板,共45个循环。观察扩增动力学曲线和熔解曲线,用2-ΔΔCt方法进行相对定量,计算得出目的基因相对于管家基因GAPDH的量。
2.4流式细胞术检测细胞标志物和TLR2和TLR4表达量 取上述分离收集的细胞,采用流式细胞仪(FACScan,Becton Dickinson)检测细胞表面抗原CD3、CD19和CD24;对脐血和成人外周血粒细胞进行TLR2和TLR4蛋白表达量检测,检测结果以平均荧光强度表示。
3统计学处理
用SPSS 13.0统计软件进行分析。数据用均数±标准差(mean±SD)表示,检验方差齐性,采用两组样本t检验。以P<0.05为差异有统计学意义。
结 果
1粒细胞流式细胞术检测结果
脐血粒细胞CD19-CD24+为(95.66±1.73)%,CD3+为(4.27±1.22)%,成人外周血粒细胞CD19-CD24+为(95.48±2.13)%,CD3+为(4.82±1.07)%,见图1。CD19-CD24+细胞数均达到95%以上,且CD3+细胞率均低于6%,显示采用密度梯度离心结合红细胞裂解的方法分离获得了较高纯度的粒细胞。
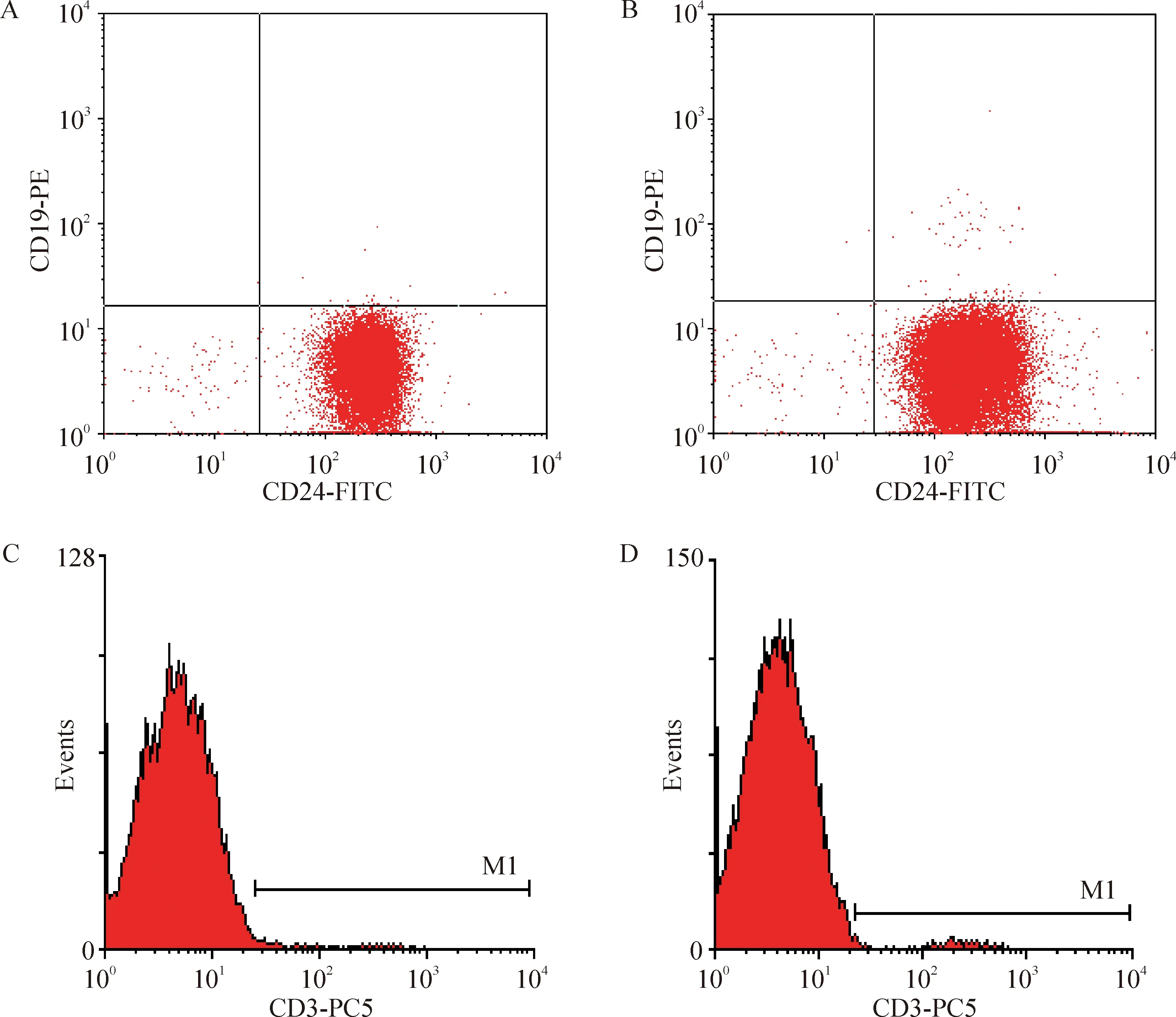
Figure 1. The flow cytometry results of granulocytes from umbilical cord blood (A,C) and adult peripheral blood (B,D).
图1脐血和成人外周血粒细胞流式细胞术检测结果
2RT-PCR产物电泳分析结果
RT-PCR产物凝胶电泳结果见图2,结果显示TLR1~TLR10和GAPDH的目的条带单一清晰且与预期值相符。
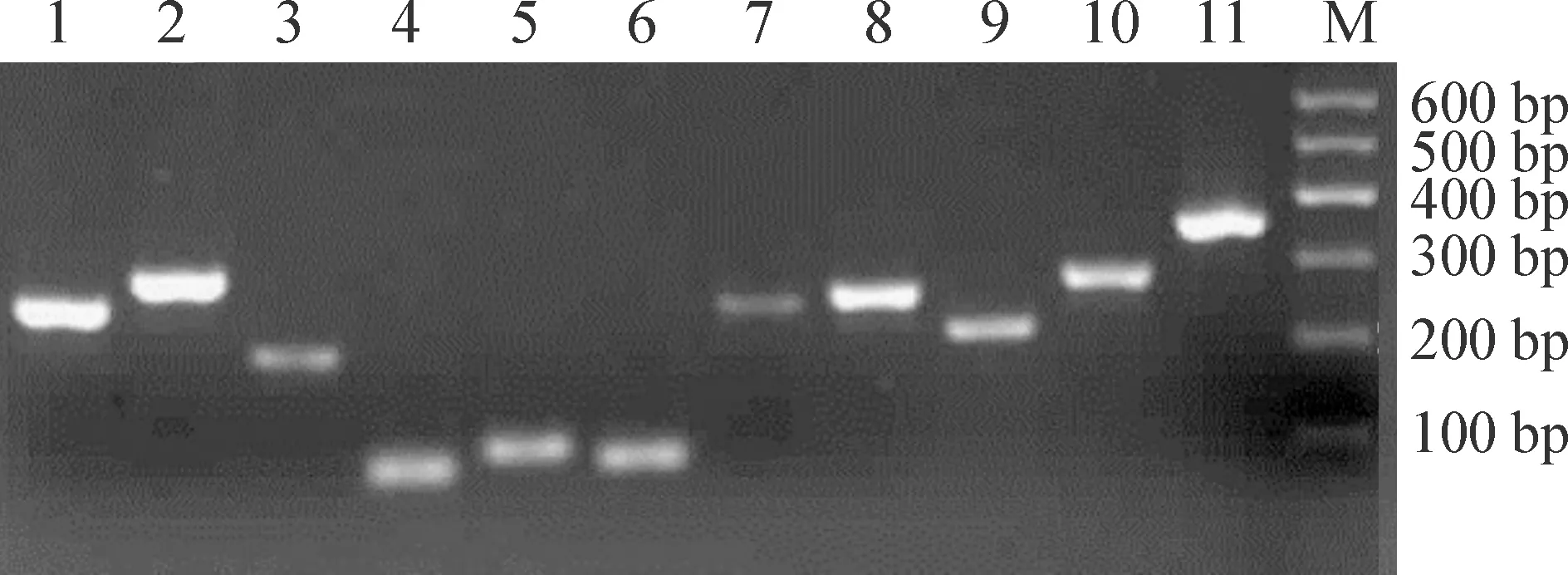
Figure 2. The agarose gel electrophoretogram of TLR1~TLR10 and GAPDH PCR products. 1:TLR1;2:TLR2;3:TLR3;4:TLR4;5:TLR5;6:TLR6;7:TLR7;8:TLR8;9:TLR9;10:TLR10;11:GAPDH; M:marker.
图2TLR1~TLR10和GAPDHPCR产物的琼脂糖凝胶电泳图
3脐血与成人外周血粒细胞TLRs
RT-qPCR结果显示,脐血粒细胞和成人外周血粒细胞TLR1(0.141±0.091vs0.691±0.447)、TLR2(0.388±0.337vs0.901±0.508)、TLR4(0.093±0.071vs0.254±0.147)、TLR6(0.056±0.045vs0.202±0.034)、TLR7(0.001±0.001vs0.004±0.003)和TLR8(0.046±0.040vs0.211±0.146)的表达差异有统计学意义(P<0.01),TLT3、TLT5、TLR9和TLR10的表达差异无统计学意义(P>0.05);其中TLR3、TLR7和TLR9在脐血和成人外周血粒细胞的相对表达水平均较低,见图3。
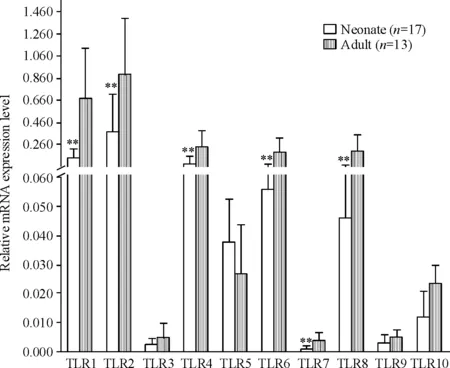
Figure 3. The comparison of TLR1~TLR10 mRNA expression in granulocytes from umbilical cord blood and adult peripheral blood.Mean±SD.**P<0.01vsadult group.
图3脐血与成人外周血粒细胞的TLR1~TLR10mRNA表达量比较
4流式细胞术检测TLR2和TLR4蛋白荧光强度结果
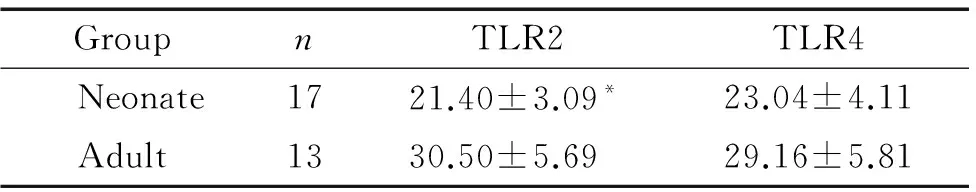
脐血与成人外周血粒细胞TLR2和TLR4的平均蛋白荧光强度见表2。脐血粒细胞TLR2和TLR4的平均蛋白荧光强度均低于成人外周血粒细胞,且两者间TLR2的平均蛋白荧光强度差异有统计学意义(P<0.05)。
讨 论
新生儿的感染性疾病发病率及病死率较高,先天免疫和获得免疫系统均未成熟是其主要原因。先天免疫系统是新生儿时期的主要保护屏障,粒细胞是先天免疫系统最丰富的细胞,是急性炎症反应的最终效应细胞,在清除外来病原体的过程中起着至关重要的作用。它们还参与先天和获得免疫细胞的激活和调节过程。在包括细胞内病原体引起的感染、自身免疫性疾病、慢性炎症和癌症等疾病的发病机制中起着关键性作用。因此,粒细胞在保护新生儿免受细菌性病原微生物的感染中起着重要作用[1-2, 7]。然而新生儿粒细胞存在数量不足以及功能缺陷,这是导致新生儿细菌性败血症死亡的主要因素之一[3-4]。
表2脐血与成人外周血粒细胞TLR2和TLR4的平均蛋白荧光强度
Table 2. The mean protein fluorescence intensity of TLR2 and TLR4 in granulocytes from umbilical cord blood and adult peripheral blood (mean±SD)
GroupnTLR2TLR4Neonate1721.40±3.09*23.04±4.11Adult1330.50±5.6929.16±5.81
*P<0.05vsadult group.
我们采用随机抽取法从华侨医院妇产科收集17例正常足月新生儿的脐血和13例正常成人自愿者外周血,按指引提取合格粒细胞并提取RNA和合成cDNA后进行各基因检测分析。所用的RT-PCR引物经扩增产物测序,Vector NTI比对分析验证证实合格,保证后续RT-qPCR分析脐血与成人外周血粒细胞TLRs家族成员的基因表达情况的可信性。用流式细胞术检测粒细胞TLR2和TLR4的平均蛋白荧光强度,有效避免因细胞蛋白提取过程中目标蛋白丢失而产生的实验误差。
TLRs是天然免疫受体超家族中一个极其重要的受体家族,表达于多种类型的组织细胞,能够识别病原相关分子模式,启动天然免疫应答,清除病原体并指导和调控获得免疫。已知人类体细胞共存在10个TLRs家族成员,部分成员参与免疫细胞的调控[1, 10]。中性粒细胞上的TLRs与PAMPs及内源性配体结合后,可激活天然免疫反应,介导急性炎症反应,直接杀伤入侵病原微生物[8]。研究发现新生儿胎龄越小,其脐血单个核细胞TLR2和TLR4水平越低,推测可能是新生儿天然免疫能力低下,易患细菌性败血症等严重感染性疾病的重要原因[11]。林桃等[12]研究显示在新生儿败血症中随着C反应蛋白升高,其外周血单个核细胞TLR2同步升高,两者呈正相关,且均与发病的早晚有关。Wu等[13]发现TLR4在新生儿窒息导致肾脏缺血再灌注损伤时所激发的炎症反应中起着关键作用。且 TLR4 的异常信号转导可能是坏死性小肠结肠炎分子发病机制之一[14]。Liu等[15]研究表明当新生儿发生坏死性小肠结肠炎时,所有的 TLRs 均在 48 h内发生变化,早于小肠结肠的组织形态学变化。上述报道均以脐血单个核细胞或组织中的TLRs为研究对象,探讨其表达变化与新生儿并发症的关系。由于常用密度梯度离心法分离所得单个核细胞主要为T、B淋巴细胞以及单核细胞的混合体,且脐血单个核细胞的情况更为复杂,除淋巴、单核细胞外,还包含造血干细胞、间充质干细胞等幼稚的细胞组分[16-17]。已知这些细胞均可表达不同的TLRs家族成员[18-19],对实验结果的评判存在一定的干扰。新生儿以T、B淋巴细胞为主的获得免疫体系相对于以粒细胞为主的天然免疫体系更为幼稚[1]。天然免疫是新生儿机体首要的或关键的屏障,与新生儿的健康休戚相关。
在本实验中,我们以脐血粒细胞为研究对象,通过密度梯度离心结合红细胞溶解获取较高纯度的粒细胞,较少的淋巴细胞污染,较好地规避造血干细胞、间充质干细胞等幼稚细胞的干扰,分析粒细胞整个Toll样受体家族表达的情况。结果发现,TLRs所有家族成员基因的表达,无论在脐血还是成人外周血粒细胞均存在个体差异。TLR1、TLR2、TLR4和TLR6 mRNA在新生儿粒细胞中的表达明显低于成人外周血粒细胞;且TLR2和TLR4蛋白表达检测与Viemann等[20]检测结果一致,显示新生儿粒细胞TLR2表达低于成人,而TLR4差别无统计学意义。TLR2 能和TLR1或TLR6结合形成异质二聚体,可识别一部分革兰阳性细菌的脂蛋白和磷壁酸、分支杆菌细胞壁、钩端螺旋体的脂多糖LPS、酵母菌细胞壁以及少见的脂多糖等类配体[21],它们的低下是否正是新生儿粒细胞不能全面和迅速地识别并清除上述病原体,从而导致病菌在血液中大量繁殖引起新生儿细菌性败血症的内在因素有待进一步探讨;TLR3、TLR7、 TLR8和TLR9表达于细胞内,主要是对病毒核酸的监测和识别,TLR3 识别双链RNA,而TLR7和TLR8 识别单链RNA,TLR9识别未甲基化的CG辅酶Ⅰ(CpG 序列),调节细菌DNA 和某些病毒的反应[22-23]。我们的结果显示TLR3、TLR7和TLR9 mRNA在脐血与成人外周血粒细胞中均低表达,而Prince等[8]发现中性粒细胞不表达TLR3和TLR7。低丰度的TLR3 和TLR7 mRNA是样本中残存的T、B细胞所致[18],还是粒细胞表达低下? 以及TLR3、TLR7和TLR9 mRNA的低表达是否与粒细胞主要针对细菌性病原微生物入侵的天然特性有关,有待进一步探讨。
综上所述,本研究发现脐血粒细胞与细菌性病原微生物成分识别相关的TLR1、TLR2、TLR4和TLR6 mRNA及TLR2蛋白表达低于成人外周血粒细胞,与新生儿,尤其是早产儿急性细菌性毒血症发病及病死率较高的临床表现一致,为新生儿相关疾病的临床治疗积累了实验资料。因本实验分离的粒细胞中仍残存约5%的T细胞,仍有进一步提高样本细胞纯度的空间,以明确TLR3和TLR7 mRNA的表达情况。
[1] Maródi L. Innate cellular immune responses in newborns[J]. Clin Immunol, 2006, 118(2-3):137-144.
[2] Le Blanc K, Mougiakakos D. Multipotent mesenchymal stromal cells and the innate immune system[J].Nat Rev Immunol, 2012, 12(5):383-396.
[3] Cimenti C, Erwa W, Herkner KR, et al. The predictive value of immature granulocyte count and immature myeloid information in the diagnosis of neonatal sepsis[J]. Clin Chem Lab Med, 2012, 50(8):1429-1432.
[4] Melvan JN, Bagby GJ, Welsh DA, et al. Neonatal sepsis and neutrophil insufficiencies [J]. Int Rev Immunol, 2010, 29(3):315-348.
[5] Eisenbarth SC, Flavell RA. Innate instruction of adaptive immunity revisited: the inflammasome[J]. EMBO Mol Med, 2009, 1(2):92-98.
[6] Loiarro M, Gallo G, Fantò N, et al. Identification of critical residues of the MyD88 death domain involved in the recruitment of downstream kinases[J]. J Biol Chem, 2009, 284(41):28093-28103.
[7] Mantovani A, Cassatella MA, Costantini C, et al. Neutrophils in the activation and regulation of innate and adaptive immunity[J]. Nat Rev Immunol, 2011, 11(8):519-531.
[8] Prince LR, Whyte MK, Sabroe I, et al. The role of TLRs in neutrophil activation[J]. Curr Opin Pharmacol, 2011, 11(4):397-403.
[9] 巩文玉,刘 怡,李 蓓,等. 红细胞裂解液对CD34+细胞相对计数的影响[J]. 中国实验血液学杂志, 2010, 18(3):762-765.
[10] 吴 欧,刘庆敏,张 虎,等. Toll样受体家族与肥胖性高血压[J]. 中国病理生理杂志,2011,27(9):1844-1847.
[11] 王 琳,徐建波,田 元,等. 新生儿脐血 Toll 样受体变化及其意义[J].中华儿科杂志, 2007, 45(5):365-368.
[12] 林 桃,李 超,邓锦有,等. Toll样受体2在败血症新生儿的表达及其与C反应蛋白的相关性[J]. 实用儿科临床杂志, 2010, 25(10):741-742.
[13] Wu H, Chen G, Wyburn KR, et al. TLR4 activation mediates kidney ischemia/reperfusion injury[J].J Clin Invest, 2007, 117(10):2847-2859.
[14] Afrazi A, Sodhi CP, Richardson W, et al. New insights into the pathogenesis and treatment of necrotizing enterocolitis: Toll-like receptors and beyond[J]. Pediatr Res, 2011, 69(3):183-188.
[15] Liu Y, Zhu L, Fatheree NY, et al. Changes in intestinal Toll-like receptors and cytokines precede histological injury in a rat model of necrotizing enterocolitis[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 297(3):G442-G450.
[16] 张素华,林丹丹,张美娟,等. Ficoll密度梯度离心法分离猪外周血单个核细胞条件的探讨[J]. 中国血吸虫病防治杂志, 2007, 19(3):192-195.
[17] 郭继强,刘爱兵,沈 丹. 两步法分离人脐血单个核细胞的最佳条件[J]. 中国组织工程研究与临床康复, 2011, 15(45):8447-8450.
[18] Wong CK, Wong PT, Tam LS, et al. Activation profile of Toll-like receptors of peripheral blood lymphocytes in patients with systemic lupus erythematosus[J]. Clin Exp Immunol, 2010, 159(1):11-22.
[19] Tomchuck SL, Zwezdaryk KJ,Coffelt SB, et al. Toll-like receptors on human mesenchymal stem cells drive their migration and immunomodulating responses[J]. Stem Cells, 2008, 26(1):99-107.
[20] Viemann D, Dubbel G, Schleifenbaum S, et al. Expression of Toll-like receptors in neonatal sepsis[J]. Pediatr Res, 2005, 58(4):654-659.
[21] Jin MS, Kim SE, Heo JY, et al. Crystal structure of the TLR1-TLR2 heterodimer induced by binding of a tri-acylated lipopeptide[J]. Cell, 2007, 130(6):1071-1082.
[22] Singh RK, Srivastava A, Singh N. Toll-like receptor signaling: a perspective to develop vaccine against leishmaniasis[J].Microbiol Res, 2012, 167(8):445-451.
[23] Xagorari A, Chlichlia K. Toll-like receptors and viruses: induction of innate antiviral immune responses[J]. Open Microbiol J, 2008, 2:49-59.
ComparisonofToll-likereceptorexpressioningranulocytesfromumbilicalcordbloodandadultperipheralblood
LIU Jun1, WU Xia2, CHEN Zhi-cong1, LIAO Ji-dong1, GU Jing-yi1, YANG Xiao-lei1, LIU Guo-sheng2, WU Hui2, LI Yang-qiu3
(1TinKa-pingCenterforMedicalExperiments,SchoolofMedicine,2theFirstClinicalHospital,3InstituteofHematology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tliaojd@jnu.edu.cn)
AIM: To compare the expression levels of Toll-like receptors (TLRs) in the granulocytes isolated from umbilical cord blood and adult peripheral blood.METHODSThe granulocytes in umbilical blood and adult peri-pheral blood were isolated by the method of density gradient centrifugation combined with red blood cell splitting. The purity of the cells was evaluated by flow cytometry. The mRNA expression levels of 10 TLRs were detected by RT-qPCR, and the protein levels of some TLRs were also tested by flow cytometry.RESULTSThe populations of CD19-CD24+cells and CD3+cells were (95.66±3.15)% and (4.19±1.54)% in neonatal granulocytes,respectively, and were (95.36±1.74)% and (4.30±0.96)% in adult granulocytes,respectively. The relative mRNA expression levels of TLRs in the granulocytes isolated from umbilical cord blood and adult peripheral blood were as follows: TLR1 0.141±0.091 and 0.691±0.447, TLR2 0.388±0.337 and 0.901±0.508, TLR4 0.093±0.071 and 0.254±0.147, TLR6 0.056±0.045 and 0.202±0.034, TLR7 0.001±0.001 and 0.004±0.003, and TLR8 0.046±0.040 and 0.211±0.146,and the diffe-rence had statistical significance (P<0.01). However, no difference in the expression levels of TLR3, TLR5, TLR9 and TLR10 between the neonatal and adult gra-nulocytes was observed (P>0.05). Among them, the mRNA expression of TLR3, TLR7 and TLR9 was at a low level in both neonatal and adult granulocytes. The protein level of TLR2 in adult gra-nulocytes (30.50±5.69) was higher than that in neonatal granulocytes (21.40±3.09,P<0.05).CONCLUSIONLow mRNA expression of TLR1, TLR2, TLR4 and TLR6, and low protein level of TLR2 in neonatal granulocytes indicate that the ability of recognizing bacterial pathogen by neonatal granulocytes may be defective or not yet fully mature.
Neonate; Umbilical cord blood; Granulocyte; Toll-like receptors; Gene expression
R363
A
10.3969/j.issn.1000- 4718.2013.04.018
1000- 4718(2013)04- 0676- 06
2012- 12- 29
2013- 02- 26
广东省产业技术研究与开发资金计划项目(No.2010B031600107);广东省自然科学基金资助项目(No.07005966)
△通讯作者Tel: 020-85225841; E-mail: tliaojd@jnu.edu.cn
