黄芪多糖通过活化AMPK和促进骨骼肌FAT/CD36转位改善成肌细胞FFAs代谢*
2013-10-25胡阳黔欧阳静萍
胡阳黔, 李 静, 刘 坚, 欧阳静萍, 宋 杰△
(1湖北医药学院附属东风医院,湖北 十堰 442000; 2湖北医药学院,湖北 十堰 442000; 3武汉大学医学院,湖北 武汉 430079)
黄芪多糖通过活化AMPK和促进骨骼肌FAT/CD36转位改善成肌细胞FFAs代谢*
胡阳黔1, 李 静2, 刘 坚2, 欧阳静萍3, 宋 杰1△
(1湖北医药学院附属东风医院,湖北 十堰 442000;2湖北医药学院,湖北 十堰 442000;3武汉大学医学院,湖北 武汉 430079)
目的探讨黄芪多糖(Astragaluspolysaccharides, APS)对骨骼肌游离脂肪酸(free fatty acids, FFAs)代谢的影响及其机制。方法培养小鼠C2C12成肌细胞;MTT法检测不同浓度FFAs作用不同时间对细胞活性的影响。根据MTT结果选取FFAs最适浓度和时间处理细胞并用APS干预,采用乙酰辅酶A合成酶-乙酰辅酶A氧化酶法检测APS干预前后培养液FFAs浓度;Western blotting测APS干预前后细胞膜脂肪酸转位酶(FAT/CD36)、总FAT/CD36、磷酸化腺苷酸活化蛋白激酶(phosphorylated AMP-activated protein kinase, p-AMPK)和总AMPK蛋白表达。结果FFAs对细胞的毒性呈浓度和时间依赖性。与FFAs组比较,FFAs+APS组细胞膜FAT/CD36及p-AMPK蛋白表达增加(P<0.05),而总FAT/CD36及总AMPK蛋白表达无明显差异(P>0.05),同时培养液FFAs浓度降低,细胞活性增加(P<0.05)。结论APS可以增加骨骼肌细胞对FFAs的摄取利用,其机制可能与活化AMPK和促进FAT/CD36转位有关。
黄芪多糖; 游离脂肪酸; 腺苷酸活化蛋白激酶
目前研究认为血浆游离脂肪酸(free fatty acids, FFAs)升高是引起胰岛素抵抗的主要因素之一[1]。骨骼肌是游离脂肪酸摄取及胰岛素抵抗发生的重要部位[2]。越来越多的证据表明FFAs通过干扰胰岛素的作用、抑制葡萄糖代谢而导致胰岛素抵抗,所以针对FFAs代谢可以提供一条很有前途的改善胰岛素抵抗和治疗2型糖尿病的途径。本实验室毛先晴等[3]研究证实黄芪多糖(Astragaluspolysaccharides, APS)治疗可明显改善高脂饮食诱导的胰岛素抵抗。本研究在上述背景基础上,就骨骼肌细胞对FFAs的代谢以及应用黄芪多糖进行干预,探讨黄芪多糖对骨骼肌FFAs代谢的影响以及可能机制。
材 料 和 方 法
1主要试剂和仪器
小鼠C2C12成肌细胞购自ATCC;低糖DMEM购自Sigma;优化水煎工艺从膜荚黄芪(上海药材公司)中提取APS(80~120 kD)(湖北中医学院药用植物鉴定教研室鉴定)[4];MTT和AMPK抑制剂compound C购自Sigma;游离脂肪酸检测试剂盒购自Wako;AMPKα Antibody购自Cell Signaling Technology; p-AMPK 抗体购自Upstate;脂肪酸转位酶(fatty acid translocase,FAT/CD36)抗体购自Santa Cruz;长链游离脂肪酸(oleate∶palmitate=2∶1)购自Sigma。
2细胞传代和培养
C2C12成肌细胞用含10%胎牛血清的低糖DMEM培养液在5% CO2、37 ℃培养箱中培养。
3实验分组
取对数生长期的细胞,倒出培养液,用无菌的缓冲液冲洗3次,0.25%胰酶消化,然后计数每个培养瓶的细胞密度,以1×109/L转入新的培养瓶。测FFAs作用时间分以下时间组:0、24 h、48 h和72 h;测FFAs作用浓度分以下浓度组:0、0.25、0.5和0.75 mmol/L。测培养液FFAs浓度变化、AMPK、p-AMPK及FAT/CD36表达情况,如下分组: (1)control组; (2)APS组,APS(200 mg/L)干预细胞24 h; (3)FFAs组, 0.25mmol/L FFAs干预细胞24 h;(4) FFAs+APS组, 0.25 mmol/L FFAs及APS(200 mg/L)共同干预细胞24 h; (5)FFAs+APS+compound C组,compound C+FFAs+APS共同干预细胞24 h。
4主要方法
4.1MTT实验 (1)取生长良好的细胞,以浓度2×107/L的细胞悬液接种96孔培养板中,培养12 h细胞贴壁后,吸弃培养液,按实验分组加入相应培养液继续培养。(2)在24 h的前4 h各取培养板1块,每孔加入浓度为5 g/L MTT 50 μL,继续培养4 h后,吸弃上清液后向每孔加入20% DMSO 100 μL,振荡后在酶标仪上以490 nm波长测吸光度(A)。
4.2Western blotting检测 将处理后的细胞裂解后,置4 ℃采用超速离心法分离提取总蛋白及胞膜蛋白,用BCA蛋白定量试剂盒定量。煮沸5 min,SDS-PAGE分离蛋白后,转印到PVDF膜上,封闭、漂洗后加入Ⅰ抗于4 ℃孵育过夜,漂洗后再加入辣根过氧化物酶标记的鼠抗兔Ⅱ抗(1∶800稀释,KPL公司)室温孵育1 h,漂洗后ECL显色,用高清晰度彩色病理细胞测量程序的图形分析软件系统测出相对吸光度值。
4.3培养液游离脂肪酸浓度测定 按试剂盒说明书步骤采用乙酰辅酶A合成酶(acetyl-CoA synthase,ACS)-乙酰辅酶A氧化酶(acetyl-CoA oxidase,ACOD)法测定。将培养液放置室温,用自动加样器移取10 μL;加入400 μL发色试剂A;5 min后,加入200 μL发色剂B;10 min后,测定吸光度,主波长546 nm,副波长660 nm。FFAs浓度测定由全自动生化仪完成,单位用mmol/L表示。
5统计学处理
数据用均数±标准差(mean±SD)表示,并采用SPSS 13.0统计软件处理,组间差异用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
10.25mmol/LFFAs作用不同时间对C2C12细胞活性的影响
0.25 mmol/L FFAs作用不同时间(24、48和72 h),各组细胞活性均明显低于control组,随着FFAs作用时间的延长,细胞活性逐渐降低,见表1。
△P<0.05vscontrol;▲P<0.05vs24 h.
2不同浓度FFAs作用24h对C2C12细胞活性的影响
不同浓度FFAs作用细胞24 h,各组细胞活性均明显低于对照组,随着FFAs作用浓度的增加,细胞活性逐渐降低,见表2。
30.25mmol/LFFAs与APS共同作用24h对C2C12细胞活性的影响
APS组与对照组差异无显著(P>0.05)。FFAs+APS组细胞活性明显高于FFAs组(P<0.05),FFAs+APS+compound C组细胞活性与FFAs组比无显著差异(P>0.05),见表3。
表2不同浓度FFAs作用24h对C2C12细胞活性的影响
Table 2. The effects of different oncentrations of FFAs on viability of C2C12 myoblasts for 24 h (mean±SD.n=8)

Group0h24hControl0.817±0.0150.838±0.0470.25mmol/LFFAs0.814±0.0240.404±0.032△0.5mmol/LFFAs0.813±0.0430.212±0.047△▲0.75mmol/LFFAs0.825±0.0330.105±0.037△▲
△P<0.05vscontrol;▲P<0.05vs0.25 mmol/L FFAs.
表3APS对FFAs导致C2C12细胞活性变化的影响
Table 3. The effects of APS on FFA-induced viability changes of C2C12 myoblasts (mean±SD.n=8)
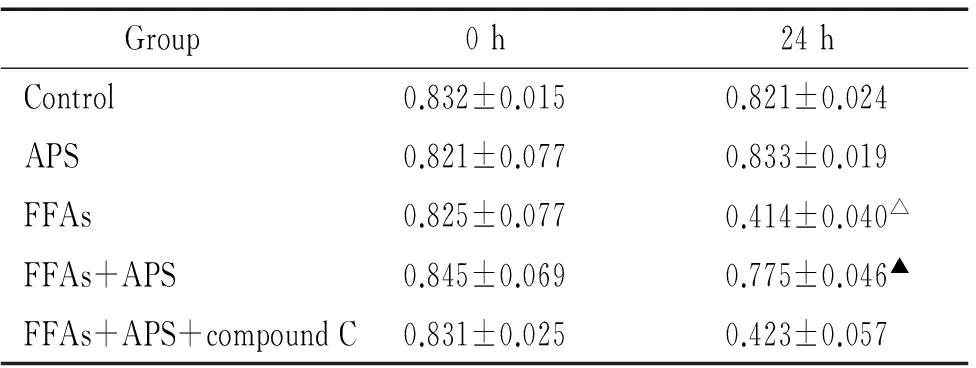
Group0h24hControl0.832±0.0150.821±0.024APS0.821±0.0770.833±0.019FFAs0.825±0.0770.414±0.040△FFAs+APS0.845±0.0690.775±0.046▲FFAs+APS+compoundC0.831±0.0250.423±0.057
△P<0.05vscontrol;▲P<0.05vsFFAs.
4培养液游离脂肪酸浓度测定
FFAs+APS组培养液FFAs浓度明显低于FFAs组(P<0.05),FFAs+APS+compound C组培养液浓度与FFAs组无显著差异(P>0.05)。APS组及对照组按分组需要未加入FFAs处理,见表4。
表4APS干预对培养液中FFAs浓度的影响
Table 4. The effects of APS on the concentration of FFAs in the culture medium (mmol/L.Mean±SD.n=8)
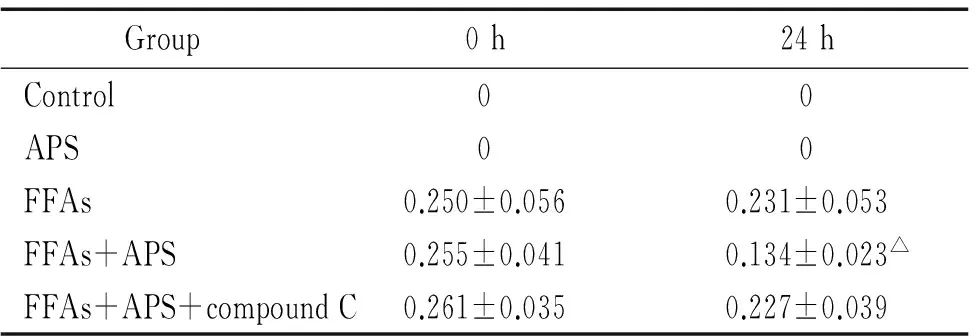
Group0h24hControl00APS00FFAs0.250±0.0560.231±0.053FFAs+APS0.255±0.0410.134±0.023△FFAs+APS+compoundC0.261±0.0350.227±0.039
△P<0.05vsFFAs.
5AMPK、p-AMPK和FAT/CD36的表达
图1显示,各组总AMPK表达无显著差异(P>0.05);FFAs组p-AMPK较对照组显著降低(P<0.05);而FFAs+APS组p-AMPK较FFAs组显著增加(P<0.05);FFAs+APS+compound C组p-AMPK与FFAs组相比无显著差异(P>0.05)。各组总FAT/CD36表达无显著差异(P>0.05);FFAs组细胞膜FAT/CD36表达较对照组显著降低(P<0.05);而FFAs+APS组细胞膜FAT/CD36表达较FFAs组和FFAs+APS+compound C组显著增加(P<0.05)。

Figure 1. The expression of FAT/CD36, AMPK and p-AMPK proteins. C: control group; A: APS group; F: FFAs group; F+A: FFAs+APS group; F+A+CC: FFAs+APS+compound C group. Mean±SD.n=4.*P<0.05vsC;▲P<0.05vsF or F+A+CC.
图1FAT/CD36、AMPK和p-AMPK蛋白的表达
讨 论
FFAs是引起胰岛素抵抗的最主要非激素物质之一, 这已经为大量流行病学资料所证实。现代医学研究表明, 在众多心血管疾病的危险因素中胰岛素抵抗处于核心地位, 或者说胰岛素抵抗是滋生多种代谢相关疾病的共同土壤。
无论是对STZ诱导的2型糖尿病动物模型,还是遗传性2型糖尿病模型(KKAy小鼠)或胰岛素抵抗模型,APS都具有增加胰岛素敏感性、改善糖耐量、降低血糖和血脂、减少肝脏脂肪沉积以及减轻体重等作用[5-7]。
本研究通过培养小鼠C2C12成肌细胞,采用不同浓度FFAs作用持续不同时间,发现FFAs对C2C12细胞的毒性呈浓度和时间依赖性:FFAs浓度越高、作用时间越长,细胞活性越低。FFAs采用了接近于临床、更有利于反映病人实际的浓度(0.25 mmol/L);为保证细胞的最佳活性,选取24 h作为FFAs的干预时间。与FFAs组比较,FFAs与APS共同作用于细胞后细胞活性明显增加。国内外已经证实FFAs增高可导致三羧酸循环减慢和枸橼酸聚集,反馈调节而使糖氧化受到抑制、糖摄取减少、酯化增强、脂解减弱,进而导致脂质在细胞内蓄积和能量供应短缺。FFAs组的细胞活性下降可能与此有关。而后续的实验证实,FFAs+APS组中APS可以促进FFAs的摄取和氧化,增强脂解,为细胞提供能量,从而改善了细胞活性。
为进一步研究APS对C2C12细胞游离脂肪酸摄取的影响及其机制,我们采用上述浓度的FFAs处理细胞,用APS进行干预,发现APS可以促进C2C12细胞对FFAs的摄取。对于上述机制的探索,我们注意到近年较受关注的FAT/CD36。FAT/CD36广泛分布在心脏、小肠、骨骼肌、脂肪等组织,它对脂肪酸的转运具有重要作用。胞浆内的FAT/CD36不能有效转运长链脂肪酸。FAT/CD36从细胞内库转位到细胞膜是肌细胞摄取脂肪酸的重要调节机制[8]。本研究证实高FFAs抑制FAT/CD36由细胞内库向细胞膜转位,从而不利于能源物质摄取。Western blotting结果证实APS可增加高FFAs状态下骨骼肌细胞FAT/CD36由细胞内库向细胞膜转位。这可能是APS促进FFAs摄取的机制。
随后我们进一步研究了APS促进FAT/CD36转位机制。我们先前研究发现APS可以活化AMPK[9]。Luiken等[10]研究发现,用AMPK的激活剂AICAR刺激心肌细胞可以增加脂肪酸的摄取,同时还发现FAT/CD36转位到细胞膜上的含量增加。Chabowski等[11]研究发现,用AICAR长期刺激心肌细胞后,FAT/CD36的mRNA和蛋白水平均显著增加。Pandke等[12]使用AMPK的激动剂β-胍基丙酸作用于心肌细胞后,其FAT/CD36的总蛋白及膜蛋白显著增加。在本研究中,通过比较分析FFAs+APS+ compound C组与FFAs+APS组蛋白表达情况,说明在AMPK抑制剂存在的情况下,APS活化AMPK的通路被阻断,进而APS促进FAT/CD36转位的作用被抑制,证实APS是通过活化AMPK进而促进FAT/CD36向细胞膜转位,从而增加FFAs的摄取。而AMPK活化后促进FAT/CD36向细胞膜转位的机制目前尚不清楚,需要我们继续研究。
在我们先前研究中[9]还发现,在高FFAs处理24 h后的C2C12细胞,APS可以活化AMPK进而抑制乙酰辅酶A羧化酶活性,从而促进FFAs氧化分解,减少FFAs在细胞内蓄积,同时为细胞提供能量。FFAs在细胞内蓄积可导致细胞毒性,APS减轻脂质在细胞内蓄积的作用具有重要的意义,它可能是APS减轻FFAs细胞毒性的重要机制。上述两方面研究证实,APS活化AMPK不仅可以增加FFAs摄取,而且可以促进进入细胞的FFAs氧化分解,为细胞提供能量,从而改善细胞脂代谢和细胞活性。
[1] Bergman RN, Ader M. Free fatty acids and pathogenesis of type 2 diabetes mellitus[J]. Trends Endocrinol Metab, 2000, 11(9):351-356.
[2] Sivitz WI. Lipotoxicity and glucotoxicity in type 2 diabetes. Effects on development and progression[J]. Postgrad Med, 2001, 109(4):55-59,63-64.
[3] 毛先晴, 欧阳静萍.黄芪多糖对饮食诱导小鼠肝脏胰岛素抵抗的预防作用[J].中国病理生理杂志, 2007, 23(11):2222-2225.
[4] 倪 艳, 苏 强, 刘 霞,等.黄芪多糖水煎提取工艺的优化试验研究[J].中国中药杂志,1998,23(5):284-286
[5] Wu Y, Ou-Yang J, Wu K, et al. Hypoglycemic effect ofAstragaluspolysaccharide and its effect on PTP1B[J]. Acta Phamacol Sin, 2005, 26(3):345-352.
[6] Wu K, Ouyang J, Wu Y, et al. Insulin sensitization and anti-obesity effects ofAstragaluspolysaccharide on high fat diet-fed C57BL/6J mice[J].FASEB J, 2006, 20(5): A1146.
[7] Mao XQ, Wu Y, Wu K, et al.Astragaluspolysaccharide reduces hepatic endoplasmic reticulum stress and restores glucose homeostasis in a diabetic KKAy mouse model[J]. Acta Pharmacol Sin, 2007, 28(12):1947-1956.
[8] Luiken JJ, Dyck DJ, Han XX, et al. Insulin induces the translocation of the fatty acid transporter FAT/CD36 to the plasma membrane embrane[J]. Am J Physiol Endocrinol Metab, 2002, 282(2):E491-E495.
[9] 宋 杰, 李 静, 胡阳黔, 等. 黄芪多糖活化AMPK减轻游离脂肪酸对C2C12成肌细胞的细胞毒性[J]. 中国病理生理杂志, 2012, 28(2):298-301.
[10] Luiken JJ,Coort SL,Willems J,et al. Contraction-induced fatty acid translocase/CD36 translocation in rat cardiac myocytes is mediated through AMP-activated protein kinase signaling[J]. Diabetes, 2003, 52(7):1627-1634.
[11] Chabowski A,Momken I,Coort SL,et al. Prolonged AMPK activation increases the expression of fatty acid transporters in cardiac myocytes and perfused hearts[J]. Mol Cell Biochem, 2006, 288(1): 201-212.
[12] Pandke KE,Mullen KL,Snook LA,et al. Decreasing intramuscular phosphagen content simultaneously increases plasma membrane FAT/CD36 and GLUT4 transporter abundance[J]. Am J Physiol Regul Integr Comp Physiol, 2008, 295(3):R806-R813.
APSimprovesfreefattyacidmetabolismbyactivatingAMPKandpromotingtranslocationofFAT/CD36inC2C12myoblasts
HU Yang-qian1, LI Jing2, LIU Jian2, OU-YANG Jing-ping3, SONG Jie1
(1DongfengAffiliatedHospitalofHubeiUniversityofMedicine,Shiyan442000,China;2HubeiUniversityofMedicine,Shiyan442000,China;3MedicalSchoolofWuhanUniversity,Wuhan430079,China.E-mail:doctorsongjie@163.com)
AIM: To investigate the effect ofAstragaluspolysaccharides (APS) on the metabolism of free fatty acids (FFAs) in C2C12 myoblasts.METHODSCultured C2C12 myoblasts were used in the study. The viability of C2C12 myoblasts treated with FFAs at different concentrations for different time was observed by MTT assay. The concentrations of FFAs in the medium were detected by acetyl-CoA synthase (ACS)-acetyl-CoA oxidase (ACOD) method. The expression of fatty acid translocase (FAT/CD36), AMPK and p-AMPK protein was examined by Western blotting.RESULTSFFAs decreased the viability of C2C12 myoblasts in a time- and concentration-dependent manner. Compared with FFAs group, the expression of cellular membrane FAT/CD36 and p-AMPK proteins increased in FFAs+APS group, but total AMPK and FAT/CD36 protein expression was not significantly changed. Meanwhile, the concentration of FFAs in the medium decreased and the cell viability increased in FFAs+APS group as compared with the group.CONCLUSIONAPS improves the metabolism of FFAs by activating AMPK and promoting translocation of FAT/CD36 in C2C12 myoblasts.
Astragaluspolysaccharides; Free fatty acids; AMP-activated protein kinases
R363
A
10.3969/j.issn.1000- 4718.2013.04.011
1000- 4718(2013)04- 0637- 04
2012- 10- 08
2013- 03- 01
国家自然科学基金资助项目(No.30370673; No.30770734); 十堰市科技局科技项目(No.ZD2012037)
△通讯作者 Tel: 0719-8272543; E-mail: doctorsongjie@163.com
