巨噬细胞移动抑制因子在复发性宫颈癌中的表达及其对预后的影响*
2013-10-24翁梅英洪顺家郑澄宇
翁梅英, 洪顺家, 郑澄宇
(中山大学孙逸仙纪念医院妇产科,广东 广州 510120)
巨噬细胞移动抑制因子在复发性宫颈癌中的表达及其对预后的影响*
翁梅英, 洪顺家△, 郑澄宇
(中山大学孙逸仙纪念医院妇产科,广东 广州 510120)
目的研究巨噬细胞移动抑制因子(macrophage migration-inhibitory factor, MIF)在复发性宫颈癌中的表达及其对预后的影响。方法2007年1月至2009年12月期间收集我院确诊宫颈癌手术后复发患者87例,采用免疫组化方法检测MIF的表达情况,并对患者进行至少36个月的随访。结果复发性宫颈癌患者MIF阳性率为75.7%(55/87)。MIF表达与宫颈癌分化程度和临床分期相关,差异有统计学意义(P<0.01);但是不同宫颈癌病理分型MIF表达差异无统计学意义(P>0.05)。复发性宫颈癌MIF阳性者近期治疗有效率为47.3%(26/55),MIF阴性者近期治疗有效率为63.6%(21/32),二者相比差异有统计学意义(P<0.05)。Kaplan-Meier 生存分析结果表明MIF表达阳性组平均生存时间为28.8个月,阴性组平均生存时间为38.4个月,log-rank检验P<0.05。结论MIF阳性可能是影响宫颈癌复发和预后的危险因素之一。
宫颈肿瘤; 复发; 预后; 巨噬细胞移动抑制因子
宫颈癌属于妇科最常见的恶性肿瘤,为仅次于乳腺癌的第二大女性恶性肿瘤,一直以来严重危害着女性健康。一般认为组织学分级、盆腔淋巴结转移、浸润深度和淋巴血管间隙侵犯均是目前影响宫颈癌预后的重要因素[1]。巨噬细胞移动抑制因子(macrophage migration-inhibitory factor,MIF) 属于T淋巴细胞分泌的细胞因子,研究发现其能够促进恶性肿瘤发生,参与肿瘤发生发展的多个环节[2]。本研究旨在探讨MIF在复发性宫颈癌中的表达状况及其对预后的影响。
材 料 和 方 法
1研究对象
收集我院2007年1月至2009年12月期间确诊宫颈癌收入院手术治疗的患者,病例入选标准:按2007年国际妇产科联盟(Federation of Gynecology and Obstetrics, FIGO)推荐的临床-诊断分期标准,ⅠB1期42例,ⅡA期(<4 cm)45例,均行改良根治性子宫切除术和盆腔淋巴结切除术。手术后随访宫颈癌复发:发现宫颈残端肿块,可伴发腰骶部疼痛,腿部放射性疼痛,下肢浮肿等局部压迫症状;三合诊扪及盆腔结节型肿块,位置固定;计算机断层扫描 (computed tomography, CT)、磁共振成像 (magnetic resonance imaging, MRI)或者彩超提示盆腹腔占位性肿块或肿大的淋巴结。
2治疗干预方法
2组患者确诊术后宫颈癌复发后给予同期放化疗,均予体外照射及腔内近距离放射治疗。同时给予顺铂化疗5周期:顺铂每平方米体表面积30 mg,每周1次。
3MIF检测方法
MIF在宫颈癌组织中的表达情况采用免疫组化方法进行检测,收集所有入选患者第1次手术时保留的蜡块组织,5 μm切片,采用S-P免疫组织化学二步法染色,鼠抗人MIF单克隆抗体免疫组织化学染色试剂盒及小鼠抗人耐药基因单克隆Ⅰ抗抗体均由Introvigen生物技术有限公司生产。空白对照为PBS代替Ⅰ抗,阴性对照采用正常鼠血清代替Ⅰ抗,阳性对照为已知阳性的宫颈癌切片。严格按照试剂盒操作手册进行染色,光镜下进行基因蛋白表达强度分级。MIF表达强度评分标准采用阳性细胞比例评分和阳性强度评分两项加权法:每高倍镜视野阳性细胞<25%为1分,25%~50%为2分,51%~75%为3分,>75%为4分;阳性细胞染色强度:淡黄色为1分,黄色为2分,棕黄色为3分;将每一标本两项得分相乘得出总分,0~3分记为阴性(-),4~8分记为阳性(+),9~12分记为强阳性(++)[3]。
4治疗效果评价
患者接受治疗1月后随访进行疗效评估,近期疗效采用WHO肿瘤治疗标准判定疗效予治疗后1个月时进行评价[4]:完全缓解(complete response,CR),肿瘤全部消失,超过1个月;部分缓解(partial response,PR),肿瘤缩小50%以上,时间≥4周;稳定(no change,NC),肿瘤体积增大<25%或缩小<50%;进展(progressive disease,PD),肿瘤体积增大>25%或出现新病灶。治疗有效为CR+PR。对所有患者进行的生存时间随访。患者治疗出院后均进行为期至少36个月电话随访,记录患者的生存时间,并进行整理分析。
5统计学处理
应用SPSS 17.0统计软件分析,计量数据采用均数±标准差(mean±SD)表示。组间均数比较用t检验,计数资料采用2检验,MIF表达与预后之间的关系采用Kaplan-Meier生存分析,以P<0.05为差异有统计学意义。
结 果
1患者一般情况
共入选符合标准的复发性宫颈癌患者87例,初次发病时年龄31~70岁,平均(43.2±10.2)岁。ⅠB1期42例,ⅡA期(<4 cm)45例。术后宫颈癌复发时间6~30月,平均(12.5±6.2)月。
2MIF表达与复发性宫颈癌临床病理特征之间的关系
第1次手术标本病理检查结果鳞状细胞癌77例,腺癌10例,低分化22例,高、中分化65例。免疫组织化学检查结果表明复发性宫颈癌患者MIF阳性率75.7%(55/87)。宫颈腺癌和鳞癌组织MIF表达分别见图1、2。MIF表达与宫颈癌分化程度和临床分期相关,差异有统计学意义(P<0.01);但是不同宫颈癌病理分型MIF表达差异无统计学意义(P>0.05),见表1。
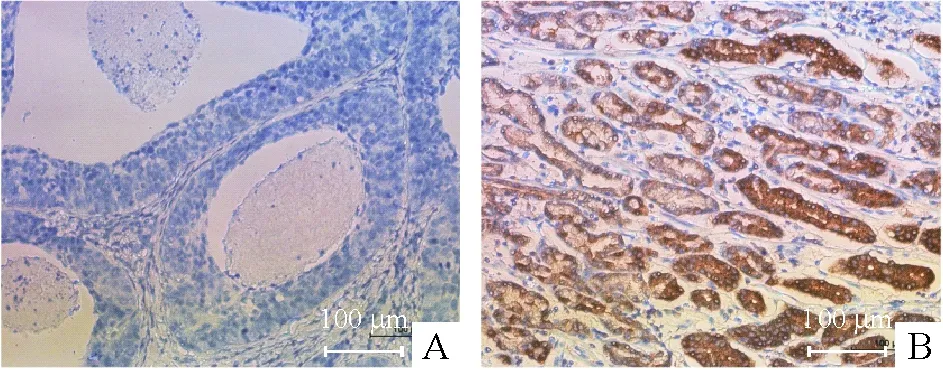
Figure 1. Analysis of MIF protein expression by immunohistochemistry in cervical adenocarcinoma(×200). A: negative MIF staining; B: positive MIF staining.
图1免疫组化法分析MIF蛋白在宫颈腺癌中的表达
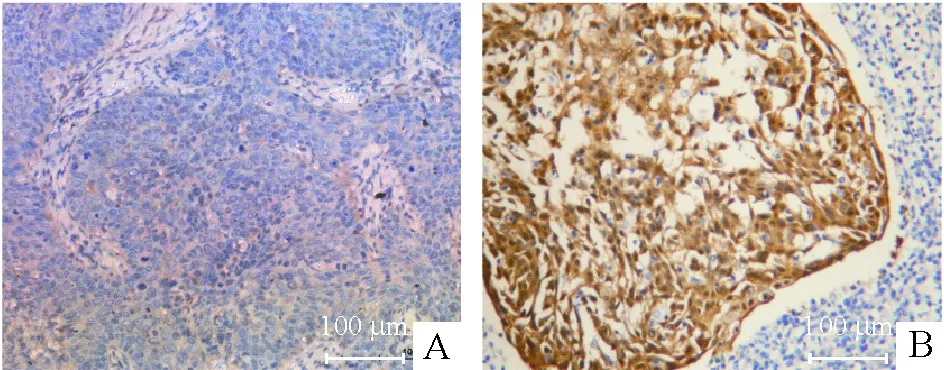
Figure 2. Analysis of MIF protein expression by immunohistochemistry in cervical squmaous-cell carcinoma(×200). A: negative MIF staining; B: positive MIF staining.
图2免疫组化法分析MIF蛋白在宫颈鳞癌中的表达
3MIF表达与复发性宫颈治疗的近期效果比较
复发性宫颈癌MIF阳性者近期治疗有效率47.3%(26/55),MIF阴性者近期治疗有效率63.6%(21/32),二者相比较差异有统计学意义(P<0.05),见表2。
表1MIF表达与复发性宫颈癌临床病理特征之间的关系
Table 1. Correlation between the expression of MIF and clinicopathological features.

CharacteristicsnMIF(+)PPathologicalpattern Squmaouscarcinoma7749(63.6%)>0.05 Adenocarcinoma106(60.0%)Differentiation Poor225(22.7%)<0.01 Well/moderate6550(76.9%)Clinicalstage ⅠB14217(40.5%)<0.01 ⅡA4538(84.4%)
表2MIF表达与复发性宫颈癌治疗的近期效果比较
Table 2. Comparison of MIF expression and short-term therapeutic effects of recurrent cervical cancer.
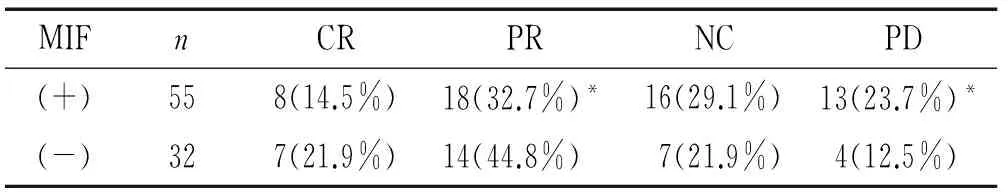
MIFnCRPRNCPD(+)558(14.5%)18(32.7%)*16(29.1%)13(23.7%)*(-)327(21.9%)14(44.8%)7(21.9%)4(12.5%)
*P<0.05vsMIF(-).
4MIF表达与复发性宫颈癌预后之间的关系
Kaplan-Meier 生存分析结果表明MIF表达阳性组平均生存时间为28.8个月,阴性组平均生存时间为38.4个月,log-rank检验P<0.05,见图3。
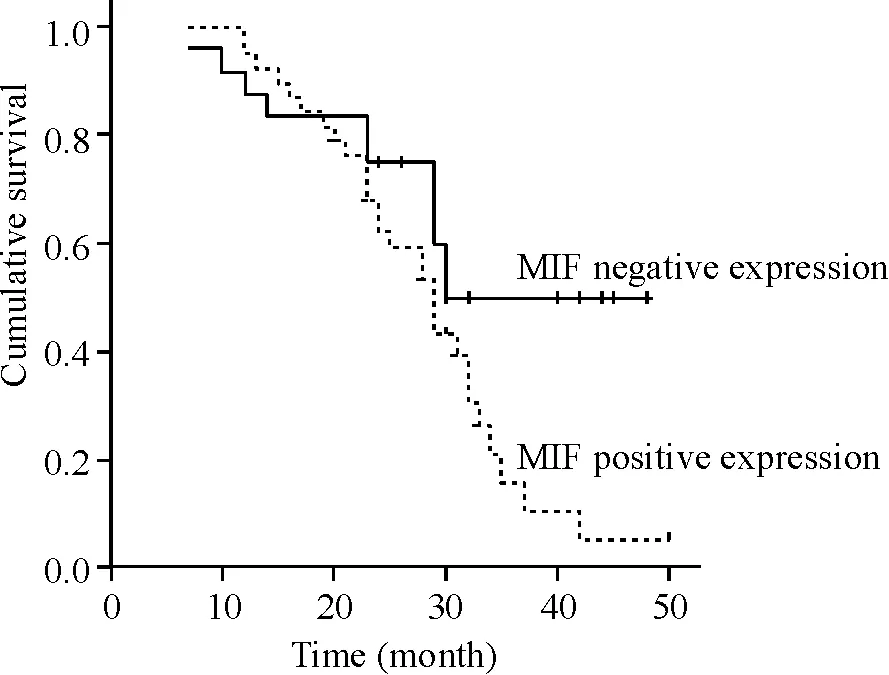
Figure 3. Kaplan-Meier analysis of the survival of recurrent cervical cancer patients with or without MIF expression.
图3Kaplan-Meier法分析MIF表达与复发性宫颈癌患者生存期的关系
讨 论
随着我国宫颈癌预防知识的大力宣传教育及早期筛查的开展普及,该病的早期诊断率升高,病死率已有明显下降,同时宫颈癌诊断年龄也出现年轻化趋势。妇女宫颈癌的预后影响因素众多,目前确认的包括临床分期、脉管累及/间质浸润深度和组织学分级。近年来宫颈癌发生发展的分子生物学机制成为国内外研究热点集中所在,研究发现来源于T淋巴细胞的细胞因子MIF可能抑制肿瘤免疫,促进血管生成,与多种肿瘤的侵袭、转移等相关[5]。在MIF研究的初期其被描述为一个具有广泛作用的前炎症因子,能够通过多种途径激活炎症反应,但是最新研究表明其在炎症与肿瘤之间起到桥梁的作用,在肿瘤发病及转移过程中发挥重要的作用[6]。研究发现MIF在肝癌、食管癌、肺癌、头颈部鳞癌等多种肿瘤组织中呈现高表达状态,与多种肿瘤的淋巴结转移有密切关系[7]。有研究证实CD74为MIF的作用受体,其细胞外结合域结合MIF位点后,能够激活前列腺素E2的合成,促使细胞复制[8]。
我们的研究表明MIF宫颈癌组织中高表达,主要位于细胞浆内,提示MIF与宫颈癌的发生、发展可能有关。同时复发性宫颈癌病例中MIF阳性率高于同期文献报道宫颈癌者[9],提示其可能为宫颈癌复发的危险因素。同时本研究还发现MIF的阳性表达与复发性宫颈癌组织分化程度及其临床分期相关,低分化、临床分期晚的病例其MIF阳性率越高,表明MIF能够抑制机体针对肿瘤细胞的免疫控制,促进肿瘤细胞逃逸,而使恶性程度增高。我们的研究还发现复发性宫颈癌MIF阴性患者再次接受抗肿瘤治疗,其短期效果优于MIF阳性病例;而且通过长达3年的随访结果也表明,MIF阴性的复发性宫颈癌患者预期寿命更长。
但是MIF影响宫颈癌预后的分子生物学具体机制尚未完全明确,有研究认为MIF可能在肿瘤早期阶段通过诱导基质金属蛋白酶2表达来促进肿瘤细胞的侵袭和转移[10-11]。基质金属蛋白酶被认为能够通过降解细胞外基质,促进血管生成调节来促进肿瘤发生进展。
综上所述,MIF阳性可能是影响宫颈癌复发和预后的危险因素之一,其具体机制及可能的药物干预靶点还有待进一步研究。
[1] Westermann A, Mella O, Van Der Zee J, et al. Long-term survival data of triple modality treatment of stage IIB-III-IVA cervical cancer with the combination of radiotherapy, chemotherapy and hyperthermia:an update[J]. Int J Hyperthermia, 2012, 28(6):549-553.
[2] Kang S, Nam BH, Park JY, et al. Risk assessment tool for distant recurrence after platinum-based concurrent chemoradiation in patients with locally advanced cervical cancer: a Korean gynecologic oncology group study[J]. J Clin Oncol, 2012, 30(19):2369-2374.
[3] 王 敏,彭宣荣,朱彦丽, 等. HuR、VEGF和COX-2表达及临床病理因素与早期宫颈癌患者预后关系的分析[J]. 中国肿瘤临床, 2010, 37(17):984-987, 990.
[4] 杨炜敏,游泽山,袁 力, 等.宫颈鳞癌组织中KAI1表达变化与宫颈癌复发及预后的相关性研究[J]. 中国病理生理杂志, 2010, 26(3):539-542.
[5] Simpson KD, Templeton DJ, Cross JV. Macrophage migration inhibitory factor promotes tumor growth and metastasis by inducing myeloid-derived suppressor cells in the tumor microenvironment[J]. J Immunol, 2012, 189(12):5533-5540.
[6] Yaddanapudi K, Putty K, Rendon BE, et al. Control of tumor-associated macrophage alternative activation by macrophage migration inhibitory factor[J]. J Immunol, 2013, 190(6):2984-2993.
[7] 熊 樱, 梁立治,郑 敏, 等. 血清CYFRA21-1与宫颈癌患者临床病理特征及预后的关系[J].实用妇产科杂志, 2011, 27(9):674-677.
[8] Tawadros T, Alonso F, Jichlinski P, et al. Release of macrophage migration inhibitory factor by neuroendocrine-differentiated LNCaP cells sustains the proliferation and survival of prostate cancer cells[J]. Endocr Relat Cancer, 2013, 20(1):137-149.
[9] 谭 琛, 罗招阳. MIF和MMP-2在宫颈癌中的表达及临床意义[J]. 中国实用医药, 2010, 5(27):35-36.
[10] 潘 琦, 陈福春, 武百强, 等. 量子点免疫荧光技术检测EMMPRIN、 MMP-2和P53蛋白在人肺癌组织中的表达意义[J]. 中国病理生理杂志, 2011, 27(3):488-493.
[11] 连俊芳, 吴素慧, 尚海霞, 等.巨噬细胞移动抑制因子及其受体CD74在宫颈癌组织中的表达及意义[J]. 中国药物与临床, 2011, 11(7):755-757.
Expressionofmacrophagemigration-inhibitoryfactorinhumanrecurrentcervicalcancertissuesanditsprognosticsignificance
WENG Mei-ying, HONG Shun-jia, ZHENG Cheng-yu
(DepartmentofObstetricsandGynecology,SunYat-senMemorialHospitalofSunYat-senUniversity,Guangzhou510120,China.E-mail:shunjiahong@126.com)
AIM: To investigate the expression of macrophage migration-inhibitory factor (MIF) in human recurrent cervical cancer tissues and its influence on prognosis.METHODSEight-seven cases of recurrent cervical cancer were collected from January 2007 to December 2009 and followed up for at least 36 months. The MIF expression in cervical cancer tissues was tested by immunochemistry.RESULTSThe positive rate of MIF expression in recurrent cervical cancer was 75.7% (55/87). Compared with the patients with negative MIF expression, the patients with positive MIF expression showed worse response to antitumor therapy [47.3% (26/55) vs 63.6% (21/32),P<0.05] and shorter survival time (28.8 months vs 38.4 months,P<0.05).CONCLUSIONPositive MIF expression could be a risk factor in recurrence and prognosis of cervical cancer.
Uterine cervical neoplasms; Recurrence; Prognosis; Macrophage migration-inhibitory factors
R737.33
A
1000- 4718(2013)09- 1641- 04
2013- 05- 02
2013- 07- 26
广东省科技计划(No.2010B031600201)
△通讯作者 Tel: 020-81332583; E-mail: shunjiahong@126.com
10.3969/j.issn.1000- 4718.2013.09.018
