长期胰岛素治疗通过促进BNP表达延缓缺血性心力衰竭的发展及其机制*
2013-10-24于立明闫文俊邢文娟乔红玉朱妙章张海锋
于立明, 闫文俊, 邢文娟, 乔红玉, 张 薇, 朱妙章, 高 峰, 于 军, 张海锋△
(第四军医大学 1教学实验中心, 2西京医院心内科, 3生理学教研室, 4唐都医院心内科, 陕西 西安 710032)
长期胰岛素治疗通过促进BNP表达延缓缺血性心力衰竭的发展及其机制*
于立明1, 闫文俊2, 邢文娟3, 乔红玉1, 张 薇4, 朱妙章3, 高 峰3, 于 军1, 张海锋1△
(第四军医大学1教学实验中心,2西京医院心内科,3生理学教研室,4唐都医院心内科, 陕西 西安 710032)
目的探讨心肌梗死后长期胰岛素治疗对心脏结构与功能的影响及机制。方法对成年雄性SD大鼠行冠状动脉左前降支结扎手术,并随机分为4组(每组8~10只):(1)生理盐水组:心梗后1 mL·kg-1·d-1,ih,4周;(2)胰岛素组:2 U·kg-1·d-1,ih,4周;(3)胰岛素+wortmannin(Wm, PI3K抑制剂)组:Wm 15 μg·kg-1·d-1,胰岛素给药前15 min,ip;(4)假手术组不结扎冠脉,作为对照。检测各组大鼠心脏结构及功能,测定心肌细胞PI3K及p38 MAPK表达量,测定血清脑钠尿肽(BNP)及心肌BNP mRNA表达量。结果心梗后胰岛素长期强化治疗4周可减少心脏纵轴长度/心脏重量,但对心脏重量/体重和心肌细胞横截面积无显著影响,并增加心脏射血分数、左心室发展压和左室压微分(均P<0.05);此外,胰岛素治疗4周可增加PI3K表达和Akt磷酸化,降低p38 MAPK磷酸化水平,同时提高血清BNP水平而不改变心肌细胞BNP mRNA表达量,但该作用不能被Wm阻断(均P<0.05)。结论心梗后长期胰岛素强化治疗可通过非PI3K-Akt依赖通路上调BNP水平,减轻心脏病理性重构并改善心功能,延缓缺血性心力衰竭的发展。
心肌缺血; 心力衰竭; 胰岛素; 钠尿肽,脑; p38 丝裂原活化蛋白激酶
缺血性心脏病(ischemic heart disease, IHD)是威胁人类健康的“第一杀手”,如何缓解缺血性心衰的发生和发展是医学界重要课题之一。本实验室前期工作首次发现胰岛素除代谢调节外,还可通过激活磷脂酰肌醇3-激酶(phospatidylinositol 3-kinase,PI3K)-蛋白激酶B(Akt)-内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)信号抑制缺血/再灌注(ischemia/reperfusion, I/R)心肌细胞凋亡,促进心肌存活及功能恢复[1-2]。我们的进一步研究证明,心肌缺血早期胰岛素治疗可通过增加一氧化氮(nitric oxide, NO)的产生,减少心肌细胞凋亡和心肌梗死面积,显著改善缺血引起的心脏结构和功能长期变化[3],但长期胰岛素治疗对缺血性心力衰竭的作用尚不清楚。脑钠尿肽(brain natriuretic peptide, BNP)是心血管系统另一种重要多肽,具有利尿、利钠、扩血管和抗心肌肥厚等作用,BNP水平在心衰状态下升高,成为急性和慢性心衰的显著特征[4]。多年来,在心衰的研究领域中对BNP的研究从未停止,一方面是由于其水平在心衰进展过程中具有重要诊断意义,另一方面则是由于BNP生物学作用的复杂性,且BNP对缺血后心脏的影响及机制仍未完全阐明。因此,本实验拟研究长期胰岛素强化治疗对缺血性心力衰竭的作用如何、是否与BNP有关,如相关则进一步探讨其信号机制。
材 料 和 方 法
1主要试剂和仪器
3%戊巴比妥钠和大鼠胰岛素(Sigma),wortmannin(Wm,PI3K抑制剂;Santa Cruz),罗氏活力型血糖仪及血糖试纸(Roche),大鼠胰岛素和BNP ELISA试剂盒(尚柏生物公司),ACUSON Sequoia 512型超声心动仪(Siemens),BL420E机能实验系统(成都泰盟公司),RT-PCR试剂盒(宝生物工程公司),定量PCR仪(伯乐公司)。
2动物模型建立
成年雄性SD大鼠(购自第四军医大学动物中心)40只,体重250~300 g,参照Xing等[3]的方法,行冠状动脉左前降支结扎手术,并随机分为4组(每组8~10只):(1)生理盐水组:心梗后1 mL·kg-1·d-1,ih,4周;(2)胰岛素组:2 U·kg-1·d-1,ih,4周;(3)胰岛素+Wm组:Wm 15 μg·kg-1·d-1,胰岛素给药前15 min,ip;(4)假手术组不结扎冠脉,作为对照。所有大鼠饲养4周。
3血液指标的测定
第4周剪尾法采血,立即使用罗氏血糖测定仪检测各组大鼠血糖,其余标本静置离心取血清,采用ELISA方法测血清胰岛素和BNP水平,具体方法见试剂盒说明书。
4超声心动图检测
采血完毕称量大鼠体重,3%戊巴比妥钠腹腔注射麻醉并固定,用超声心动仪(频率14MHz,深度3 cm)测量5个心动周期,取平均值作为最后检测数据。根据Xing等[3]的方法,测量并计算:收缩期室间隔厚度[systolic interventricular septum thickness, IVS(S)]、左室收缩末期内径(left ventricular end-systolic dimension, LVESD)、左室舒张末期内径(left ventricular end-diastolic dimension, LVEDD)及左室射血分数(left ventricular ejection fraction, LVEF)等。
5左室血流动力学检测
超声心动图检测后第2天,将各组大鼠麻醉后仰卧于手术台上。分离右侧颈总动脉,结扎远心端,经右侧颈动脉插入心导管至左心室,与生物信号采集处理系统相连,连续记录各组大鼠心率(heart rate, HR)、左室发展压(left ventricular developed pressure, LVDevP)和左室内压微分(the instantaneous first derivation of left ventricle pressure, ±LV dp/dtmax)。
6HE及Masson染色
打开胸腔摘取心脏,称全心重量(heart weight, HW)和全心长度(heart length, HL),并计算HL/HW及全心肥厚指数(HW/BW),然后在结扎处下2 mm切取0.5 cm厚的心肌组织横切面,进行常规脱水石蜡包埋切片后,做HE及Masson三色染色。
7Westernblotting检测心肌组织PI3K、Akt、糖原合成酶激酶3β(glycogensynthasekinase3β,GSK3β)及p38丝裂原活化蛋白激酶(p38mitogen-activatedproteinkinase,p38MAPK)等表达及磷酸化水平
剪取缺血区心肌标本0.1 g,常规方法提蛋白,并用BCA法蛋白浓度定量。Western blotting检测PI3K、Akt、p-Akt、p38 MAPK、p-p38 MAPK、GSK3β、p-GSK3β表达情况,以β-actin作为内参照,使用ECL-Plus试剂盒发光,并通过生化检测系统成像。用Image-Pro Plus软件分析蛋白条带密度。
8实时荧光定量PCR检测心肌β-肌球蛋白重链(β-myosinheavychain,β-MHC)、心房钠尿肽(atrialnatriureticpeptide,ANP)和BNPmRNA含量
应用Trizol抽提组织总RNA,采用RT-PCR试剂盒检测。ANP上游引物5’-CTGGGACCCCTCCGATAGAT-3’,下游引物5’-TCGGTACCGGAAGCTGTTG-3’;BNP上游引物5’-GGGCTGTGACGGGCTGAGGTT-3’,下游引物5’-AGTTTGTGCTGGAAGATAAGA-3’;β-MHC上游引物5’-GCAGCTTATCAGGAAGGAATAC-3’,下游引物5’-CTTGCGTACTCTGTCACTC-3’;GAPDH上游引物5’-AACTCCCTCAAGATTGTCAGCAA-3’,下游引物5’-CAGTCTTCTGAGTGGCAGTGATG-3’。引物由大连宝生物公司设计并合成,扩增条件:95℃10 min进入循环;95℃ 15 s,60℃/55.1℃ 1 min,循环40次。以目的基因的表达/内参照基因的表达对ANP、BNP、β-MHC mRNA表达相对定量。
9统计学处理
数据以均数±标准差(mean±SD)表示,采用Prism 5.0软件分析,多组间数据比较采用方差分析(ANOVA),若总体差异显著,再以LSD-t检验分析相应两组间的显著性差别。以P<0.05为差异有统计学意义。
结 果
1心梗后长期胰岛素强化治疗显著改善心脏功能和结构
与生理盐水组相比,超声心动图结果显示胰岛素治疗有效增加左室射血分数,并使心腔缩小,室间隔增厚,显著改善心肌缺血后心脏结构,而使用wortmannin则降低射血分数,使心腔扩大,室间隔变薄,抑制了胰岛素的保护作用(均P<0.05),见图1。
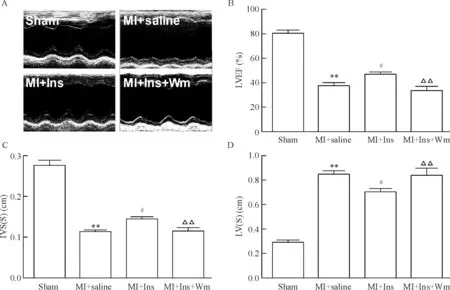
Figure 1. Insulin treatment for 4 weeks significantly increased cardiac function and retarded cardiac remodeling. A: echocardiography; B: left ventricular ejection fraction (LVEF); C: systolic interventricular septum thickness [IVS(S)]; D: systolic left ventricle cavity dimension [LV(S)]. Ins: insulin; Wm: wortmannin. Mean±SD.n=8.**P<0.01vssham;#P<0.05vsMI+saline;△△P<0.01vsMI+Ins.
图1胰岛素治疗4周显著增加心肌缺血后心脏射血分数,改善心脏结构
血流动力学结果显示,胰岛素治疗4周显著升高LVDevP和±LV dp/dtmax(均P<0.05),明显改善心功能。使用wortmannin显著降低LVDevP和±LV dp/dtmax(均P<0.05),抑制了胰岛素的保护作用,见表1。
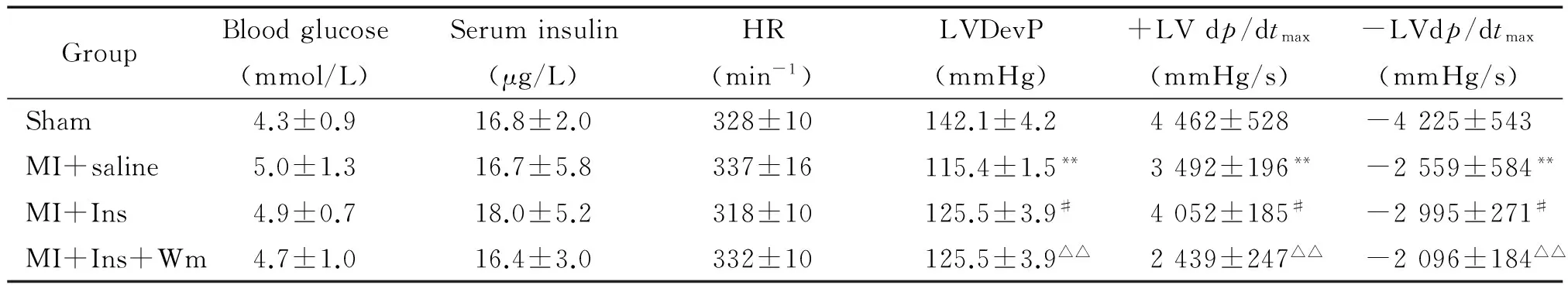
表1 胰岛素治疗4周显著改善心肌缺血后心脏血流动力学功能
Ins: insulin; Wm: wortmannin.**P<0.01vssham;#P<0.05vsMI+saline;△△P<0.01vsMI+Ins.
2心梗后长期胰岛素强化治疗减轻心肌缺血后心脏病理性重构
HE染色心肌切片显示,与生理盐水组相比,胰岛素治疗组心肌细胞排列更加规整,见图2A;Masson染色显示,与生理盐水组相比,胰岛素治疗组梗死纤维化区域及左室横截面积明显缩小,室壁增厚,wortmannin显著抑制了胰岛素的保护作用,见图2B。另外,长期胰岛素治疗减少HL/HW,但对HW/BW和心肌细胞横截面积无显著影响,见图2C、D、E。
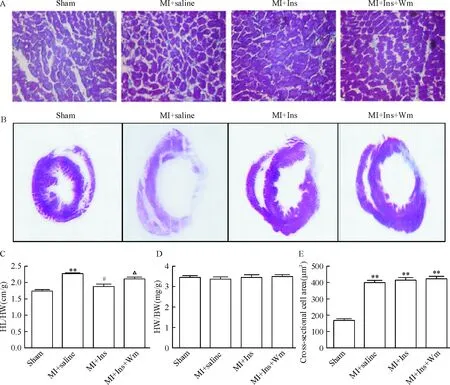
Figure 2. Insulin treatment for 4 weeks attenuated cardiac pathological remodeling. A: HE staining(×400); B: Masson staining; C: heart length/heart weight (HL/HW); D: heart weight/body weight (HL/BW); E: cross-sectional cell area. Ins: insulin; Wm: wortmannin. Mean±SD.n=8.**P<0.01vssham;#P<0.05vsMI+saline;△P<0.05vsMI+Ins.
图2胰岛素治疗4周减轻心肌缺血后心脏病理性重构
3胰岛素激活PI3K-Akt通路,并抑制p38MAPK通路
Western blotting检测发现胰岛素可增加PI3K表达,促进Akt及GSK3β磷酸化,激活心肌梗死周边区PI3K-Akt信号,同时降低p38 MAPK磷酸化水平,抑制p38 MAPK信号通路,见图3。
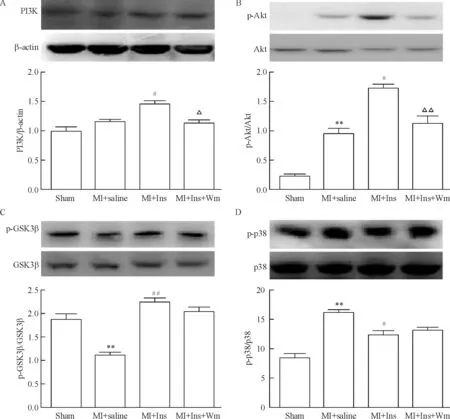
Figure 3. Insulin treatment activated PI3K-Akt signaling pathway and inhibited p38 MAPK signaling. A:PI3K expression;B:Akt phosphorylation;C:GSK3β phosphorylation;D:p38 MAPK phosphorylation. Ins: insulin; Wm: wortmannin. Mean±SD.n=10.**P<0.01vssham;#P<0.05,##P<0.01vsMI+saline;△P<0.05,△△P<0.01vsMI+Ins.
图3胰岛素激活PI3K-Akt通路和抑制p38MAPK通路
4长期胰岛素治疗升高血清BNP浓度,但不改变心肌BNPmRNA表达
通过检测病理性心脏重构相关基因mRNA水平,发现胰岛素长期治疗显著减少β-MHC和ANP mRNA水平,并且可增加血清中BNP浓度,但对心肌BNP mRNA水平则无显著影响。与胰岛素治疗组相比,使用PI3K抑制剂wortmannin可显著提高心脏重构相关基因水平,但是对血清BNP水平及心肌BNP mRNA水平无显著影响 ,见图4。
讨 论
近年来,基础及临床研究证实胰岛素不仅发挥调节能量代谢的作用,还可通过多种促生存和抗凋亡信号途径参与心肌保护[5],是葡萄糖-胰岛素-钾极化液(glucose-insulin-potassium,GIK)保护缺血心肌的关键成分[1]。已有实验证明胰岛素可减轻缺血/再灌注损伤,促进心肌存活及心功能恢复,然而心肌缺血后长期胰岛素强化治疗对缺血性心力衰竭的作用及机制尚未完全阐明[6]。本研究通过结扎大鼠冠状动脉左前降支构建缺血性心力衰竭动物模型,发现心梗后长期胰岛素强化治疗可通过激活生存信号PI3K-Akt,抑制p38 MAPK信号,减轻心脏病理性重构、延缓缺血性心力衰竭并改善心功能。
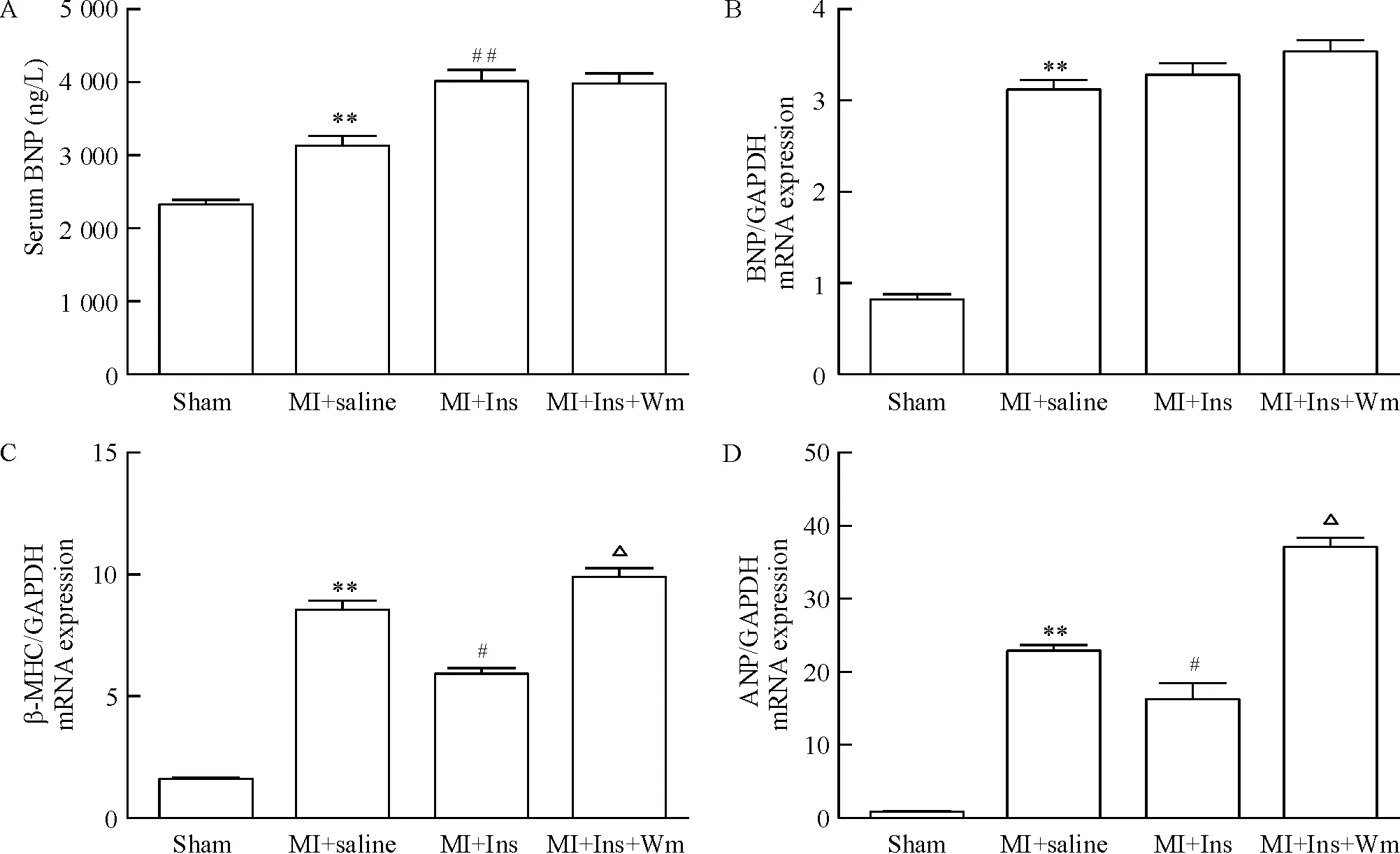
Figure 4. Effects of long-term insulin treatment on serum BNP level (A) and myocardial mRNA expression of BNP (B),β-MHC (C) and ANP (D). Ins: insulin; Wm: wortmannin. Mean±SD.n=10.**P<0.01vssham;#P<0.05,##P<0.01vsMI+saline;△P<0.05vsMI+Ins.
图4长期胰岛素治疗对血清中BNP浓度的影响
BNP是1988年首次从猪脑内分离得到的一种具有强效利钠、利尿、扩血管和降压作用的多肽,由于其生物学作用的复杂性及对心衰诊断与预后评价的特殊价值而备受关注[7]。BNP是由心肌细胞合成的具有生物活性的天然激素,当左心室功能不全时,由于心肌扩张而快速合成释放入血,有助于调节心脏功能。深入研究发现,BNP可发挥减轻缺血/再灌注损伤[8],抑制病理性心肌肥厚和抗凋亡抗纤维化等作用[4],延缓缺血性心衰进程。我们发现长期胰岛素强化治疗可显著提高血清BNP水平,而不改变心肌BNP mRNA水平,BNP可能参与胰岛素的心肌保护作用。
作为心血管系统两大重要激素,胰岛素与钠尿肽系统相互作用机制尚不明确。有研究表明,BNP减轻心脏缺血/再灌注损伤可能与PI3K-Akt信号通路有关[8-9],而胰岛素抵抗患者与非胰岛素抵抗患者相比,血清N端BNP前体的水平显著下降[10]。这些结论都提示,胰岛素信号通路与钠尿肽信号通路可能有密切关系。本实验证实,缺血性心脏病情况下胰岛素可提高血清BNP水平而不改变心肌细胞BNP mRNA含量,故胰岛素可能在转录后水平调节血清BNP含量,其具体机制有待于进一步研究。前期研究已证实胰岛素有2条信号通路:PI3K-Akt-eNOS及Ras-MAPK信号通路,前者发挥扩管、抗凋亡和抑制氧化应激等作用保护心肌,后者发挥促细胞增殖作用,促心肌肥厚,生理情况下二者相互平衡,共同调节,但在以胰岛素抵抗为主特征的糖尿病患者则严重抑制前者,后者稳定不变甚至强化,加重心血管疾病的病程及预后[5]。Xing等[3]发现,心梗后给予短期胰岛素治疗可激活梗死周边区PI3K-Akt-eNOS信号保护缺血心肌,而Gao等[11]研究发现胰岛素通过激活PI3K-Akt信号而非Ras-MAPK信号减轻心肌缺血再灌注损伤,另外,有研究显示抑制p38 MAPK信号通路可抑制内皮黏附分子表达减轻缺血再灌注损伤[12]。本研究证实,缺血区周围心肌p38 MAPK激活,发挥促进心脏肥厚等作用,而使用长期外源胰岛素治疗可促进心肌PI3K-Akt信号而相对抑制Ras-MAPK信号通路,抑制缺血心肌梗死,减轻缺血心脏病理重构,改善心功能,延缓心力衰竭的发展。同时注意到胰岛素治疗上调血清BNP,而这种作用不能被PI3K抑制剂wortmannin阻断,同时wortmannin也不能改变缺血心肌BNP mRNA水平,即胰岛素可通过非PI3K-Akt依赖途径对BNP产生正性作用,Ras-MAPK信号通路很可能参与胰岛素对BNP的调控,其具体机制有待进一步研究。
本研究首次证实心梗后胰岛素长期强化治疗可通过非PI3K-Akt依赖途径促进BNP表达,延缓缺血性心衰的发展,提示胰岛素对长期缺血性心脏病及缺血性心衰的潜在治疗价值,对糖尿病合并心梗的病人尤有意义,其详细机制有待在糖尿病等模型进一步研究。
[1] Gao F, Gao E, Yue TL, et al. Nitric oxide mediates the antiapoptotic effect of insulin in myocardial ischemia-reperfusion: the roles of PI3-kinase, Akt, and endothelial nitric oxide synthase phosphorylation[J]. Circulation, 2002,105(12):1497-1502.
[2] Gao F, Tao L, Yan W, et al. Early anti-apoptosis treatment reduces myocardial infarct size after a prolonged reperfusion[J]. Apoptosis, 2004,9(5):553-559.
[3] Xing W, Yan W, Fu F, et al. Insulin inhibits myocardial ischemia-induced apoptosis and alleviates chronic adverse changes in post-ischemic cardiac structure and function[J]. Apoptosis, 2009,14(9):1050-1060.
[4] Kapoun AM, Liang F, O’Young G, et al. B-type natriuretic peptide exerts broad functional opposition to transforming growth factor-beta in primary human cardiac fibroblasts: fibrosis, myofibroblast conversion, proliferation, and inflammation[J]. Circ Res, 2004,94(4):453-461.
[5] Yu Q, Gao F, Ma XL. Insulin says no to cardiovascular disease[J]. Cardiovasc Res, 2011,89(3):516-524.
[6] 裴汉军, 宋光远, 吴永健, 等. 糖尿病在糖尿病大鼠心肌梗死后心力衰竭形成中的效应[J]. 中国病理生理杂志, 2009,25(6):1051-1058.
[7] Di Angelantonio E, Chowdhury R, Sarwar N, et al. B-type natriuretic peptides and cardiovascular risk: systematic review and meta-analysis of 40 prospective studies[J]. Circulation, 2009,120(22):2177-2187.
[8] Sun Y, Deng T, Lu N, et al. B-type natriuretic peptide protects cardiomyocytes at reperfusion via mitochondrial calcium uniporter[J]. Biomed Pharmacother, 2010,64(3):170-176.
[9] 王华祖, 龚兴国. 蛋白激酶B的研究进展[J]. 中国病理生理杂志, 2003,19(11):84-89.
[10] Khan AM, Cheng S, Magnusson M, et al. Cardiac natriuretic peptides, obesity, and insulin resistance: evidence from two community-based studies[J]. J Clin Endocrinol Metab, 2011,96(10):3242-3249.
[11] Gao F, Yan WL, Zhang HF, et al.Anti-apoptotic effect of insulin in myocardial ischemia-reperfusion and its principal signaling pathway[J]. Zhonghua Nei Ke Za Zhi, 2003,42(3):153-156.
[12] Gao F, Yue TL, Shi DW, et al. p38 MAPK inhibition reduces myocardial reperfusion injury via inhibition of endothelial adhesion molecule expression and blockade of PMN accumulation[J]. Cardiovasc Res, 2002,53(2):414-422.
Long-terminsulintreatmentimprovespostischemiccardiacstructureandfunctionviaincreasingserumBNPlevels
YU Li-ming1, YAN Wen-jun2, XING Wen-juan3, QIAO Hong-yu1, ZHANG Wei4, ZHU Miao-zhang3, GAO Feng3, YU Jun1, ZHANG Hai-feng1
(1CenterofTeachingExperiment,2DepartmentofCardiology,XijingHospital,3DepartmentofPhysiology,4DepartmentofCardiology,TangduHospital,ForthMilitaryMedicalUniversity,Xi’an710032,China.E-mail:hfzhang@fmmu.edu.cn)
AIM: To investigate the influence of long-term insulin treatment on postischemic cardiac structural and functional changes, and to further explore the underlying mechanisms.METHODSAdult male SD rats were randomly divided into 4 groups (8~10 rats per group): sham group, myocardial infarction (MI) + saline (1 mL·kg-1·d-1, hypodermic injection for 4 weeks) group, MI + insulin (2 U·kg-1·d-1, hypodermic injection for 4 weeks) group and MI + insulin (2 U·kg-1·d-1, hypodermic injection for 4 weeks) + wortmannin [a phosphatidylinositol 3-kinase (PI3K) inhibitor; 15 μg·kg-1·d-1, intraperitoneal injection 15 min before each insulin treatment] group. The rats in the latter 3 groups were subject to ligation of the left anterior descending coronary artery, while those in sham group underwent the same surgical procedures without tying the sutures. The cardiac structural and functional changes were observed by echocardiogram, heart catheterization and microscopy with HE and Masson trichrome staining. Blood glucose was determined by Roche blood glucose meter, and the serum levels of insulin and brain natriuretic peptide (BNP) were detected by ELISA. The protein expression and phosphorylation of PI3K, Akt, glycogen synthase kinase 3β (GSK3β) and p38 mitogen-activated protein kinase (p38 MAPK) in myocardial tissues were detected by Western blotting. The mRNA expression of BNP, β-myosin heavy chain (β-MHC) and atrial natriuretic peptide (ANP) in myocardial tissues was determined by real-time fluorescence quantitative PCR.RESULTSAt the end of the 4th week, MI rats receiving long-term insulin treatment showed decreased ratio of heart length/heart weight, smaller systolic left ventricle cavity, thicker systolic interventricular septum, and increased cardiac ejection fraction, left ventricular development pressure and instantaneous first derivate of left ventricle pressure (P<0.05vsMI + saline group). Moreover, insulin treatment significantly increased the phosphorylation of PI3K and Akt and the serum level of BNP, and inhibited the phosphorylation of p38 MAPK (P<0.05vsMI + saline group), but did not change the mRNA expression of BNP in myocardial tissues. The effects of insulin on BNP were not blocked by wortmannin (P>0.05vsMI + insulin group).CONCLUSIONInsulin improves postischemic cardiac structure and function by increasing serum BNP levels possibly independent of PI3K-Akt signaling pathway.
Myocardial ischemia; Heart failure; Insulin; Natriuretic peptide,brain; p38 mitogen-activated protein kinases
R331.31
A
1000- 4718(2013)09- 1554- 07
2013- 04- 28
2013- 07- 11
国家自然科学基金资助项目(No. 81270330; No.31271220; No. 81270329; No.81100083)
△通讯作者 Tel: 029-84779277; E-mail: hfzhang@fmmu.edu.cn
10.3969/j.issn.1000- 4718.2013.09.003
