胰岛素样生长因子I通过改善线粒体功能保护新生大鼠心肌细胞免于凋亡*
2013-10-24李晋菊丁碧蓝许晓玲张剑凯吴柱国
李晋菊, 丁碧蓝, 许晓玲, 张剑凯, 黄 颖, 李 涛, 吴柱国△
(广东医学院 1儿科专业硕士研究生, 2第二临床学院, 3广东省医学分子诊断重点实验室, 广东 东莞 523808)
胰岛素样生长因子I通过改善线粒体功能保护新生大鼠心肌细胞免于凋亡*
李晋菊1#, 丁碧蓝2, 许晓玲2, 张剑凯3, 黄 颖3, 李 涛3, 吴柱国2△
(广东医学院1儿科专业硕士研究生,2第二临床学院,3广东省医学分子诊断重点实验室, 广东 东莞 523808)
目的探讨线粒体机制在胰岛素样生长因I(IGF-I)保护心肌细胞中的作用。方法体外培养新生大鼠心肌细胞,过氧化氢处理诱导凋亡,JC-1线粒体膜电位检测法和透射电镜观察心肌细胞线粒体膜电位和形态的改变,Annexin V-FITC/PI双染色法、caspase-3活性测定、DNA-ladder分析和Hoechst 33258染色方法观察心肌细胞凋亡的情况。结果过氧化氢可诱导心肌细胞凋亡,siRNA下调Kruppel 样因子9(KLF9)48 h后,心肌细胞线粒体膜电位下降率明显降低,由对照组的(24.0±1.6)%,降为IGF-I处理组的(18.3±1.2)%和KLF9下调组的(15.2±1.2)%;线粒体形态明显改善;DNA片段化改善;caspase-3活性降低,与对照组相比IGF-I处理组降低(1.30±0.28)倍,KLF9下调组降低(1.31±0.43)倍;Annexin V-FITC/PI双染法显示细胞凋亡率对照组为(42.5±1.8)%,IGF-I处理组为(22.4±4.2)%,KLF9下调组为(32.5±3.5)%;Hoechst 33258染色结果显示凋亡小体减少,KLF9下调组与IGF-I的抗心肌细胞凋亡效果相似。结论IGF-I通过下调KLF9表达改善线粒体功能,保护心肌细胞免于凋亡。
心肌细胞; 胰岛素样生长因子I; Kruppel 样因子9; 线粒体; 细胞凋亡
胰岛素样生长因子I(insulin-like growth factor I, IGF-I)是一类无论在结构和功能上都与胰岛素比较相似的生长因子。大量体内、外实验研究表明,IGF-I可以保护心肌细胞免于凋亡[1-2],而且在心肌梗死的患者体内IGF-I浓度降低[3]。线粒体在细胞凋亡的过程中扮演重要角色,线粒体是细胞内还原性氧自由基(reactive oxygen species,ROS)的主要来源,通过细胞色素C向胞内的释放、电子传递的改变以及膜电势和通透性的改变参与细胞凋亡的过程[4]。我们的前期研究发现,IGF-I可以通下调Kruppel样因子9 (Kruppel-like factor 9,KLF9)从而进一步下调细胞色素C家族的P4501A1 (cytochrome P450 1A1,CYP1A1),保护心肌细胞免于凋亡[5]。细胞色素C从线粒体的释放正是细胞凋亡的标志之一[6]。作为体内从不休息的细胞,心肌细胞的线粒体含量最为丰富[7],那么IGF-1保护心肌细胞免于凋亡的同时是否也可以恢复线粒体功能,这一问题的回答将使我们进一步明确IGF-I保护心肌细胞免于凋亡的机制。因此本文观察了利用KLF9特异性siRNA下调KLF9基因表达以后,诱导凋亡状态下新生大鼠心肌细胞线粒体功能的恢复情况,及其与凋亡的相关性。
材 料 和 方 法
1动物
初生1~3 d的SD新生大鼠购自广州中医药大学实验动物中心。
2试剂与仪器
DMEM培养基购于迈晨公司,Lipofectamine 2000、胎牛血清和0.25%胰酶购于Invitrogen,IGF-I 由Genentech公司惠赠,KLF9 siRNA及control siRNA购自Santa Cruz,caspase-3 和DNA-ladder检测试剂盒购自Merck, Hoechst 33258和线粒体膜电位检测试剂盒购自碧云天生物技术公司,Annexin V-FITC/PI双染色检测试剂盒购于凯基公司,其它常规试剂购自Sigma。电泳仪器采用Bio-Rad的Mini-PROTEAN System。图像采集应用Bio-Rad的Molecular Imager VersaDoc MP Systems。透射电镜观察由中山大学电镜室协助完成。
3主要方法
3.1细胞培养、诱导凋亡与转染 将生后1~3 d的SD新生大鼠浸入装有75%乙醇的烧杯中消毒,将消毒好的乳鼠置于大玻璃培养皿中(120 mm),在无菌条件下用眼科剪子及镊子开胸取出心脏,取3个小培养皿,各加预先温育的Ca2+free medium 5~10 mL,把心脏放于3个培养皿中漂洗3次至心脏表面无血渍,洗涤液澄清为止,把心脏放入一小玻璃培养皿(75 mm)中剪成小块,一个心脏剪成5块,将剪好的心脏转移至预先装有9 mL胰酶的小烧杯中,用磁力搅拌器搅拌10 min,,速度为保持转动的最低速(约60 r/min)静置1 min左右,待自然沉降后吸取上层混悬液丢弃,补充至原来体积的胰酶继续消化10 min,静置1 min左右,待自然沉降后吸取上层混悬液至50 mL离心管Ⅰ,轻吹打几下使心肌细胞呈单个分散状态后马上850 r/min、22 ℃离心7 min,弃上清,加5 mL Ca2+DMEM重悬细胞,吸取转移至50 mL离心管Ⅱ安放一旁,重复上步骤7~10次直至组织块完全消化为止,将所有收集到离心管Ⅱ中的细胞悬液850 r/min、22 ℃离心7 min,弃去上清,加入20 mL DMEM轻吹打,分别装入2个10 cm培养皿中,放置于37 ℃、5% CO2培养箱中培养90 min后,收集培养液中的非贴壁细胞转移到50 mL新离心管,850 r/min、22 ℃ 离心7 min,弃上清,吸取40 mL DMEM培养,24 h后观察细胞的贴壁情况, 48 h后换液。以后每2~3 d换1次。
诱导凋亡时,先用无血清DMEM洗细胞3次,然后换成无血清的DMEM继续培养。同时分别加IGF-I 10 nmol/L和KLF9 siRNA 10 μmol/L。KLF9 siRNA转染方法参见Lipofectamine 2000操作手册,24 h或32 h后均加H2O2200 μmol/L,48 h后收集细胞。
3.2DNA片段化分析 每个样品收集1×106个细胞,按照 Merck的DNA-ladder检测试剂盒说明书操作。
3.3Caspase-3活性分析 收集1×106个细胞,做好标记,PBS重悬细胞,以4 ℃、500×g离心5 min,弃上清。每1×106个细胞加50 μL Sample Buffer A (49 μL Sample buffer+0.1 μL PMSF+0.9 μL DTT),涡旋混合。冰上孵育10 min,4 ℃、1 000×g离心10 min。 转移上述溶解液至96孔板上,每孔加50 μL Assay Buffer B (49 μL Assay Buffer+ 0.1 μL PMSF+0.9 μL DTT),混匀, 每孔加入10 μL caspase-3 底物,盖上盖,37 ℃孵育2 h,进行酶标仪检测,选择激发光波长400 nm,发射光波长550 nm,记录荧光值,以正常心肌细胞组caspase-3荧光值为基准,求出各组的caspase-3相对活性,并绘制柱状图。
3.4Hoechst 33258染色 适量细胞培养于6孔板中,用PBS洗3次,加入1 mL固定液,4 ℃固定过夜,去除固定液,用PBS洗2次,每次用摇床晃3 min,吸尽液体。加入1 mL Hoechst 33258染色液,染色5 min,手动晃动数次,去除染色液,用PBS洗2次,每次用摇床晃3 min,吸紧液体。加1滴抗荧光淬灭剂于6孔板内,激发波长350 nm,发射波长460 nm,荧光显微镜下观察细胞形态并拍照。
3.5Annexin V-FITC/PI双染法 按凯基公司Annexin V-FITC/PI双染色检测试剂盒说明书操作。(0.5~1)×105细胞加入195 μL Annexin V-FITC 结合液和5 μL Annexin V-FITC,轻轻混匀,室温避光孵育10 min,1000×g离心5 min,弃上清,加入190 μL Annexin V-FITC 结合液轻轻重悬细胞,加入10 μL PI染色液,随即进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。
3.6线粒体膜电位检测 按碧云天公司的JC-1线粒体膜电位检测试剂盒说明书操作。(1~6)×105细胞重悬于0.5 mL培养液,加入0.5 mL JC-1染色液,37 ℃孵育20 min,600×g离心3 min,用JC-1染色缓冲液洗涤2次,再用适量JC-1染色缓冲液重悬后,用流式细胞仪分析。
3.7透射电镜的检测 吸出细胞培养液,用细胞刮轻轻刮下细胞至2 mL 离心管中,4 ℃、500×g离心5 min,加入2.5%戊二醛固定液,固定5 min,4 ℃、500×g离心5 min,勿摇晃,保持标本在4 ℃(冰盒)中,送电镜室进行环氧树脂包埋,超薄切片, 锇酸染色,在透射电镜下观察线粒体超微结构并拍照。
4统计学处理
数据用均数±标准差(mean±SD)表示,采用多组间比较的单因素方差分析,组间数据两两比较用Bonferroni检验,数据采用SPSS 17.0统计软件分析,以P<0.05为差异有统计学意义。
结 果
1乳鼠原代心肌细胞分离与培养
利用差异吸附方法,我们成功地分离了新生大鼠心肌细胞,通过倒置相差显微镜观察,贴壁的心肌细胞呈梭形、菱形或多角形,可观察到轻微搏动,心肌细胞比例占90%以上,见图1。
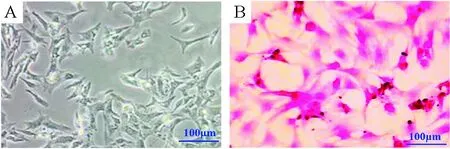
Figure 1. The morphology of neonatal rat primary myocardial cells.A: phase contrast; B: HE staining.
图1新生大鼠心肌细胞的形态
2KLF9特异性siRNA下调新生大鼠心肌细胞KLF9基因的表达
KLF9特异性siRNA转染新生大鼠心肌细胞后,可以特异性地下调新生大鼠心肌细胞KLF9的mRNA及蛋白表达,见图2。

Figure 2.KLF9-specific siRNA inhibited KLF9 mRNA (A) and protein (B) expression in neonatal rat primary myocardial cells.Mean±SD.n=3.*P<0.05vscontrol siRNA.
图2KLF9特异性siRNA抑制新生大鼠心肌细胞KLF9mRNA和蛋白的表达
3KLF9基因表达下调可以改善新生大鼠心肌细胞的凋亡
由图3A可见,IGF-I刺激或用特异性siRNA阻断KLF9表达,均可改善由过氧化氢处理导致细胞凋亡引起的DNA片段化。流式细胞术结果显示,IGF-I刺激或用特异性siRNA阻断KLF9表达,均使心肌细胞的凋亡率下降,对照组为(42.5±1.8)%,IGF-I处理组为(22.4±4.2)%,KLF9siRNA组为(32.5±3.5)%,差异显著,见图3B。Hoechst 33258染色结果显示(图3C),KLF9 siRNA组和IGF-I组较control siRNA组相比较,凋亡小体较少。Control siRNA组caspase-3活性(图3D)为正常未处理组细胞的(1.98±0.39)倍, IGF-I组与KLF9 siRNA组分别为(1.30±0.28)倍及(1.31±0.43)倍,IGF-I组与KLF9 siRNA组caspase-3活性较control siRNA组均有下降,差异显著(P<0.01)。
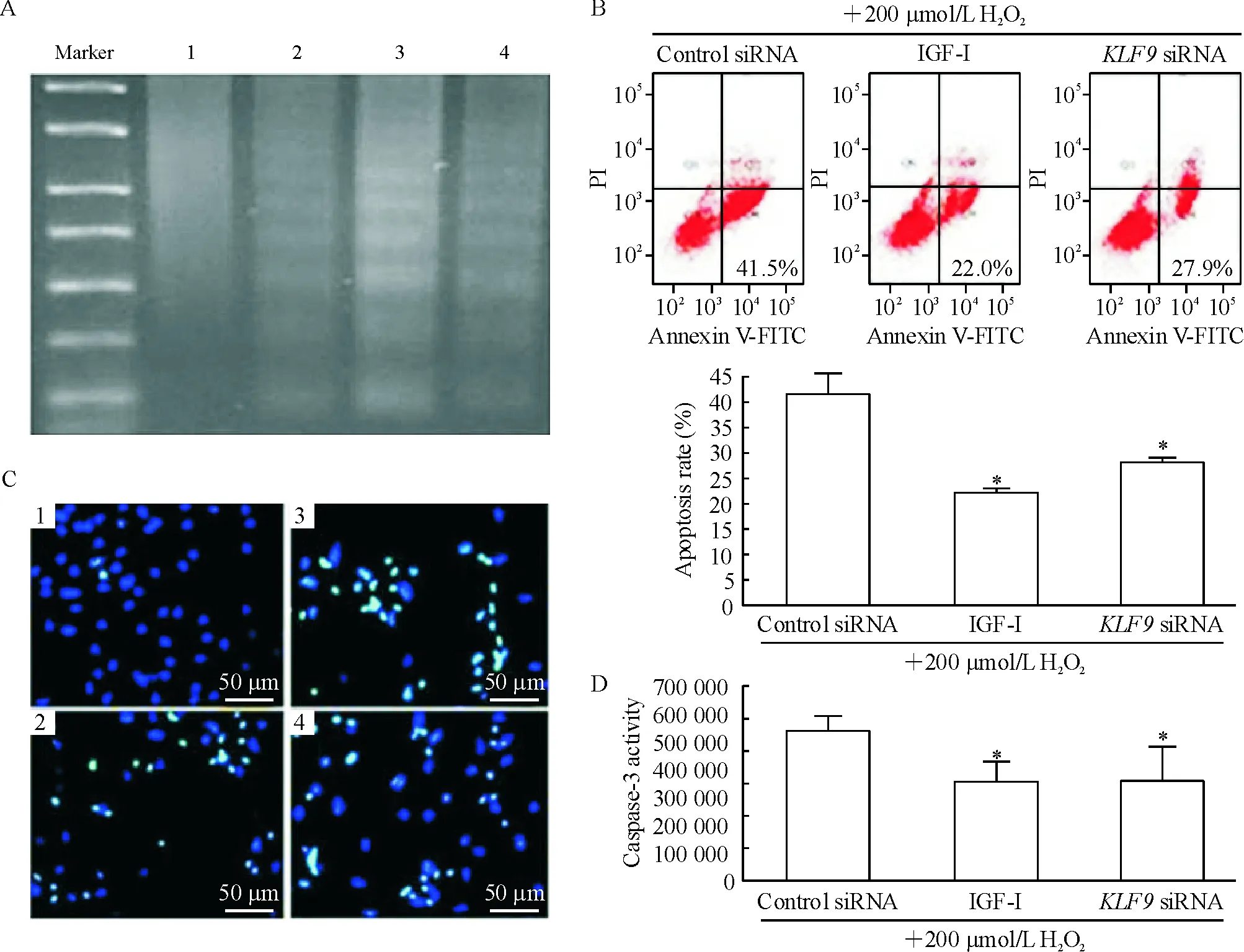
Figure 3. Cardiomyocyte apoptosis after down-regulation ofKLF9 expression. A: DNA-ladder;B: Annexin V-FITC/PI C: Hoechst 33258 staining; D: caspase-3 activity.1: normal; 2: 10 nmol/L IGF-I+200 μmol/L H2O2; 3: control siRNA+200 μmol/L H2O2; 4:KLF9 siRNA+200 μmol/L H2O2.Mean±SD.n=3.*P<0.05vscontrol siRNA.
图3下调KLF9表达后心肌细胞凋亡的情况
4KLF9基因表达下调可以改善新生大鼠心肌细胞线粒体膜电势
Control siRNA组线粒体膜电位下降(24.0±1.63)%,而IGF-I处理组和KLF9 siRNA组线粒体膜电位下降分别为(18.3±1.2)%和(15.2±1.2)%,IGF-I组和KLF9 siRNA组线粒体膜电位较control siRNA组有明显改善,见图4。以上结果说明KLF9基因表达下调可以改善由过氧化氢引起的心肌细胞线粒体损伤。
5KLF9基因表达下调可以改善新生大鼠心肌细胞线粒体形态
Control siRNA组线粒体肿胀,线粒体膜结构不完整,而IGF-I处理或用特异性siRNA阻断KLF9表达,仍有线粒体的肿胀,但与control siRNA组相比,线粒体形态明显改善,见图5。
讨 论
IGF-I可以通过调控心肌细胞的基因表达而保护心肌细胞免于凋亡[8],并且可以保护低温诱导的心脏损伤[9]。在我们的前期工作中发现IGF-I可以下调心肌细胞KLF9的表达,由于KLF9是一个转录因子,因此其表达发生改变以后会进一步影响受其调控的基因的表达。目前研究发现KLF9主要调控细胞色素C家族成员的表达[10-12],而细胞色素C主要存在于线粒体当中。线粒体功能不全与心血管疾病的发生密切相关[13],在重症休克时,线粒体功能不全使平滑肌细胞中ATP生成减少,它是引起血管收缩反应下降和顽固性低血压的原因之一[14]。在某些因素诱导下,线粒体结构发生破坏,膜通透性增加,细胞色素C外流,这是细胞凋亡的重要原因[15]。细胞色素C是催化细胞内ROS产生的主要酶类,下调其表达会导致ROS产生减少,从而保护由ROS引起的细胞凋亡。在肝细胞中下调CYP2E1和1A1表达,对细胞凋亡有明显的保护作用[16-17]。本研究在前期工作的基础上,发现IGF-I可以通过下调KLF9的基因表达,部分恢复过氧化氢诱导下心肌细胞的线粒体功能,这种恢复作用是通过下调细胞色素C的基因表达来实现的[5],而且这种保护与心肌细胞的凋亡密切相关。这一发现进一步强调了线粒体在心肌细胞凋亡中的作用,揭示了IGF-I保护心肌细胞免于凋亡的新机制,为心脏病的防治提供新的依据。
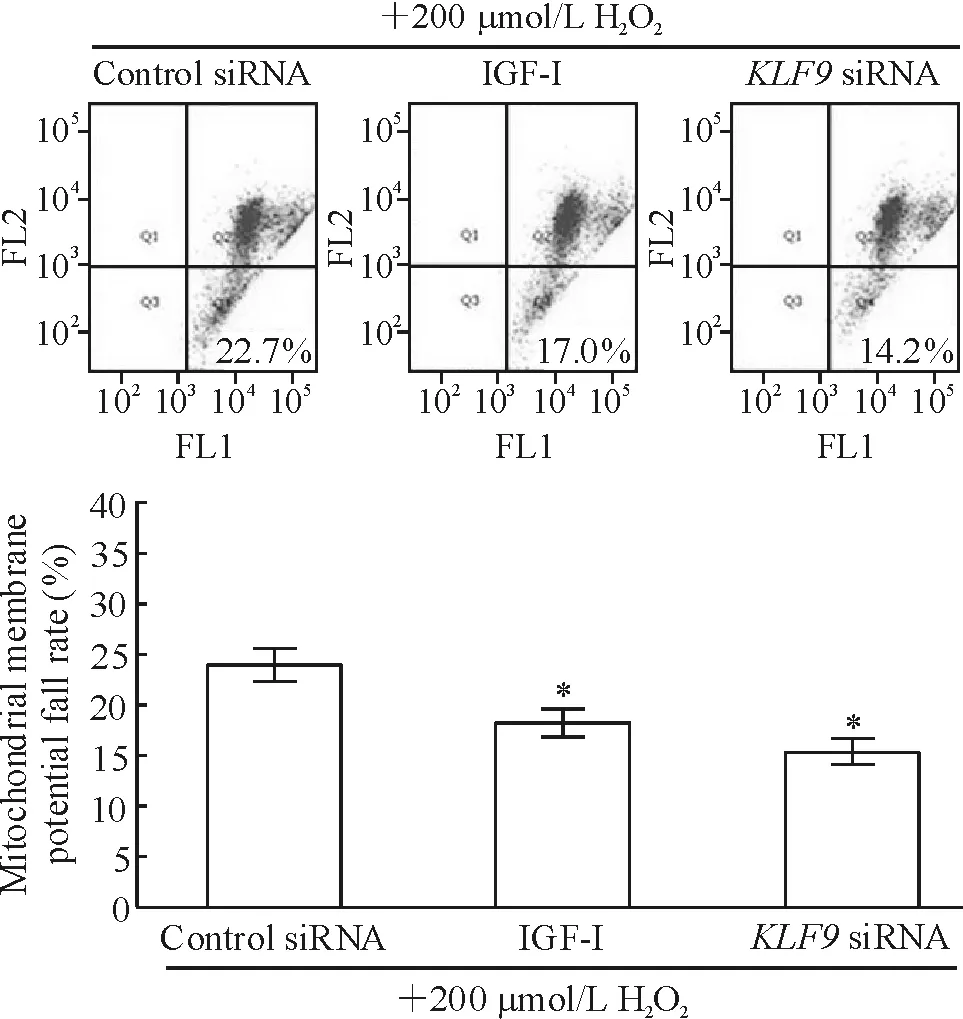
Figure 4. The fall rate of cardiomyocyte mitochondrial membrane potential after down-regulation ofKLF9 expression.Mean±SD.n=3.*P<0.05vscontrol siRNA.
图4下调KLF9表达后心肌细胞线粒体膜电位的变化

Figure 5. The cardiomyocyte mitochondrial morphology after down-regulation ofKLF9 expression.A:normal;B:control siRNA+H2O2; C:IGF-I+H2O2;D:KLF9 siRNA+H2O2.
图5下调KLF9表达后心肌细胞线粒体形态的变化
[1] Wang L, Ma W, Markovich R, et al. Regulation of cardiomyocyte apoptotic signaling by insulin-like growth factor I [J]. Circ Res,1998,83(5): 516-522.
[2] Wang PH. Roads to survival: insulin-like growth factor-1 signaling pathways in cardiac muscle[J]. Circ Res,2001,88(6): 552-554.
[3] Yuan R, Tsaih SW, Petkova SB, et al. Aging in inbred strains of mice: study design and interim report on median lifespans and circulating IGF1 levels[J]. Aging Cell,2009,8(3): 277-287 .
[4] Green DR, Reed JC. Mitochondria and apoptosis[J]. Science,1998,281(5381): 1309-1312.
[5] 吴柱国,刘世明, 李 涛. 胰岛素样生长因子保护心肌细胞免于凋亡的可能新机制[J]. 中华高血压杂志,2010,18(1): 85-90.
[6] Ekhterae D, Lin Z, Lundberg MS, et al. ARC inhibits cytochromecrelease from mitochondria and protects against hypoxia-induced apoptosis in heart-derived H9c2 cells[J]. Circ Res,1999,85(12): e70-e77.
[7] Lai HC, Liu TJ, Ting CT, et al. Insulin-like growth factor-1 prevents loss of electrochemical gradient in cardiac muscle mitochondria via activation of PI 3 kinase/Akt pathway[J]. Mol Cell Endocrinol,2003,205(1-2): 99-106 .
[8] Li T, Chen YH, Liu TJ, et al. Using DNA microarray to identify Sp1 as a transcriptional regulatory element of insulin-like growth factor 1 in cardiac muscle cells [J]. Circ Res,2003,93(12): 1202-1209 .
[9] 余国伟,陈 洁,陈莹莹,等. HSP90依赖的Akt线粒体转位参与IGF-I对低温保存心脏的保护作用[J]. 中国病理生理杂志,2012,28(10): 1773-1778.
[10] Hoffmann M, Mager WH, Scholte BJ, et al. Analysis of the promoter of the cytochrome P-450 2B2 gene in the rat[J]. Gene Expr,1992,2(4): 353-363.
[11] Imataka H, Sogawa K, Yasumoto K, et al. Two regulatory proteins that bind to the basic transcription element (BTE), a GC box sequence in the promoter region of the rat P-4501A1 gene[J]. EMBO J,1992,11(10): 3663-3671 .
[12] Foti D, Stroup D, Chiang JY. Basic transcription element binding protein (BTEB) transactivates the cholesterol 7α-hydroxylase gene (CYP7A) [J]. Biochem Biophys Res Commun,1998,253(1): 109-113 .
[13] 熊 燕,张 梅,陈 菲,等. 线粒体功能障碍与心血管疾病[J]. 中国病理生理杂志,2013,29(2): 364-370.
[14] 王兴民,赵克森. 线粒体功能不全在重症休克发生中的作用[J]. 中国病理生理杂志,2013,29(4): 757-760,768.
[15] Myasoedova KN. New findings in studies of cytochromes P450[J]. Biochemistry (Mosc),2008,73(9): 965-969.
[16] Ciolino HP, Dankwah M, Yeh GC. Resistance of MCF-7 cells to dimethylbenz(a)anthracene-induced apoptosis is due to reduced CYP1A1 expression[J]. Int J Oncol,2002,21(2): 385-391 .
[17] Jones BE, Liu H, Lo CR, et al. Cytochrome P450 2E1 expression induces hepatocyte resistance to cell death from oxidative stress[J]. Antioxid Redox Signal,2002,4(5): 701-709.
Insulin-likegrowthfactorIprotectsneonatalratcardiomyocytesfromapoptosisthroughimprovementofmitochondrialfunction
LI Jin-ju1, DING Bi-lan2, XU Xiao-ling2, ZHANG Jian-kai3, HUANG Ying3, LI Tao3, WU Zhu-guo2
(1PediatricGraduateStudent,2theSecondClinicalCollege,3GuangdongProvincialKeyLaboratoryofMedicalMolecularDiagnosis,GuangdongMedicalCollege,Dongguan523808,China.E-mail:wugdmc@126.com)
AIM: To investigate whether mitochondrial mechanism is involved in the anti-apoptotic effect of insulin-like growth factor I (IGF-I) on cardiomyocytes.METHODSPrimary neonatal rat cardiomyocytes (NRCMs) were cultured and treated with 200 μmol/L hydrogen peroxide (H2O2) to induce apoptosis. Kruppel-like factor 9 (KLF9)-specific siRNA was transfected into the cells by Lipofectamine 2000. The mitochondrial function was measured by JC-1 mitochondrial membrane potential (MMP) assay. The mitochondrial morphology was observed by transmission electron microscopy. Myocardial cell apoptosis was detected by Annexin V-FITC/PI dual staining, caspase-3 activity assay, DNA-ladder analysis and Hoechst 33258 staining.RESULTSThe apoptosis of NRCMs was induced by H2O2, with MMP decreased by (24.0±1.6)% compared with control group. The fall rates of MMP in IGF-I group andKLF9 siRNA group were (18.3±1.2)% and (15.2±1.2)%, respectively (bothP<0.01 vs H2O2group), and improved mitochondrial morphology, decreased caspase-3 activity, attenuated DNA fragmentation and reduced apoptotic bodies were also observed in these two groups. The apoptotic rates of NRCMs in IGF-I group andKLF9 siRNA group were (22.4±4.2)% and (32.5±3.5)%, respectively, both lower than that in H2O2group [(42.5±1.8)%,P<0.01]. The anti-apoptotic effect ofKLF9 silencing on NRCMs was consistent with that of IGF-I treatment.CONCLUSIONIGF-I protects NRCMs from apoptosis through down-regulatingKLF9 expression and improving mitochondrial function.
Cardiomyocytes; Insulin-like growth factor I; Kruppel-like factor 9; Mitochondria; Apoptosis
R329.21
A
1000- 4718(2013)09- 1585- 05
2013- 02- 21
2013- 07- 30
广东省自然科学基金资助项目(No. 10152402301000009);东莞市高等院校科技计划重点项目(No. 201010815202)
△通讯作者 Tel: 0769-22896978; E-mail: wugdmc@126.com
# 现工作单位: 临汾市人民医院儿科
10.3969/j.issn.1000- 4718.2013.09.008
