PKCε信号通路介导槲皮素拮抗心肌细胞缺氧/复氧损伤*
2013-10-24彭易安胥甜甜易小清罗喻超
汤 蕾, 彭易安, 胥甜甜, 易小清, 刘 瑛, 罗喻超, 尹 东, 何 明△
(1南昌大学食品科学与技术国家重点实验室,江西 南昌330047; 2南昌大学药学院药理学与分子治疗学教研室,江西 南昌 330006; 3南昌大学第二附属医院分子医学中心实验室,江西 南昌330006)
PKCε信号通路介导槲皮素拮抗心肌细胞缺氧/复氧损伤*
汤 蕾1,2, 彭易安1,2, 胥甜甜2, 易小清2, 刘 瑛2, 罗喻超2, 尹 东3, 何 明1,2△
(1南昌大学食品科学与技术国家重点实验室,江西 南昌330047;2南昌大学药学院药理学与分子治疗学教研室,江西 南昌 330006;3南昌大学第二附属医院分子医学中心实验室,江西 南昌330006)
目的探讨槲皮素拮抗心肌细胞缺氧/复氧(A/R)损伤与蛋白激酶Cε(PKCε)之间的关系。方法培养新生大鼠原代心肌细胞,构建A/R模型,Western blotting检测槲皮素对PKCε表达水平的调节。检测A/R损伤后各组细胞乳酸脱氢酶活性、肌酸激酶活性、细胞存活率、活性氧(ROS)含量、线粒体膜电位、线粒体通透性转换孔(mPTP)的开放和细胞凋亡。结果A/R前72 h加入40 μmol/L槲皮素可明显上调心肌细胞PKCε蛋白表达水平,并显著提高细胞存活率,减少ROS产生,维持线粒体膜电位,抑制mPTP开放,减少细胞凋亡(P<0.01)。同时经槲皮素和PKCε抑制剂εV1-2预处理后,则槲皮素的上述保护作用均明显减弱或消失(P<0.01)。结论槲皮素可以上调心肌细胞PKCε蛋白表达水平,其抗心肌缺血再灌注损伤的保护作用机制可能依赖于PKCε途径。
槲皮素; 蛋白激酶Cε; 心肌保护; 缺氧/复氧
心肌缺血/再灌注(ischemia/reperfusion, I/R) 损伤引起的心肌细胞凋亡或坏死是心力衰竭主要致死原因之一。在过去几十年中,一些植物化学物如黄酮类物质被发现具有心肌保护作用。槲皮素(quercetin,Que)是自然界中含量最丰富的黄酮醇类化合物,动物实验已证实槲皮素可以对抗心、脑、肾等多种组织器官的I/R引起的氧化应激损伤,一些流行病学研究也提出槲皮素的日常摄入量与冠心病发病和致死率之间的负相关[1]。虽然黄酮醇类物质对心血管系统的保护作用主要是源于其强大的抗氧化性,但已有研究发现,其具体机制可能还涉及某些细胞内信号路径功能和特定蛋白质表达水平的调控[2-3]。
蛋白激酶Cε(protein kinase C epsilon,PKCε)是蛋白激酶C家族成员之一,其功能涉及多种病理生理过程,包括有丝分裂、应激状况下的细胞存活、新陈代谢和转录调控等。大量的研究已证实,缺血预适应、缺血后适应等多种心肌保护机制均涉及PKCε信号路径[4]。我们曾发现,槲皮素预处理可以上调心肌细胞PKCε蛋白表达水平。在本研究中,我们采用新生大鼠原代心肌细胞,建立急性缺氧/复氧(anoxia/reoxygenation, A/R)模型,确认槲皮素预处理上调PKCε蛋白表达水平的最佳时间和浓度;并选用特异性PKCε抑制物εV1-2,探讨槲皮素抗心肌细胞A/R损伤作用与其对PKCε蛋白表达水平调节之间的关系。
材 料 和 方 法
1动物
出生1~3d的清洁级Sprague-Dawley(SD)大鼠,雌雄不拘,购自南昌大学实验动物科学部。
2主要试剂
MEM培养基购自Gibco-BRL;胎牛血清购自杭州四季青生物工程材料有限公司;槲皮素购自中国食品药品检定研究院;RIPA裂解液购自碧云天生物技术有限公司;抗体购自Santa Cruz;PKCε特异性抑制剂εV1-2购自Anaspec;乳酸脱氧酶(lactate dehydrogenase,LDH)和肌酸激酶(creatine kinase,CK)检测试剂盒购自南京建成科技有限公司;噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT]购自Sigma;活性氧(reactive oxygen species,ROS)荧光染料DCFH-DA (2’,7’-dichlorodihydrofluorescein diacetate)和线粒体膜电位荧光探针JC-1(5,5’,6,6’-tetrachloro-1,1’,3,3’-tetraethylbenzi-midazolocarbocyanine iodide)购自Invitrogen;线粒体/胞质分离试剂盒购自BioVision;Annexin V/PI凋亡检测试剂盒购自BD Biosciences。
3方法
3.1细胞培养及实验分组 根据文献[5]方法制备新生大鼠原代心肌细胞。取出SD乳鼠心脏,分离心室组织,用0.1%胰酶,37 ℃水浴消化数次。至组织消化完全后将全部细胞混悬液接种到100 mm培养皿,置于5%CO2、37 ℃培养箱1.5 h,进行差速贴壁除去成纤维细胞。按实验需要分别将细胞接种于6孔板和96孔板。5%CO2、37 ℃培养24 h后,换培养液为含10% FBS的MEM(含0.1 mmol/L BrdU以抑制纤维细胞生长),2~3 d后开始可用于实验处理。实验分为对照组(常规培养,不经A/R处理)、A/R组(缺氧3 h后复氧2 h)、Que+A/R组(在A/R前72 h加入40 μmol/L槲皮素)、 Que +εV1-2+A/R组(A/R前72 h加入40 μmol/L槲皮素,A/R前30 min加入1 μmol/L抑制剂εV1-2)和 εV1-2+A/R组(A/R前30 min加入1 μmol/L抑制剂εV1-2)。
3.2A/R模型的建立 参照文献方法[6],配制模拟缺氧液和模拟复氧液。A/R处理开始时,对培养心肌细胞换用预先经95% N2和5% CO2混和气体饱和过的模拟缺氧溶液,置于持续95%N2-5%CO2平衡的A/R装置(37 ℃)中缺氧孵育3 h后,再换用模拟再灌注溶液于95%O2-5%CO2(37 ℃)。复氧孵育2 h。对照组细胞于常规生长培养基中,5%CO2、37 ℃孵育5 h。
3.3Western blotting 检测PKCε蛋白表达水平 各组细胞经A/R处理后,用RIPA 裂解液充分裂解细胞后,12 000 r/min,4 ℃离心15 min,取上清。加入上样缓冲液98 ℃加热变性5 min。各组取等量蛋白液进行SDS-PAGE凝胶电泳及转膜。将膜置于含10% 脱脂牛奶的TBS-T封闭液中 2 h,与1∶500稀释的抗PKCε Ⅰ抗室温振荡孵育1 h, TBS-T洗膜,再与1∶2 000稀释的辣根过氧化物酶标记Ⅱ抗孵育1 h,TBS-T洗膜。 加化学发光剂于膜上反应1 min, X射线胶片曝光分析。
3.4LDH及CK活性检测 实验结束后,取各组细胞培养液用于检测CK和LDH活性,具体操作按试剂说明书进行。
3.5细胞存活率检测 采用MTT实验来比较各组细胞经A/R处理后的细胞存活率变化。各组细胞按1×104cells/well的密度接种于96孔板,A/R处理后,去除培养基,加入MTT (5×10-3mg/L) 37 ℃ 孵育4 h后,弃上清,加入150 μL/well DMSO室温振荡10 min充分溶解结晶, 使用酶标仪测定各孔490 nm波长处的吸光度。结果以对照组吸光度的百分比表示。
3.6细胞内活性氧含量检测 A/R后,收集各组心肌细胞用预冷的PBS洗2次,用配制好的10 μmol/L DCFH-DA溶液500 μL重悬细胞,37 ℃孵育30 min,800×g离心5 min,弃上清;预冷的PBS洗涤细胞2~3次,立即进行流式细胞仪(Becton Dickinson)检测以488 nm为激发波长、530 nm为发射波长测各组的绿色荧光强度。
3.7线粒体膜电位检测 A/R后,收集各组心肌细胞用预冷的PBS洗2次,分别加入10 μL JC-1(200 μmol/L),37 ℃孵育20 min,800×g离心5 min,弃上清;PBS洗涤细胞2~3次,制成108/L的悬液,立即进行流式细胞仪检测,分别以488 nm为激发光波长,527 nm和590 nm为发射光波长测绿色和红色荧光强度,以各组红/绿荧光强度的比值反映线粒体膜电位水平。
3.8线粒体肿胀实验检测线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)的开放 采用线粒体/胞质分离试剂盒分离新生大鼠原代心肌细胞线粒体。操作如下:收获的细胞用预冷的PBS洗2次,用1.0 mL 1×Cytosol Extraction Buffer Mix重悬细胞,冰浴10 min;细胞移入匀浆器中,充分匀浆至70%~80%细胞破裂;转移至离心管,4 ℃、700×g离心10 min, 收集上清至新的离心管,4 ℃、10 000×g离心30 min,上清为胞浆。线粒体沉淀中加入500 μL Swelling Buffer重悬,用于mPTP开放检测。
根据文献方法[7],采用Ca2+诱导的线粒体肿胀实验检测mPTP的开放。在520 nm 波长处测各组吸光度初值(A1),加200 μmol·L-1CaCl2诱导mPTP开放,每隔1~2 min测量数据变化,20 min后吸光度不再变化,记录此时吸光度值(A2),△A=A1-A2。用ΔA/min×1 000表示mPTP开放程度,此数值越大,mPTP开放程度越大。预先加入30 nmol·L-1mPTP阻滞剂cyclosporin A作为阴性对照。
3.9细胞凋亡检测 细胞凋亡的检测采用Annexin V/PI凋亡检测试剂盒。A/R后,收集各组心肌细胞用预冷的PBS洗2次后,用1×Binding Buffer重悬细胞,使细胞密度为约5×109cells/L。先后加入10 μL Annexin V-FITC 和 5 μL PI,轻度涡旋后,室温避光孵育15 min,加入300 μL Binding Buffer,立即进行流式细胞仪检测(激发光488 nm;发射光578 nm),各组阳性细胞百分率用于表示细胞凋亡水平。
4统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 11.5进行方差齐性检验,组间均数比较采用单因素方差分析(One way-ANOVA),两两比较采用LSD法,以P<0.05为差异有统计学意义。
结 果
1槲皮素上调A/R处理的新生大鼠原代心肌细胞PKCε蛋白表达水平
经槲皮素预处理组的PKCε蛋白表达水平都有不同程度上调,其中72 h前预处理组的蛋白表达水平普遍高于24及48 h预处理组(结果未显示)。在72 h预处理的各浓度组中,40 μmol/L槲皮素预处理组PKCε蛋白表达水平最高,与对照组及A/R组相比差异均有统计学意义(P<0.01),见图1。在之后的实验中,所有涉及槲皮素预处理的分组,其处理方式均为A/R前72 h加入40 μmol/L槲皮素。
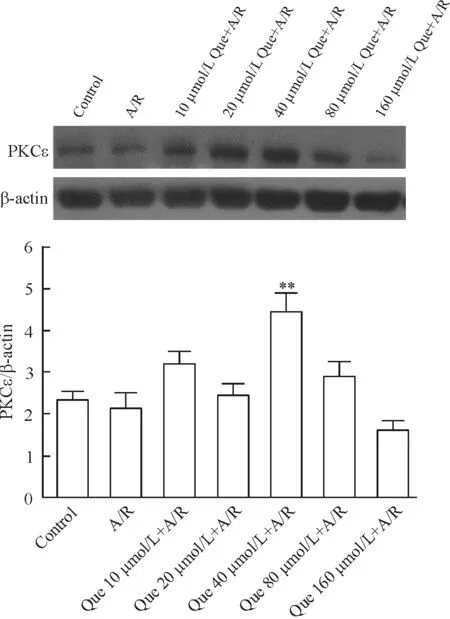
Figure 1. Effect of quercetin(Que) on PKCε expression in rat primary cardiomyocytes exposed to A/R.Mean±SD.n=3.**P<0.01vscontrol group or A/R group.
图1槲皮素对A/R处理的大鼠原代心肌细胞PKCε蛋白表达水平的影响
2槲皮素及εV1-2预处理对心肌细胞状态及存活率的影响
如表1所示,与对照组相比,A/R组细胞培养液CK和LDH活性明显升高(P<0.01),提示A/R损伤模型建立成功。但槲皮素预处理组的CK和LDH活性则明显低于A/R组(P<0.01),说明槲皮素预处理可以保护心肌细胞免受A/R损伤。有趣的是,槲皮素加εV1-2预处理组CK和LDH活性明显高于单纯槲皮素预处理组(P<0.01),说明PKCε抑制剂εV1-2取消了槲皮素的心肌保护作用。而εV1-2+A/R组的结果与A/R组无明显差异,说明此剂量的εV1-2不影响基础状态下的PKCε功能。与A/R组相比,槲皮素预处理组的细胞存活率明显升高(P<0.01),额外加入εV1-2则呈现出较低的细胞活率 (P<0.01vsQue +A/R组)。同样,εV1-2+A/R组细胞存活率与A/R组无明显差异。
表1槲皮素或槲皮素加εV1-2预处理对A/R损伤后心肌细胞LDH、CK和细胞存活率及线粒体膜电位的影响
Table 1. The changes of LDH, CK, cell viability and mitochondrial membrane potential in cardiomyocytes pretreated with quercetin (Que) or Que plus εV1-2(Mean±SD.n=5)

GroupCellviability(%)LDHactivity(U/L)CKactivity(U/L)Mitochondrialmembranepotential(red/green)Control10060.00±2.9845.17±3.37 1.62±0.11 A/R31.72±2.35**144.00±7.97**132.00±8.72**0.63±0.09**Que+A/R88.65±4.78▲▲63.00±5.34▲▲71.79±4.67▲▲1.37±0.08▲▲Que+εV1-2+A/R40.30±3.99##129.00±6.01##120.89±5.55##0.76±0.12##εV1-2+A/R34.51±2.21135.23±8.37126.30±7.740.61±0.07
**P<0.01vscontrol group;▲▲P<0.01vsA/R group;##P<0.01vsQue+A/R group.
3槲皮素及εV1-2预处理对A/R诱导的心肌细胞ROS产生的影响
如图2所示,A/R组ROS含量明显高于对照组,槲皮素预处理可明显抑制A/R导致的ROS产生(P<0.01vsA/R组)。槲皮素预处理后再加入εV1-2则使ROS含量明显升高(P<0.01vsQue+A/R组),与A/R组水平接近。

Figure 2. Quercetin(Que) preconditioning decreased the ROS generation in cardiomyocytes induced by A/R, while this effect was abrogated by εV1-2. Mean±SD.n=5.**P<0.01vscontrol group;△△P<0.01vsA/R group;##P<0.01vsQue+A/R group.
图2槲皮素或槲皮素加εV1-2预处理对A/R损伤后心肌细胞内ROS含量的影响
4槲皮素及εV1-2预处理对A/R引起的心肌细胞线粒体膜电位变化的影响
本实验以红/绿荧光的比值衡量线粒体膜电位水平。如表1所示,A/R组细胞的红/绿荧光比值明显低于正常对照组,表明A/R处理引起了线粒体膜电位的下降。而同样经历A/R的槲皮素预处理组,该比例却明显高于A/R组,说明槲皮素预处理可以减轻A/R引起的线粒体膜电位下降。在槲皮素加εV1-2预处理组,红/绿荧光比值明显低于单纯槲皮素预处理组,说明εV1-2的加入取消了槲皮素对线粒体膜电位的保护作用。
5槲皮素及εV1-2预处理对A/R引起的mPTP开放的影响
如图3所示,除加入cyclosporin A的阴性对照组外,各组吸光度均呈现出下降,说明我们所观察到的吸光度变化是mPTP 开放特异性的。其中A/R组吸光度下降趋势明显强于正常对照组 (P<0.01),说明A/R损伤降低了线粒体膜对Ca2+的耐受性,增强了mPTP 的开放,而槲皮素预处理组的吸光度变化程度明显低于A/R 组(P<0.01),说明槲皮素预处理可以抑制A/R引起的mPTP 开放。而槲皮素及εV1-2预处理组吸光度变化明显大于单纯槲皮素处理组(P<0.01),表明εV1-2取消了槲皮素抑制mPTP开放的作用。
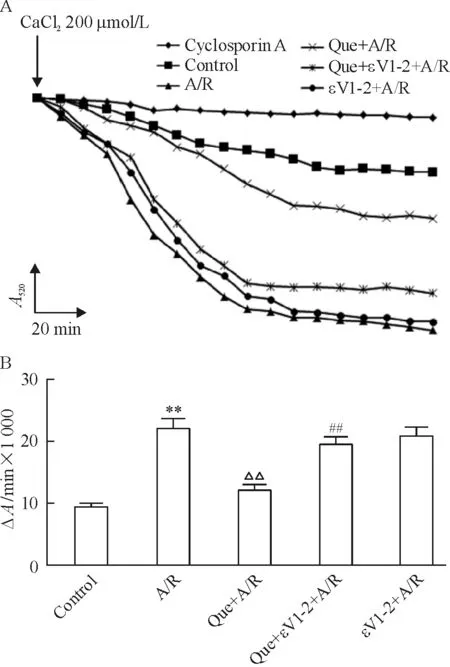
Figure 3. Quercetin(Que) preconditioning suppressed the mPTP opening in cardiomyocytes induced by A/R, while this effect was abrogated by εV1-2. A: original traces were shown for Ca2+-dependent mitochondrial swelling, monitored by the decrease in absorbance; B: rate of mitochondrial swelling induced by 200 μmol/L CaCl2.Mean±SD.n=5.**P<0.01vscontrol group;△△P<0.01vsA/R group;##P<0.01vsQue+A/R group.
图3槲皮素或槲皮素加εV1-2预处理对A/R损伤后心肌细胞mPTP开放的影响
6槲皮素及εV1-2预处理对A/R引起的心肌细胞凋亡的影响
如图4所示,A/R组凋亡细胞百分率明显高于正常对照组(P<0.01)。与之相比,槲皮素预处理组细胞凋亡水平则明显降低(P<0.01),说明槲皮素预处理可以抑制A/R引起的心肌细胞凋亡,而槲皮素加εV1-2预处理组,凋亡水平则明显高于单纯槲皮素处理组(P<0.01),说明εV1-2减弱槲皮素的抗凋亡作用。
讨 论
心肌I/R引起的心肌细胞死亡及功能损伤是各种缺血性心脏病患者死亡的主要原因。缺血组织再灌注时,氧的再次供给导致ATP的生成,但损坏的电子传递系统引起大量线粒体ROS生成以及各种氧化应激损伤。线粒体钙超载和ROS含量的增加导致mPTP开放,离子稳态被破坏,线粒体膜电位进一步崩塌,凋亡信号因子进入胞浆启动细胞凋亡,最终引起组织和器官的功能损伤[8]。槲皮素强大的抗氧化作用可以减轻肝、肾、心、脑等多种器官的缺血再灌注损伤,改善细胞功能[3,9]。Ikizler等[10]进行离体心脏灌流实验发现,SD大鼠连续7 d进行50 mg/kg槲皮素灌胃或全心缺血前30 min进行15 mmol/L槲皮素灌注,都可明显对抗随后的I/R损伤。其中连续7 d处理组的差异更显著。这提示我们槲皮素的心肌保护作用可能涉及相关蛋白质的表达调控。
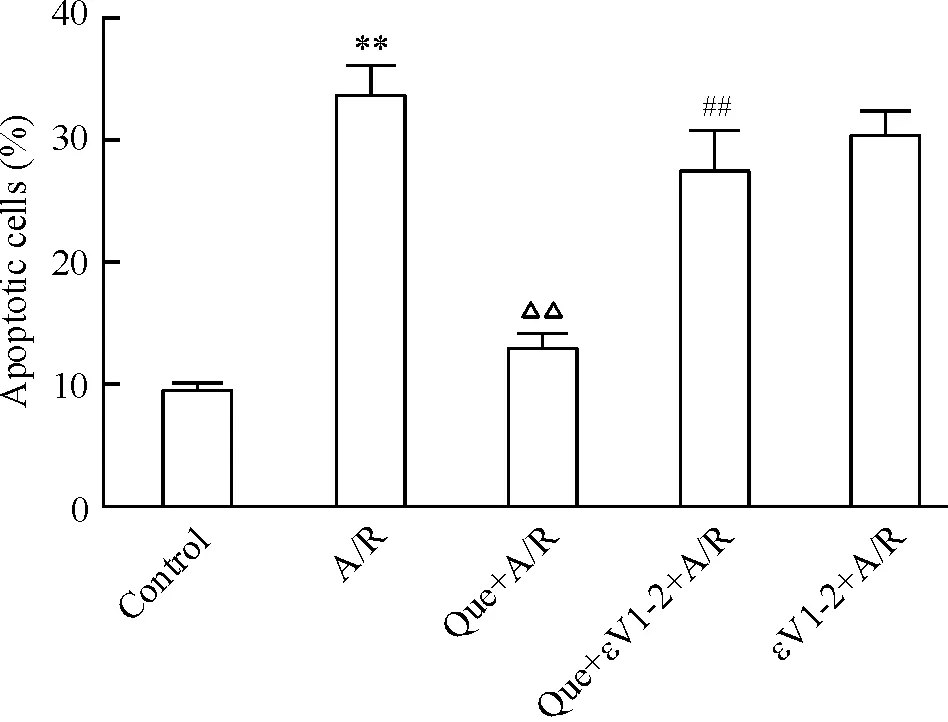
Figure 4. Quercetin(Que) preconditioning inhibited the apoptosis of cardiomyocytes induced by A/R, while this effect was abrogated by εV1-2.Mean±SD.n=5.**P<0.01vscontrol group;△△P<0.01vsA/R group;##P<0.01vsQue+A/R group.
图4槲皮素或槲皮素加εV1-2预处理对A/R损伤后心肌细胞凋亡的影响
本研究首次证实槲皮素预处理可以明显上调心肌细胞PKCε蛋白表达水平。为探讨槲皮素的心肌保护作用是否依赖于其对PKCε蛋白表达水平的上调,我们采用了特异性的PKCε抑制剂εV1-2,在不影响基础水平PKCε蛋白功能的浓度下,比较单纯槲皮素预处理组和槲皮素加εV1-2预处理组心肌细胞在经A/R损伤后,细胞存活率、细胞内ROS含量、线粒体膜电位、mPTP开放及细胞凋亡的变化。结果表明在加入特异性PKCε抑制剂εV1-2后,槲皮素的各种抗A/R损伤保护作用包括提高细胞存活率、减少细胞内ROS产生,维持线粒体膜电位,抑制mPTP开放等,均有不同程度的减弱,甚至完全消失。这说明槲皮素上述心肌保护作用的实现涉及PKCε信号路径的功能。
细胞凋亡是心肌I/R损伤的主要特征,也是其导致患者死亡的主要原因,因此减少细胞凋亡是各种心肌保护作用的关键。虽然槲皮素的抗肿瘤作用是源于其能够促进卵巢癌、胰腺癌和食道癌等肿瘤细胞的凋亡[11-12],但也有研究发现,槲皮素可以抑制鱼藤酮诱导的PC12细胞凋亡及肾、脑等组织I/R损伤引起的凋亡[13-14]。在本研究中,我们证实槲皮素预处理的确可以明显减少A/R诱导的心肌细胞凋亡,并且该作用的实现也依赖于PKCε信号路径,因为εV1-2的加入可明显减弱槲皮素的抗心肌细胞凋亡作用。
综上所述,我们认为,槲皮素的抗心肌缺血再灌注损伤保护作用的机制涉及PKCε路径,并至少部分依赖于其对PKCε蛋白表达水平的上调。这一发现不仅使我们更深入了解槲皮素这一重要的植物化学物维护心血管健康的内在机制,也为我们探索心血管保护药物提供了新的思路。
[1] Kelly GS. Quercetin. Monograph [J].Altern Med Rev, 2011, 16(2): 172-194.
[2] Kinaci MK, Erkasap N, Kucuk A, et al. Effects of quercetin on apoptosis, NF-κB and NOS gene expression in renal ischemia/reperfusion injury [J]. Exp Ther Med,2012, 3(2): 249-254.
[3] Jin HB, Yang YB, Song YL, et al. Protective roles of quercetin in acute myocardial ischemia and reperfusion injury in rats [J]. Mol Biol Rep,2012, 39(12): 11005-11009.
[4] Miura T, Tanno M, Sato T. Mitochondrial kinase signalling pathways in myocardial protection from ischaemia/reperfusion-induced necrosis [J]. Cardiovasc Res, 2010, 88(1): 7-15.
[5] Watkins SJ, Borthwick GM,Arthur HM. The H9C2 cell line and primary neonatal cardiomyocyte cells show similar hypertrophic responsesinvitro[J].InVitroCell Dev Biol Anim, 2010, 47(2): 125-131.
[6] Xu M, Wang Y, Hirai K, et al. Calcium preconditioning inhibits mitochondrial permeability transition and apoptosis [J]. Am J Physiol Heart Circ Physiol, 2001, 280(2): H899-H908.
[7] Javadov S, Choi A, Rajapurohitam V, et al. NHE-1 inhibition-induced cardioprotection against ischaemia/reperfusion is associated with attenuation of the mitochondrial permeability transition [J]. Cardiovasc Res, 2008, 77(2): 416-424.
[8] Murphy E, Steenbergen C. Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury [J]. Physiol Rev, 2008, 88(2): 581-609.
[9] Kahraman A, Erkasap N, Serteser M, et al. Protective effect of quercetin on renal ischemia/reperfusion injury in rats [J]. J Nephrol, 2003, 16(2): 219-224.
[10] Ikizler M, Erkasap N, Dernek S, et al. Dietary polyphenol quercetin protects rat hearts during reperfusion: enhanced antioxidant capacity with chronic treatment [J]. Anadolu Kardiyol Derg, 2007, 7(4): 404-410.
[11] 邓晓慧,宋海岩,孙春莉.槲皮素对人卵巢癌SKOV-3细胞增殖的影响[J]. 中国病理生理杂志,2013,29(1):99-102.
[12] Angst E, Park JL, Moro A, et al. The flavonoid quercetin inhibits pancreatic cancer growthinvitroandinvivo[J]. Pancreas, 2013, 42(2): 223-229.
[13] 毕 伟,朱丽红,王传明,等.槲皮素抑制鱼藤酮诱导的PC12细胞凋亡[J]. 中国病理生理杂志, 2011, 27(1):82-85.
[14] Yao RQ, Qi DS, Yu HL, et al. Quercetin attenuates cell apoptosis in focal cerebral ischemia rat brain via activation of BDNF-TrkB-PI3K/Akt signaling pathway [J]. Neurochem Res,2012, 37(12): 2777-2786.
Protectiveeffectofquercetinonratcardiomyocytesagainstanoxia/reoxygenationinjuryismediatedbyPKCεsignalingpathway
TANG Lei1,2, PENG Yi-an1,2, XU Tian-tian2, YI Xiao-qing2, LIU Ying2, LUO Yu-chao2, YIN Dong3, HE Ming1,2
(1StateKeyLaboratoryofFoodScienceandTechnology,NanchangUniversity,Nanchang330047,China;2DepartmentofPharmacology&MolecularTherapeutics,SchoolofPharmaceuticalScience,NanchangUniversity,Nanchang330006,China;3JiangxiProvincialKeyLaboratoryofMolecularMedicine,theSecondAffiliatedHospitalofNanchangUniversity,Nanchang330006,China.E-mail:jxhm56@hotmail.com)
AIM: To investigate whether quercetin (Que) protects cardiomyocytes from anoxia/reoxygenation (A/R) injury through protein kinase C epsilon (PKCε) pathway.METHODSPrimary cardiomyocytes were isolated from neonatal SD rats and exposed to A/R (3 h of anoxia followed by 2 h of reoxygenation) as well as Que and/or εV1-2 (a selective PKCε inhibitor) preconditioning. The expression of PKCε in the cells was detected by Western blotting. The levels of lactate dehydrogenase (LDH) and creatine kinase (CK) in cell culture supernatants, the reactive oxygen species (ROS) and mitochondrial membrane potential in the cells, the opening of mitochondrial permeability transition pore (mPTP) and the cell viability and apoptosis were also measured.RESULTSThe expression of PKCε protein was significantly increased in the cardiomyocytes pretreated with 40 μmol/L Que 72 h before A/R (P<0.01vsA/R group). Meanwhile, Que preconditioning could increase cell survival rate, decrease ROS production and cell apoptosis, alleviate the loss of mitochondrial membrane potential and inhibit the opening of mPTP induced by A/R injury (P<0.01vsA/R group). However, pretreatment with Que and εV1-2 attenuated these protective effects of Que (P<0.01vsQue+A/R group).CONCLUSIONOne of the mechanisms underlying the cardioprotective effect of Que might be the increase in PKCε protein expression and the activation of its downstream pathway.
Quercetin; Protein kinase C epsilon; Cardioprotection; Anoxia/reoxygenation
R965.1
A
1000- 4718(2013)09- 1567- 06
2013- 05- 03
2013-07 - 09
国家973计划项目(No.2009CB526405);国家自然科学基金资助项目(No.81260492)
△通讯作者 Tel: 0791-86362231; E-mail: jxhm56@hotmail.com
10.3969/j.issn.1000- 4718.2013.09.005
