脂肪特异性蛋白27对大鼠肝星状细胞活化的影响*
2013-10-24俞富祥宋才鑫吴志伟张启瑜
俞富祥, 宋才鑫, 吴志伟, 张启瑜
(温州医学院附属第一医院肝胆胰外科,浙江 温州 325000)
脂肪特异性蛋白27对大鼠肝星状细胞活化的影响*
俞富祥, 宋才鑫, 吴志伟, 张启瑜△
(温州医学院附属第一医院肝胆胰外科,浙江 温州 325000)
目的探讨脂肪特异性蛋白27(Fsp27)对肝星状细胞(HSCs)增殖和活化的影响及其对纤维化相关蛋白的调节作用。方法从SD大鼠肝脏提取HSCs并培养,采用实时荧光定量PCR、免疫荧光染色和Western blotting检测原代HSCs和活化HSCs中Fsp27 mRNA和蛋白的表达。构建携带Fsp27基因的慢病毒,转染活化的HSCs并继续培养72 h,通过CCK-8比色法检测Fsp27对HSCs增殖的影响;Western blotting检测HSCs中α-平滑肌肌动蛋白(α-SMA)的表达,了解HSCs的活化状态;实时荧光定量PCR检测Fsp27对HSCs中纤维化相关蛋白[包括基质金属蛋白酶2(MMP-2)、金属蛋白酶组织抑制物1(TIMP-1)和转化生长因子β1(TGF-β1)] mRNA表达的影响。结果成功分离大鼠原代HSCs。Fsp27在原代HSCs和活化HSCs中的表达差异显著(P<0.01);活化HSCs成功转染携带Fsp27基因的慢病毒后继续培养72 h,与对照组比较,HSCs的活化与增殖被明显抑制(P<0.05);Fsp27促进MMP-2 mRNA的表达(P<0.05),降低TIMP-1和TGF-β1mRNA的表达(P<0.05)。结论Fsp27可抑制HSCs的增殖和活化,并调节纤维化相关蛋白的表达。Fsp27的作用可能与其维持HSCs静息状态细胞表型有关。
脂肪特异性蛋白27; 肝星状细胞; 活化
众所周知,肝星状细胞(hepatic stellate cells,HSCs)的活化与增殖是肝纤维化发生发展的中心环节。HSCs增殖激活后可分泌大量细胞外基质,引起胶原纤维沉积导致纤维化。阻止HSCs的增殖活化有可能阻断肝纤维化肝硬化的进程[1-4]。针对HSCs的有关肝纤维化机制及对其防治的研究近年已成为国内外生物学、医学研究的热点之一。
HSCs活化的一个重要特征是胞浆内脂滴的消失。现有针对脂肪细胞的研究提示脂肪特异性蛋白27(fat-specific protein 27,Fsp27)是脂肪细胞胞浆内脂滴形成的一个重要蛋白,其基因在肝脏中是过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的直接靶基因,脂肪细胞储脂功能的实现主要通过Fsp27而实现[5]。另外有研究通过导入外源基因PPARγ在HSCs中表达,显示PPARγ可使HSCs由活化态向静止态转变。在本研究中,我们增强Fsp27在活化HSCs中的表达,以了解Fsp27能否对HSCs活化增殖过程产生影响。
材 料 和 方 法
1材料及试剂
健康6周龄雄性SD大鼠10只,体重200~300 g,供分离原代HSCs,由温州医学院实验动物中心提供;L-DMEM培养基,购自HyClone;小牛血清购自Gibco;Ⅳ型胶原酶、DNaseⅠ购自Sigma;OptiPrep分离液购自Axis Shield;6孔塑料培养板购自Millipore;鼠抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体购自Southern-Biotech;AEC试剂盒购自博士德生物公司。RNA Trizol试剂盒购自Invitrogen。
2方法
2.1HSCs的分离、培养 使用本实验室前期建立的方法,即胶原酶原位灌注及密度梯度离心技术从大鼠分离提取原代HSCs。原代细胞经形态学及免疫细胞化学法鉴定(原代HSCs活化后表达α-SMA),HSCs纯度可达95%。将细胞接种于培养瓶中, 37 ℃、5% CO2、饱和湿度的培养箱中常规培养。培养液为含10%小牛血清的L-DMEM,根据细胞生长情况,每2~3 d换液1次。
2.2实时荧光定量PCR 按TRIzol试剂盒说明书提取总RNA,测定RNA的浓度及纯度,逆转录反应条件参照试剂盒说明,PCR反应条件为95 ℃变性15 s后,按95 ℃ 5 s变性,60 ℃ 30 s退火,共45个循环。Fsp27上游引物5’-CCTCTATGACACATACTCGCTTTC-3’,下游引物5’-TGTTCTTCCTCAGTGGCATCC-3’,产物长度168 bp。GAPDH上游引物5’-GAGGACCAGGTTGTCTCCTG-3’,下游引物5’-GGATGGAATTGTGAGGGAGA -3’, 产物长度215 bp。
2.3Western blotting 在原代HSCs及活化HSCs中分别加入现配的细胞裂解液,冰上裂解30 min,于4 ℃、12 000 r/min离心15 min,取上清进行蛋白定量。取一定量蛋白样品上样。SDS-PAGE分离,转移至PVDF膜,封闭缓冲液室温摇床振荡1 h,加入I抗体α-SMA (1∶100),4 ℃过夜,TBST漂洗3次,每次10 min,孵育II抗(1∶30 000),37 ℃恒温振摇1 h;TBST漂洗3次,每次10 min,化学发光,显影、定影,对胶片图像扫描,用凝胶图像处理系统Gel-Pro Analyzer分析目标带的灰度值。
2.4免疫荧光染色 原代细胞爬片48 h后PBS漂洗,4%多聚甲醛4 ℃固定过夜;PBS漂洗3次后0.1%Triton X-100处理15 min;PBS漂洗,10%山羊血清封片20 min;于4 ℃标记I抗过夜,次日PBS漂洗并室温标记II抗1 h,然后漂洗、封片,上机观测。
2.5携带Fsp27基因的慢病毒载体的构建及细胞感染 构建的重组体慢病毒(pLV-Fsp27)包含鼠Fsp27基因及GFP基因,该病毒的滴定度测定为2.00×1011TU/L。病毒被储存在-80 ℃,病毒增殖分离在293T细胞中进行。慢病毒感染后的HSCs进行下游检测时状态良好。
根据实验设计,以下细胞实验均在细胞株HSC-T6中进行。在不同感染复数(multiplicity of infection, MOI)下进行慢病毒感染。HSCs培养于6孔板中,密度为5×104cells/well,每孔以MOI=0、20和40转染重组体慢病毒(pLV-Fsp27)或空载病毒(pLV-GFP)。感染72 h后根据GFP的表达情况及Fsp27 mRNA的检测,测算感染效率。
2.6目标基因转染后对细胞表型及细胞增殖的影响 根据实验设计分为空白对照组(无病毒转染)、阴性对照组(转染pLV-GFP)及阳性对照组(转染pLV-Fsp27),每组设5个复孔。按前述方法将带目标基因的慢病毒转染HSCs后继续培养24 h、48 h和72 h,光学显微镜下观察细胞表型的变化。每孔加入CCK-8溶液80 μL,继续培养2 h,用自动酶标仪于450 nm处检测每孔的吸光度(A),根据公式[增殖抑制率(%)=(1-实验组A值/空白对照组A值)×100%]计算阴性对照组及阳性对照组的增殖抑制率。
2.7目标基因转染后对细胞活化的影响 将带目标基因的慢病毒转染活化HSCs,观察HSCs α-SMA表达的变化。慢病毒转染HSCs后继续培养72 h,按前述方法提取蛋白,采用Western blotting测定α-SMA的表达情况。
2.8目标基因转染后对HSCs的纤维化相关蛋白表达的影响 带目标基因的慢病毒转染细胞后继续培养72 h,设计大鼠基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)、金属蛋白酶组织抑制物1(tissue inhibitor of metalloproteinase 1, TIMP-1)、转化生长因子β1(transforming growth factor β1,TGF-β1)及内参照GAPDH的引物,利用实时荧光定量PCR技术,分别测定各组细胞中上述蛋白的mRNA表达情况。具体如下:MMP-2上游引物5’-CCCCTATCTACACCTACACCAA-3’,下游引物5’-CACCACGGATCTGAGCAAT-3’,扩展片段长192 bp; TIMP-1上游引物5’-CCTCTGGCATCCTCTTGTTG-3’,下游引物5’-CGCTGGTATAAGGTGGTCTC-3’,扩增片段长157 bp;TGF-β1上游引物5’-GAGGCGGTGCTCGCTTTGT-3’,下游引物5’-CGGGTGACTTCTTTGGCGTAG-3’,扩增片段长107 bp;GAPDH上游引物5’-GAGGACCAGGTTGTCTCCTG-3’,下游引物5’-GGATGGAATTGTGAGGGAGA-3’,扩增片段长215 bp。反应条件:94 ℃ 5 min预变性,扩增40个循环,每个循环包括:94 ℃ 30 s,56 ℃(MMP-2和TIMP-1为52.1 ℃)30 s,72 ℃ 45 s。
3统计学处理
采用SPSS 13.0统计软件处理,数据以均数±标准差(mean±SD)表示,两样本均数间比较用t检验。多个样本均数间的比较用方差分析,以P<0.05为差异有统计学意义。
结 果
1HSCs的分离、培养和形态学特点
每只大鼠HSCs的获得率约为(1~2)×107,台盼蓝染色存活细胞>95%。相差显微镜下,刚分离出来的HSCs呈圆球形,胞浆内含较多脂肪小滴,在328 nm波长的激发光下,荧光显微镜可观察到蓝绿色荧光的脂滴。培养2~3 d后,细胞贴壁;5~8 d后,细胞伸展呈星形。10 d后HSCs几乎全部活化(胞浆内可见棕色的α-SMA),见图1。

Figure 1. Identification of hepatic stellate cells (HSCs). A: primary HSCs at 2 d (×1 000); B: primary HSCs at 3 d (×100); C: activated HSCs (α-SMA immunocytochemical staining,×300).
图1肝星状细胞的鉴定
2Fsp27在原代及活化HSCs中的表达
Fsp27蛋白主要表达于细胞胞浆脂滴包膜,在原代HSCs中无论mRNA水平还是蛋白质水平均为显著表达,而在活化的HSCs中Fsp27则几乎不表达,两者差异显著(P<0.01),见图2。
3携带Fsp27基因的慢病毒转染HSCs结果
成功构建携带Fsp27基因的慢病毒(pLV-Fsp27)。HSCs经慢病毒感染后,在显微镜下可见绿色荧光,显微镜下荧光观察感染效率达到80%以上。pLV-Fsp27组中该Fsp27 mRNA强表达,而在空白对照组和pLV-GFP组中几乎不表达(P<0.01),见图3。

Figure 2. Expression of Fsp27 mRNA and protein in primary HSCs and activated HSCs. A: expression of Fsp27 protein in HSCs (immunofluorescence staining, ×200);B: Fsp27 mRNA expression in HSCs detected by real-time fluorescence quantitative PCR; C: expression of Fsp27 protein in HSCs detected by Western blotting. Mean±SD.n=6.**P<0.01vsactivated HSCs.
图2原代及活化HSCs中Fsp27的表达
4Fsp27抑制HSCs增殖并引起HSCs表型的变化
光学显微镜下观察,与空白对照组和pLV-GFP组比较,pLV-Fsp27组细胞形态变小,胞浆变少,树突状胞突变短,形态更接近于原代HSCs。与pLV-GFP组相比,病毒转染48 h和72 h后,pLV-Fsp27组HSCs增殖活性受抑制明显,且与病毒剂量相关(P<0.05)。在MOI=40时,随着时间推移,与pLV-GFP组相比,pLV-Fsp27组HSCs的增殖抑制率显著增大(P<0.05),见图4。
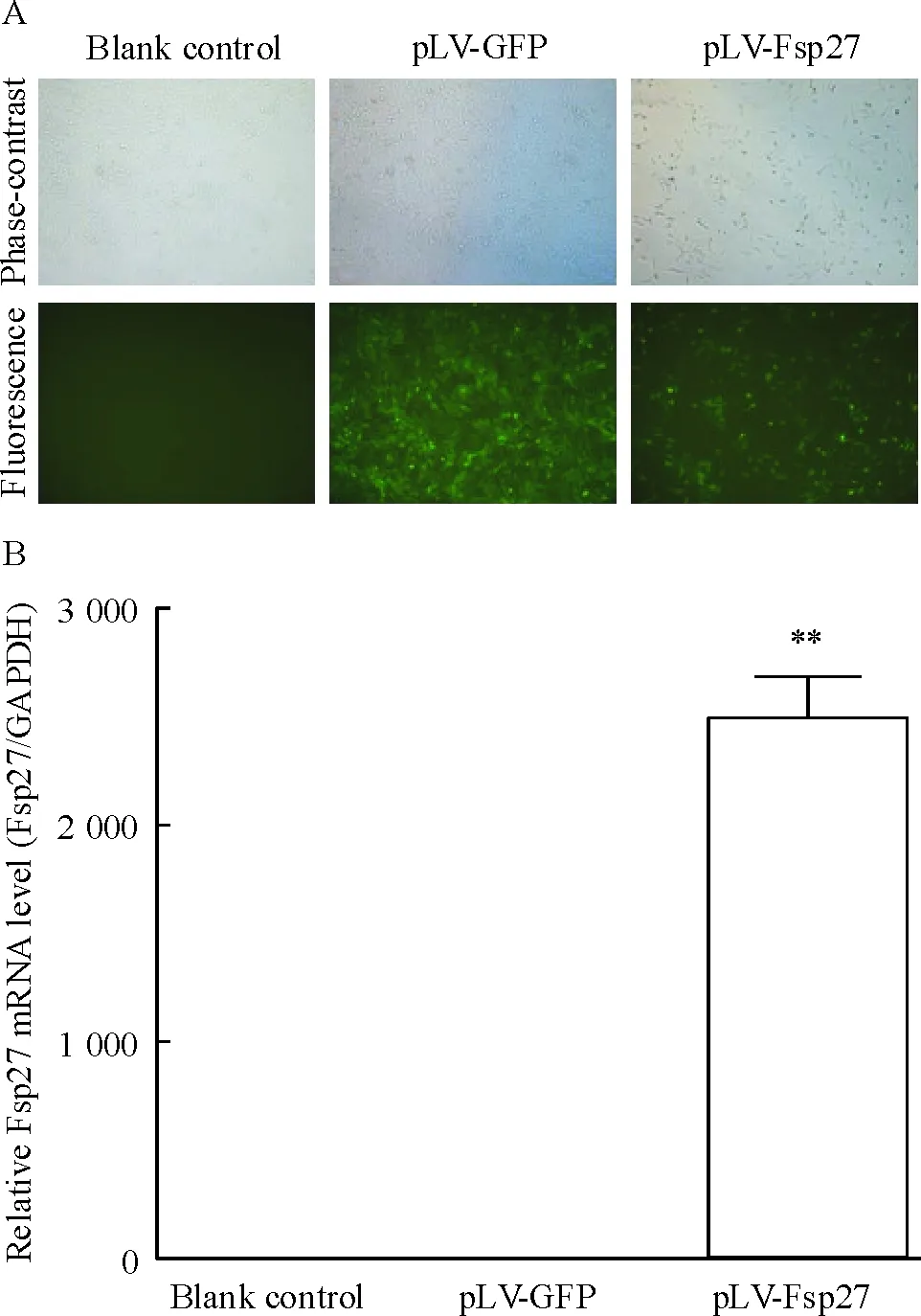
Figure 3. Infection efficiency and Fsp27 mRNA expression in activated HSCs after lentivirus infection. A: cell morphology and GFP expression observed under phase-contrast microscope and fluorescence microscope, respectively (×200); B: expression of Fsp27 mRNA detected by real-time fluorescence quantitative PCR. Mean±SD.n=6.**P<0.01vsblank control or pLV-GFP.
图3活化HSCs感染慢病毒后的感染效率和Fsp27mRNA表达
5Fsp27抑制HSCsα-SMA的表达
与空白对照组和pLV-GFP组比较,pLV-Fsp27组HSCs内α-SMA表达水平明显下降(P<0.05)。而pLV-GFP组与空白对照组中HSCs的α-SMA的表达则无显著差异(P>0.05),见图5。
6Fsp27调节了肝纤维化相关蛋白的mRNA表达
与空白对照组和pLV-GFP组比较,pLV-Fsp27组中抗纤维化的MMP-2 mRNA表达升高,促纤维化的TIMP-1及TGF-β1mRNA表达降低,差异均有统计学意义(P<0.05),见图6。
讨 论
我国是肝炎高发国家,肝炎继续发展形成肝硬化,由肝硬化导致的肝功能衰竭或肝癌是导致患者死亡的主要原因,现已成为影响人民健康的重要因素。因此,阻断或延缓肝纤维化的发展是目前治疗肝硬化的关键。有研究显示肝纤维化是一个可逆转的疾病,是治疗肝硬化的一个重要靶点[1-4,6]。
HSCs属于肝脏的间质细胞,它在肝脏中的生理功能主要为参与维生素A 的代谢,储存脂肪,为肝细胞提供能源。在病理条件下如肝脏受到外源性刺激时,HSCs增殖并激活,激活的HSCs一方面通过增生和分泌细胞外基质参与肝纤维化的形成和肝内结构的重建,对肝纤维化的形成起着至关重要的作用,另一方面通过细胞收缩使肝窦内升高,门静脉血液回流受阻,肝脏缺血缺氧加重,又进一步促进肝损伤和肝硬化的发展。由此可见,HSCs的持续激活是肝纤维化发生发展过程中的关键环节[1-4]。
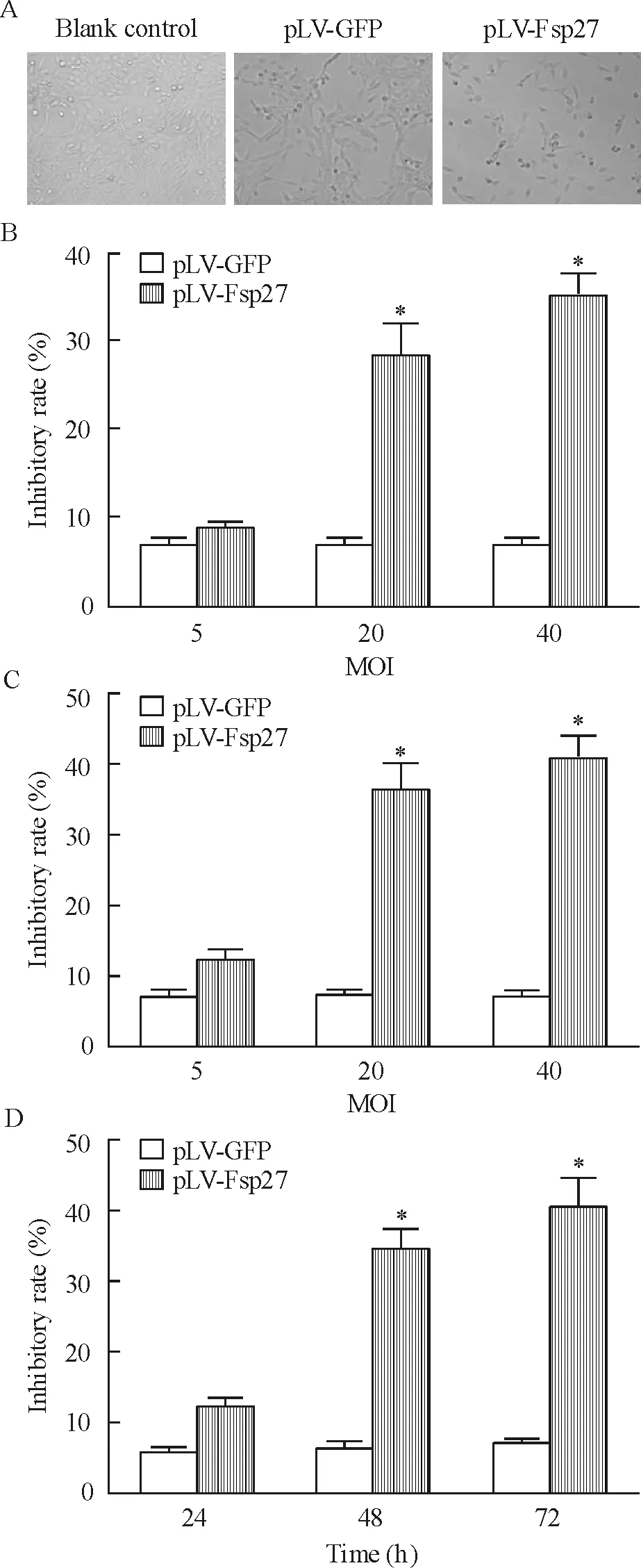
Figure 4. Changes of the morphology and proliferation of activated HSCs after pLV-Fsp27 infection. A: cell morpho-logy observed under phase-contrast microscope (×200); B~D: cell viability detected by CCK-8 assay, including 48 h after infection at different MOI (B), 72 h after infection at different MOI (C) and different time after infection at MOI=40 (D). Mean±SD.n=6.*P<0.05vspLV-GFP.
图4活化HSCs感染pLV-Fsp27后形态与增殖的变化
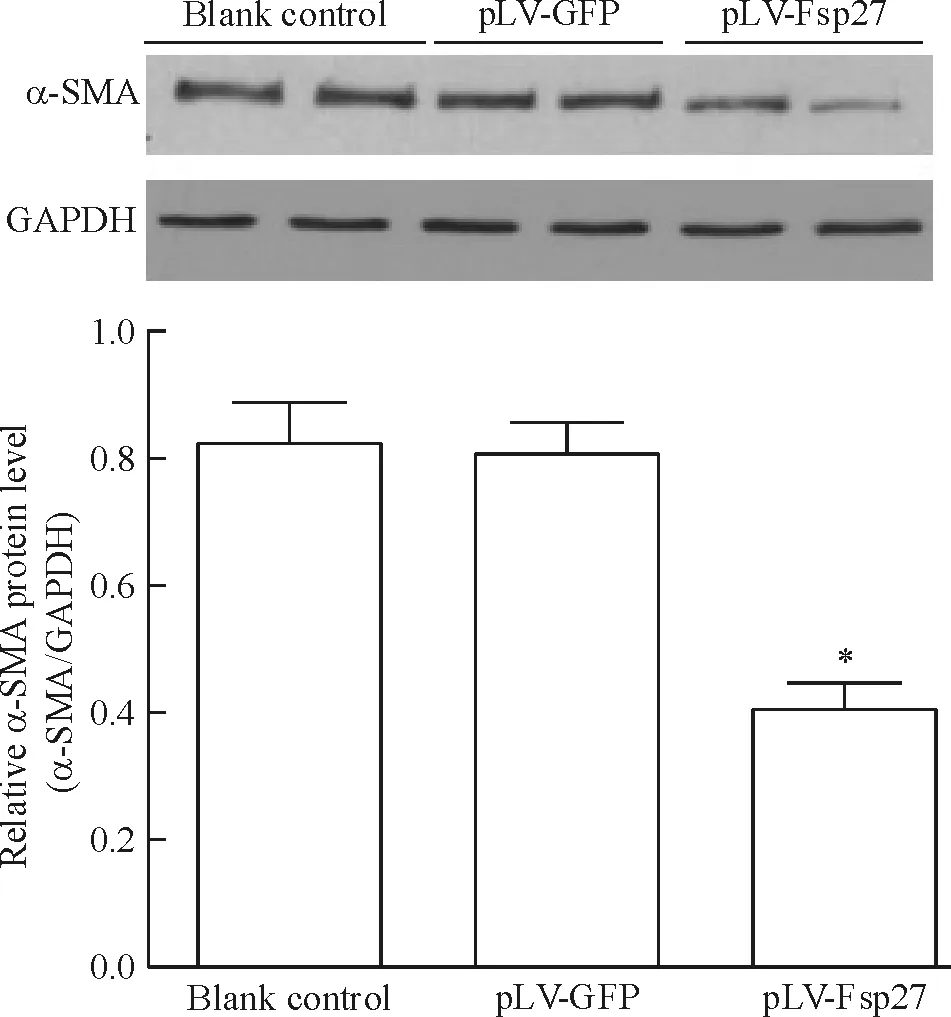
Figure 5. Effect of Fsp27 on α-SMA expression in activated HSCs. Mean±SD.n=3.*P<0.05vsblank control or pLV-GFP.
图5活化HSCs感染pLV-Fsp27后α-SMA表达的变化

Figure 6. Effects of Fsp27 on MMP-2,TGF-β1and TIMP-1 mRMA expression in activated HSCs. Mean±SD.n=6.*P<0.05vsblank control or pLV-GFP.
图6活化HSCs感染pLV-Fsp27后MMP-2、TGF-β1和TIMP-1mRMA表达的变化
PPARγ是维持HSCs静息状态的重要细胞因子,在原代HSCs中高表达,而在活化的HSCs中低表达,甚至不表达。通过外源性增加HSCs中PPARγ的激动剂或病毒转染外源基因使PPARγ高表达,发现PPARγ不仅能显著抑制活化HSCs的活化与增殖,而且能有效抑制活化后HSCs的致炎因子及胶原纤维的分泌,从而能逆转活体肝纤维化进程[6-11]。
虽然HSCs中PPARγ的功能研究报道较多,但其具体作用机制尚不十分明晰。诱导细胞死亡的DFF45样效应因子(cell death-inducing DFF45-like effectors,CIDE)家族是近几年发现的与细胞凋亡相关的一组新蛋白,在细胞凋亡、脂肪和能量代谢方面具有明显的作用[12]。Fsp27是CIDE家族蛋白中的一员,在成熟脂肪细胞特异表达,其在脂肪组织的分化和形成过程中可能具有重要的作用。Fsp27是一种脂肪液滴结合蛋白,并且会促进脂肪细胞中脂类物质的堆积,其基因是PPARγ的直接靶基因[5-6]。HSCs是肝脏中的储脂细胞,本研究发现Fsp27在原代HSCs高表达,而在活化HSCs中几乎不表达。通过Fsp27特异性抗体免疫荧光染色还发现,该蛋白特异性表达于脂肪滴包膜,对HSCs胞浆中脂滴的形成与维持可能具有重要作用。
我们通过慢病毒载体感染技术,使Fsp27在活化HSCs中得以表达。与对照组比较,Fsp27明显抑制HSCs增殖,同时也抑制了HSCs的活化,还促进了抗纤维化蛋白MMP-2的mRNA表达,降低了促纤维化蛋白TIMP-1及TGF-β1的mRNA表达。由此可见,Fsp27可能也是维持HSCs静息状态细胞表型及生物活性的重要调控因子之一,有望成为抗肝纤维化治疗的靶点之一。
总之,目前初步的研究成果显示,Fsp27可抑制HSCs活化、增殖,促进了抗纤维化蛋白 MMP-2的表达。但是Fsp27在HSCs中的具体作用通路及PPARγ对HSCs的作用是否是通过Fsp27途径等问题目前国内外研究报道甚少,有待进一步深入研究。
[1] Friedman SL. Hepatic stellate cells: protean, multifunctional and enigmatic cells of the liver[J]. Physiol Rev, 2008, 88(1): 125-172.
[2] Roderfeld M, Weiskirchen R, Wagner S, et al.Inhibition of hepatic fibrogenesis by matrix metalloproteinase-9 mutants in mice[J].FASEB J, 2006, 20(3): 444-454.
[3] 高俊茶, 王 妍, 姜慧卿. 索拉非尼抑制人肝星状细胞胶原合成[J]. 中国病理生理杂志, 2012, 28(1) :85-89.
[4] 郭 剑, 刘小娟, 张国尊, 等. 腺病毒介导的 shRNA 下调 PTEN 表达对体外活化肝星状细胞增殖与凋亡的影响[J]. 中国病理生理杂志, 2012, 28(9):1627-1632.
[5] Matsusue K, Kusakabe T,Noguchi T, et al. Hepatic steatosis in leptin-deficient mice is promoted by the PPARγ target geneFsp27[J]. Cell Metab, 2008, 7(4): 302-311.
[6] Yu J,Zhang S,Chu ES, et al. Peroxisome proliferator-activated receptors gamma reverses hepatic nutritional fibrosis in mice and suppresses activation of hepatic stellate cellsinvitro[J]. Int J Biochem Cell Biol, 2010, 42(6): 948-957.
[7] Galli A, Crabb D, Ceni E, et al. Peroxisome proliferator-activated receptor γ transcriptional regulation is involved in platelet-derived growth factor-induced proliferation in human hepatic stellate cells[J]. Hepatology, 2000, 31(1): 101-108
[8] Hazra S, Miyahara T, Rippe RA, et al. PPAR gamma and hepatic stellate cells[J]. Comp Hepatol, 2004, 3(Suppl 1): S7.
[9] 郭晏同, 赵景明, 冷希圣, 等. 罗格列酮抑制体外大鼠肝星状细胞活化[J]. 基础医学与临床, 2008, 28(11): 1129-1133.
[10] Nakajima A, Wada K, Miki H, et al. Endogenous PPAR gamma mediates anti-inflammatory activity in murine ischemia-reperfusion injury[J]. Gastroenterology, 2001, 120(2): 460-469.
[11] Lee JI,Paik YH,Lee KS, et al. A peroxisome-proliferator activated receptor-γ ligand could regulate the expression of leptin receptor on human hepatic stellate cells[J]. Histochem Cell Biol, 2007, 127(5): 495-502.
[12] Zhou Z, Toh SY, Chen Z, et al. Cidea-deficient mice have lean phenotype and are resistant to obesity[J]. Nat Genet, 2003, 35(1): 49-56.
Effectoffat-specificprotein27onactivationofrathepaticstellatecellsinvitro
YU Fu-xiang, SONG Cai-xin, WU Zhi-wei, ZHANG Qi-yu
(DepartmentofHepatobiliaryandPancreaticSurgery,theFirstAffiliatedHospital,WenzhouMedicalCollege,Wenzhou325000,China.E-mail:yfxbmu@163.com)
AIM: To investigate the effects of fat-specific protein 27 (Fsp27) on the proliferation and activation of hepatic stellate cells (HSCs)invitro.METHODSHSCs were isolated from the liver of SD rats. The mRNA and protein expression of Fsp27 in primary HSCs and activated HSCs was detected by real-time fluorescence quantitative PCR, immunofluorescence staining and Western blotting. After 72 h of transfection withFsp27-carrying lentivirus (pLV-Fsp27), the proliferation of HSCs was tested by CCK-8 assay, the protein expression of α-smooth muscle actin (α-SMA) in HSCs was detected by Western blotting, and the mRNA expression of fibrosis-related proteins, including matrix metalloproteinase 2 (MMP-2), tissue inhibitor of metalloproteinase 1 (TIMP-1) and transforming growth factor beta 1 (TGF-β1), was determined by real-time fluorescence quantitative PCR.RESULTSRat HSCs were successfully isolated and cultured. The difference of Fsp27 expression between primary HSCs and activated HSCs was significant (P<0.01). The proliferation and activation of HSCs was inhibited 72 h after pLV-Fsp27 transfection (P<0.05). Fsp27 enhanced the mRNA expression of MMP-2 and down-regulate the mRNA expression of TIMP-1 and TGF-β1in activated HSCs (P<0.05).CONCLUSIONFsp27 inhibits the proliferation and activation of HSCs and regulates the expression of fibrosis-related proteins. Fsp27 may play an important role in maintenance of the quiescent phenotype of HSCs.
Fat-specific protein 27; Hepatic stellate cells; Activation
R363
A
1000- 4718(2013)09- 1597- 06
2013- 03- 13
2013- 07- 02
温州市科技计划项目(No.Y20120191);浙江省重中之重外科学组资助(No.浙教高科2008-255)
△通讯作者 Tel: 0577-55579453; E-mail: yfxbmu@163.com
10.3969/j.issn.1000- 4718.2013.09.010
