细胞外HSP70/HSP70-PCs对人肝癌HepG2细胞上皮-间充质转化的影响及机制研究*
2013-10-24李航宇孙宏治刘金钢
李航宇, 李 岩, 刘 丹, 孙宏治, 刘金钢△
(1中国医科大学附属盛京医院普通外科,辽宁 沈阳 110004; 2辽宁医学院附属第一医院普通外科,辽宁 锦州 121001)
细胞外HSP70/HSP70-PCs对人肝癌HepG2细胞上皮-间充质转化的影响及机制研究*
李航宇1, 李 岩1, 刘 丹1, 孙宏治2, 刘金钢1△
(1中国医科大学附属盛京医院普通外科,辽宁 沈阳 110004;2辽宁医学院附属第一医院普通外科,辽宁 锦州 121001)
目的探讨细胞外热休克蛋白70(HSP70)/HSP70肽复合物(HSP70-PCs)对肝癌细胞上皮-间充质转化(EMT)的影响和可能机制。方法将HepG2细胞分为3组:正常对照组、HSP70/HSP70-PCs组(终浓度2 mg/L)和LY294002+HSP70/HSP70-PCs组。应用real-time RT-PCR与Western blotting法检测上皮细胞表面标志E-cadherin和间质细胞表面标志α-平滑肌肌动蛋白(α-SMA)的表达变化,以及磷脂酰肌醇3-激酶(PI3K)和缺氧诱导因子1α(HIF1-α)的表达变化。结果细胞外HSP70/HSP70-PCs可以促进HepG2细胞EMT的发生。HepG2细胞的EMT过程伴随HIF-1α和PI3K表达增加。应用LY294002阻断PI3K后,HepG2细胞没有发生EMT,同时细胞外HSP70/HSP70-PCs上调HIF-1α表达的作用消失。结论细胞外HSP70/HSP70-PCs可以通过PI3K/HIF-1α促进肝癌细胞发生EMT。
上皮-间充质转化; HepG2细胞; 热休克蛋白70
在肝癌的发生、进展中存在上皮-间充质转化 (epithelial-mesenchymal transition,EMT) 现象,并且与肝癌的侵袭转移关系密切[1]。EMT是指上皮细胞向间充质细胞转化的复杂过程,在此过程中上皮细胞的极性消失、迁移和运动能力增强,同时伴有上皮细胞标志物的丢失和间充质细胞标志物的过度表达。EMT的重要标志是上皮细胞表型稳定物质表达缺失,如上皮型钙黏蛋白(E-cadherin),和(或)间充质细胞标志蛋白表达增加,如α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)[2]。热休克蛋白70(heat-shock protein 70,HSP70)是一组生物体内普遍存在、进化上高度保守的蛋白质家族,肿瘤细胞内诱导表达的热休克蛋白可以调控肿瘤的多种生物学行为[3]。近年的研究发现,HSP70不仅在细胞内发挥作用,细胞内HSP70及HSP70肽复合物(HSP70-peptide complexes,HSP70-PCs)可以通过多种方式被释放到细胞外[4]。进入肿瘤微环境的HSP70/HSP70-PCs发挥重要而复杂的作用,一方面可以活化免疫细胞参与肿瘤免疫杀伤,另一方面又可能调控肿瘤细胞的免疫逃逸[5]。更为引人注目的是细胞外HSP70/ HSP70-PCs可以直接作用于肿瘤细胞,调节肿瘤细胞的多种生物学行为[6]。但是目前关于细胞外HSP70/HSP70-PCs参与肿瘤细胞的EMT尚不明确。
缺氧诱导因子1α(hypoxia-inducible factor 1α, HIF-1α)是缺氧条件下存在于哺乳动物或人体内,介导细胞适应于缺氧微环境的转导调控因子,与多种肿瘤细胞的增殖和凋亡、肿瘤生长和转移相关[7]。目前关于HSP70与HIF-1α之间关系在肝癌中少有研究。磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)信号通路与肿瘤细胞凋亡、增殖、侵袭等密切相关并能调节HIF-1α蛋白介导肝癌的侵袭[8]。我们前期的研究显示细胞外HSP70-PCs能够活化肝癌细胞PI3K/Akt通路,那么细胞外HSP70/HSP70-PCs是否是通过PI3K/Akt通路调控HIF-1α蛋白介导肝癌细胞EMT的发生值得研究。本研究应用细胞外HSP70-PCs对肝癌细胞进行体外干预,探讨其对EMT机制的影响并为临床防治肝癌寻找治疗的靶点。
材 料 和 方 法
1材料
人肝癌细胞株HepG2来源于American Type Culture Collection (ATCC)。多克隆小鼠抗人E-cadherin抗体和多克隆小鼠抗人α-SMA抗体均购自Abcam;多克隆鼠抗人HIF-1α抗体和多克隆鼠抗人PI3K抗体购自Santa Cruz;HRP标记的羊抗鼠IgG和HRP标记的羊抗兔IgG购于武汉博士德生物有限公司; RNA提取试剂盒购自大连宝生物工程有限公司; RNA PCR Kit购自Promega;PI3K抑制剂LY294002购自Sigma。
2方法
2.1细胞外HSP70/HSP70-PCs的提取纯化 采用隋春阳等[6]的方法进行细胞外HSP70/HSP70-PCs的提取纯化,並用Western blotting法鉴定。
2.2实验分组 HepG2细胞在含有10%胎牛血清DMEM培养液中,37℃、5% CO2培养,2~3 d用0.25%胰酶消化传代。取对数生长期的细胞进行实验。细胞分3组:正常对照组、细胞外HSP70/HSP70-PCs(终浓度2 mg/L)组和LY294002+细胞外HSP70/HSP70-PCs处理组。各组于培养后的24 h检测。
2.3E-cadherin、α-SMA、PI3K与HIF-1α mRNA表达的检测 按说明书提取各组细胞总RNA,测定 RNA 浓度和纯度并根据总RNA 浓度按说明书逆转合成cDNA,共20 μL。引物序列由北京鼎国生物工程有限公司设计并合成,E-cadherin正向引物5’-CCGCCATCGCTTACA- 3’,反向引物5’-GGCACCTGACCCTTGTA-3’;α-SMA正向引物5’-CGGGACATCAAGGAGAAACT-3’;反向引物5’-CCATCAGGCAACTCGTAACTCT-3’;GAPDH正向引物5’-GGATTTGGTCGTATTGGG-3’;反向引物5’-TCGCTCCTGGAAGATGG-3’;HIF-1α正向引物5’-CTTCTGGATGCTGGTG-3’;反向引物5’-TCGGCTAGTTAGGGTAC-3’。反应条件:两步法,第1步: 95 ℃ 3 min;第2步:95 ℃ 10 s,60 ℃ 30 s,共40个循环。熔解曲线分析:以0.5 ℃/s变化速度从65 ℃到95 ℃每隔5 s计算1次荧光值。采用相对定量法,测定目的基因、校对基因及GAPDH的PCR产物的Ct值,代入公式 2-ΔΔCt×100%。实验重复5次。
2.4E-cadherin、α-SMA、PI3K与HIF-1α蛋白表达的检测 按分子克隆方法提取细胞总蛋白,经 Bradford法测定蛋白浓度;各组取 60~100 g 总蛋白进行 100 g/L SDS聚丙烯酰胺凝胶电泳,半干法转膜,丽春红染色标记,100 g/L脱脂奶粉于室温封闭2 h,50 g/L脱脂奶粉稀释I抗,4 ℃孵育过夜。TBST室温摇洗3次,10~15 min;50 mL/L脱脂奶粉稀释HRP标记的II抗,于室温孵育2 h,TBST摇洗3次,每次10~15 min;ECL显色。
3统计学处理
采用SPSS 13.0统计软件,数据用均数±标准差(mean±SD)表示,进行t检验或方差分析,以P<0.05为差异有统计学意义。
结 果
1细胞外HSP70/HSP70-PCs的纯化
细胞裂解液经伴刀豆球蛋白A(concanavalin A,Con A)-Sepharpse 4B层析后,分为Con A结合部分和不结合部分,不结合部分经电泳后在70 kD处有一淡染条带(图1A)。将Con A不结合部分进一步用DEAE柱进行分离,梯度盐洗脱,收集不同洗脱峰的蛋白,将收集的蛋白用特异性Western blotting法鉴定,证实该蛋白确实为HSP70(图1B)。

Figure 1. Purification and identification of extracellular HSP70/HSP70-PCs. A: SDS-PAGE analysis of the purified extracellular HSP70/HSP70-PCs. M:marker; 1:total protein; 2:after Con A separation; 3:after DEAE separation. B: HSP70 was confirmed by Western blotting.
图1Westernblotting检测细胞外HSP70/HSP70-PCs的表达
2细胞外HSP70/HSP70-PCs可以促进HepG2细胞EMT的发生
Real-time RT-PCR结果显示,HSP70-PCs处理组E-cadherin mRNA的表达显著降低,而间充质细胞的标志物α-SMA mRNA的表达显著升高,见图2。Western blotting结果显示,与对照组细胞相比,经过2 mg/L HSP70-PCs处理的HepG2细胞中上皮标志物 E-cadherin蛋白的表达显著降低,而间充质细胞的标志物α-SMA蛋白的表达显著升高,见图3。以上结果提示,经过HSP70-PCs处理后,HepG2细胞中上皮细胞标志物表达逐渐消失,而间充质细胞标志物表达逐渐增加,HepG2细胞已经发生 EMT。
3HepG2细胞的EMT过程伴随HIF-1α和PI3K表达增加
Real-time RT-PCR结果显示,经细胞外HSP70/HSP70-PCs处理发生EMT的HepG2细胞中HIF-1α与PI3K的mRNA 表达增加,显著高于对照组(P<0.05),见图4。Western blotting结果显示,经细胞外HSP70/HSP70-PCs处理发生EMT的HepG2细胞中HIF-1α与PI3K蛋白表达显著增加,显著高于对照组(P<0.05),见图5。
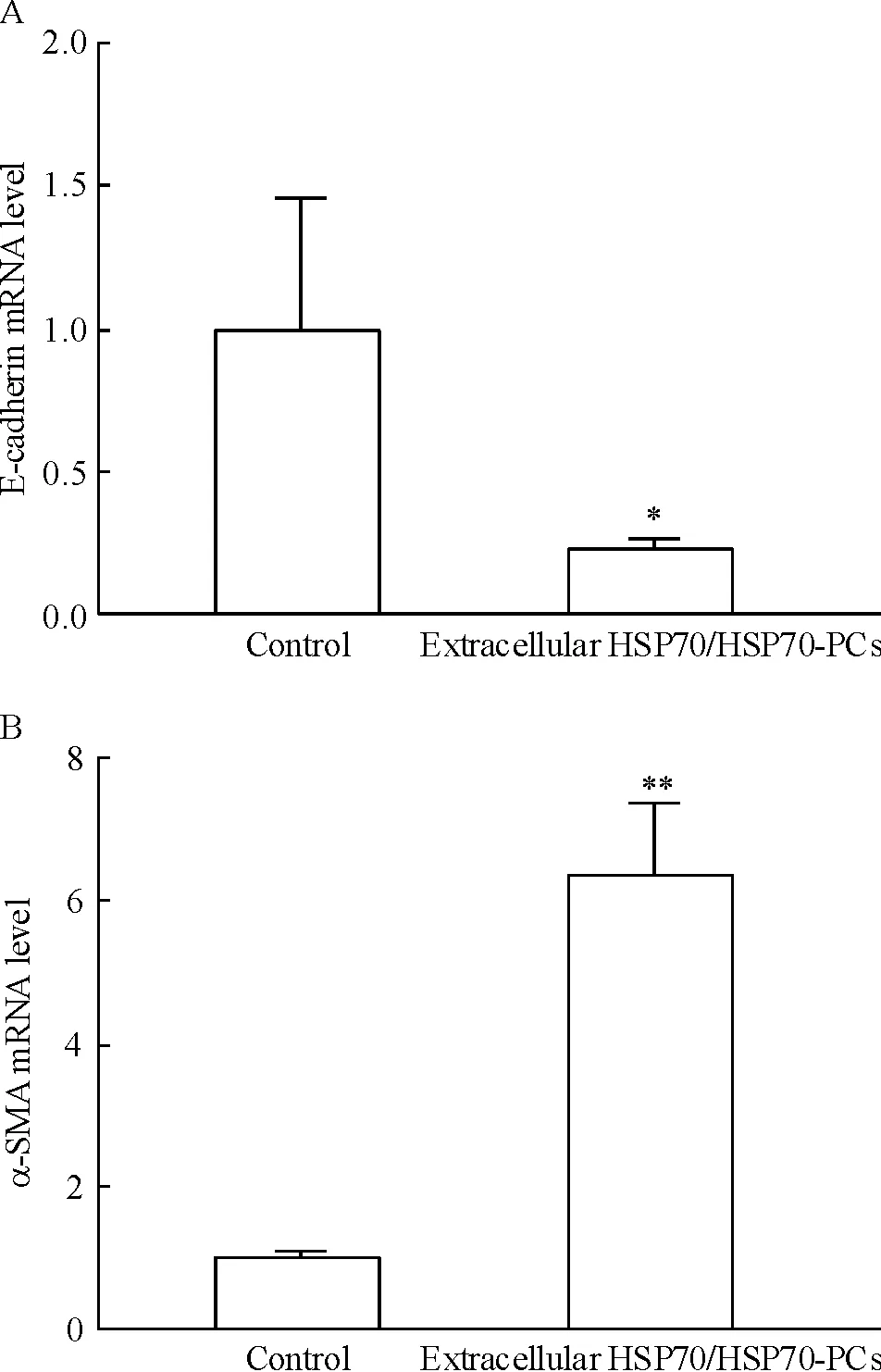
Figure 2. Effects of extracellular HSP70/HSP70-PCs on E-cadherin (A) and α-SMA (B) mRNA expression in HepG2 cells detected by real-time RT-PCR.Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图2细胞外HSP70/HSP70-PCs处理后HepG2细胞中E-cadherin及α-SMAmRNA的表达
4细胞外HSP70/HSP70-PCs通过PI3K调控HIF-1α表达影响HepG2细胞EMT过程
经过PI3K抑制剂LY294002预处理后的HepG2细胞,在细胞外HSP70/HSP70-PCs的作用下没有发生EMT。HSP70/HSP70-PCs下调E-cadherin蛋白表达和上调SMA蛋白表达的作用消失,与对照组相比,E-cadherin蛋白和SMA蛋白的表达均无明显变化。同时,应用LY294002特异性阻断PI3K后,HIF-1α蛋白的上调表达亦消失,见图6。此结果说明,细胞外HSP70/HSP70-PCs促进HepG2 EMT是通过PI3K和HIF-1α来实现的。而且,HIF-1α位于PI3K的下游,可以通过阻断PI3K抑制细胞外HSP70/HSP70-PCs对HIF-1α表达的影响。
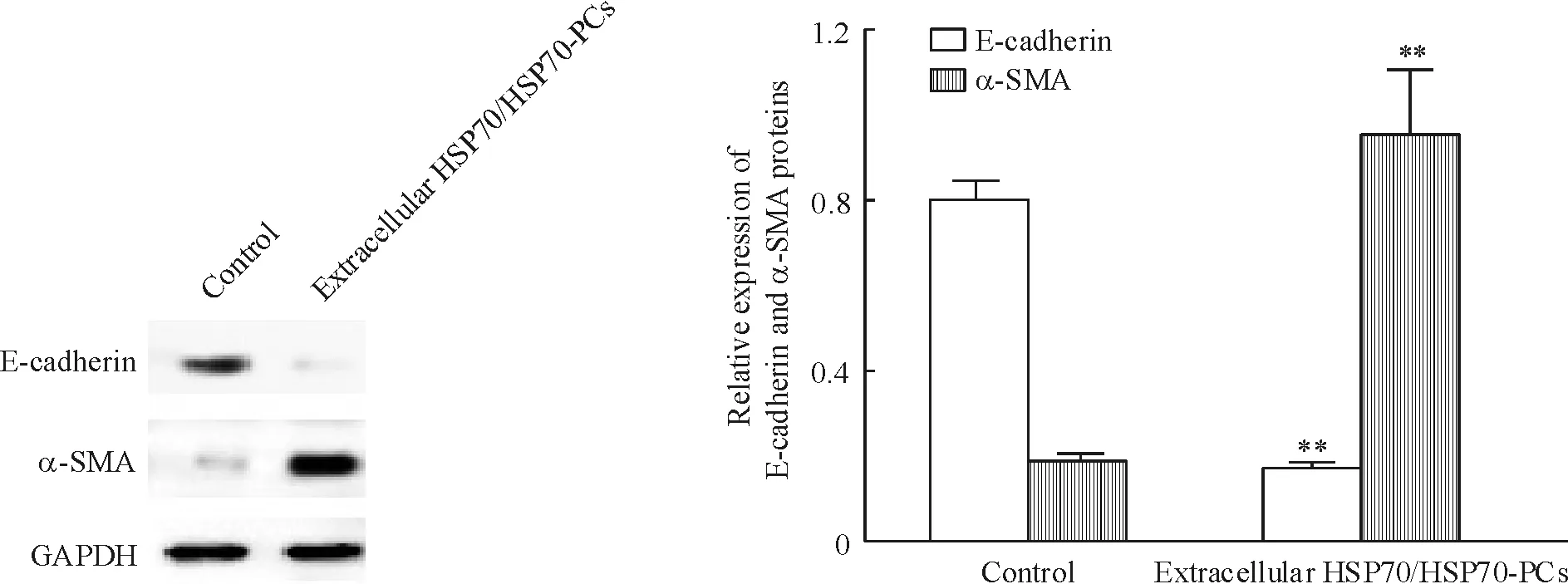
Figure 3. Effects of extracellular HSP70/HSP70-PCs on E-cadherin and α-SMA protein expression in HepG2 cells detected by Western blotting.Mean±SD.n=3.**P<0.01vscontrol group.
图3细胞外HSP70/HSP70-PCs处理后HepG2细胞中E-cadherin及α-SMA蛋白的表达
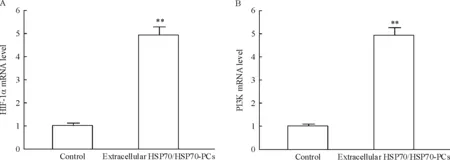
Figure 4. Effects of extracellular HSP70/HSP70-PCs on HIF-1α (A) and PI3K (B) mRNA expression in HepG2 cells.Mean±SD.n=3.**P<0.01vscontrol group.
图4细胞外HSP70/HSP70-PCs处理后HepG2细胞中HIF-1α和PI3KmRNA的表达
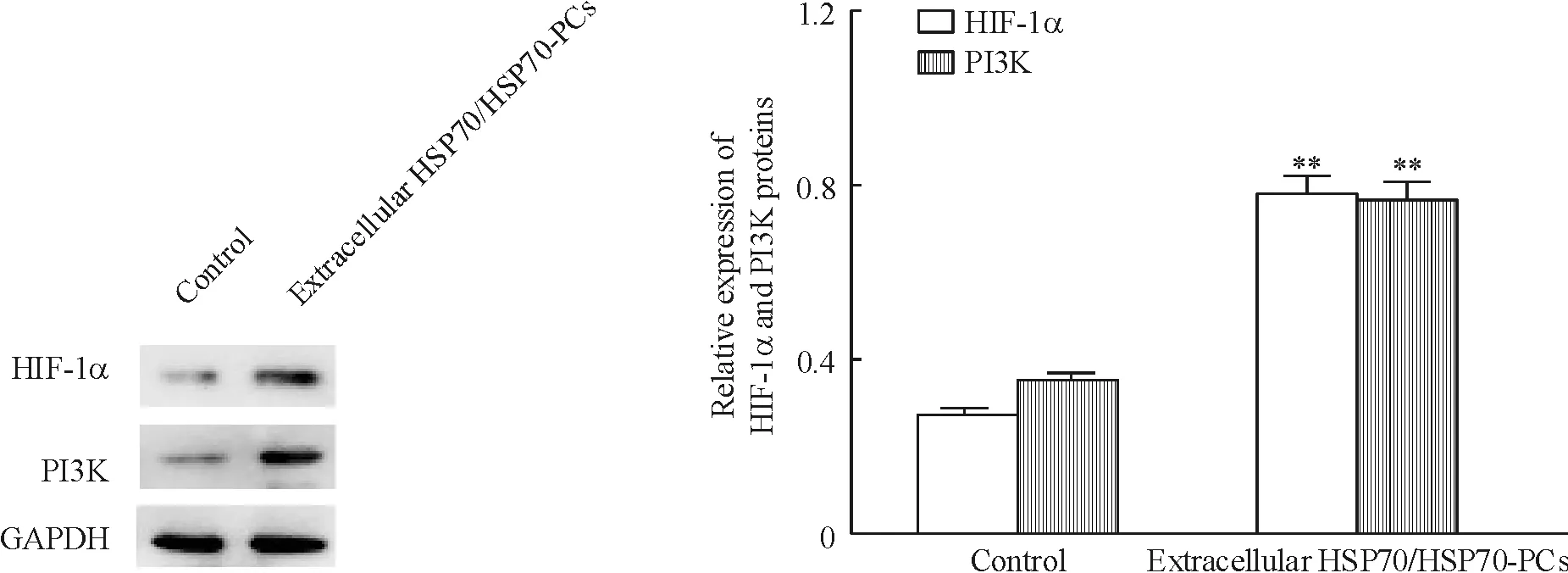
Figure 5. Effects of extracellular HSP70/HSP70-PCs on HIF-1α and PI3K protein expression in HepG2 cells detected by Western blotting.Mean±SD.n=3.**P<0.01vscontrol group.
图5细胞外HSP70/HSP70-PCs处理后HepG2细胞中HIF-1α和PI3K蛋白的表达
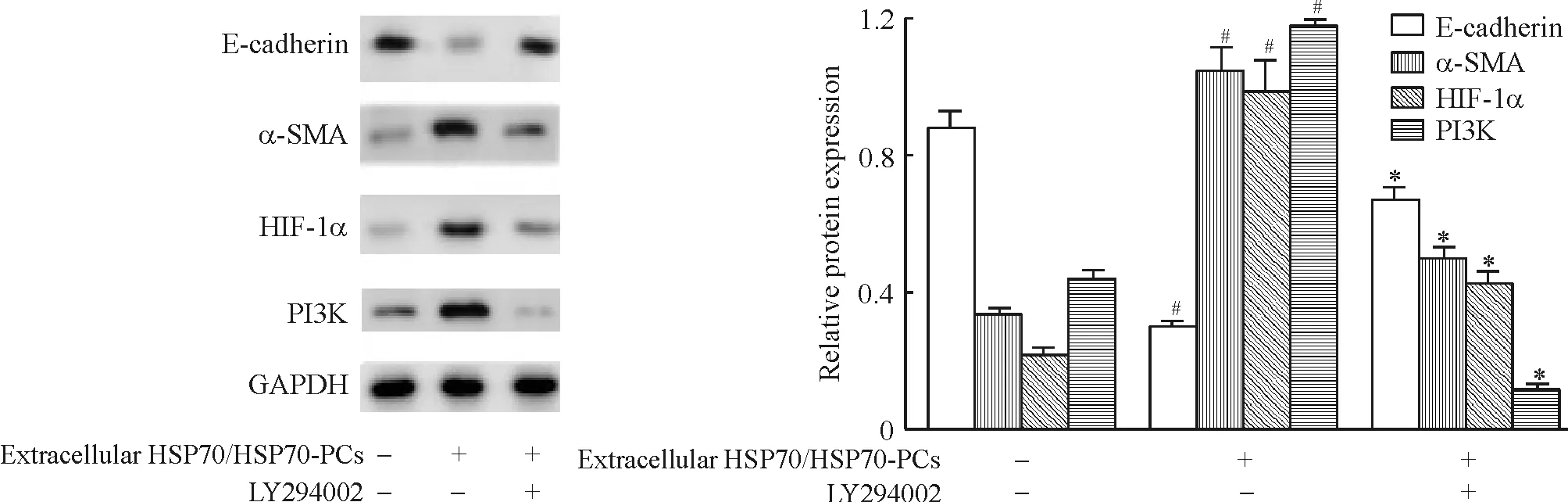
Figure 6. Effects of LY294002 on extracellular HSP70/HSP70-PCs-induced E-cadherin,α-SMA,HIF-1α and PI3K protein expression in HepG2 cells detected by Western blotting.Mean±SD.n=3.#P<0.05vscontrol (without treatment);*P<0.05vsHSP70/HSP70-PCs alone.
图6HSP70/HSP70-PCs处理与PI3K阻断后的HepG2细胞E-cadherin、α-SMA、HIF-1α和PI3K的表达
讨 论
恶性肿瘤的侵袭、转移和复发过程极其复杂,包括细胞黏附、细胞运动、细胞增生、细胞外基质降解、肿瘤血管生成、机体免疫等多个环节[9]。EMT系指上皮细胞在特定的生理和病理情况下向间充质细胞转化的现象,是肿瘤细胞获得侵袭和转移能力的分子基础[10]。肿瘤细胞经EMT 转化后,上皮表型E-cadherin表达下调或缺失是其重要标志,同时可引起间充质表型α-SMA表达的上调[11]。因此可以依靠检测这两类细胞表面特异性标记物来鉴定EMT的发生。
HSP70是在生物体内普遍存在的蛋白质家族。肿瘤组织中的HSP70/HSP70-PCs不仅存在于肿瘤细胞内,还可以通过胞吐、分泌和肿瘤细胞坏死裂解等方式释放到细胞外[12]。体外研究发现细胞外HSP70/HSP70-PCs在肿瘤进展的不同阶段发挥复杂而矛盾的作用。在肿瘤的早期阶段,细胞外HSP70/HSP70-PCs可以通过活化免疫抑制肿瘤的生长;在肿瘤的晚期,存在于肿瘤微环境中的HSP70/HSP70-PCs通过免疫抑制促进肿瘤的生长[13]。Walsh等[14]的研究发现细胞外HSP70/HSP70-PCs还能直接作用于肿瘤细胞调控其侵袭等生物学行为。目前尚未有文献明确报道细胞外HSP70/HSP70-PCs对肿瘤细胞的EMT有影响。为此,我们在肝癌细胞系HepG2的体外培养过程中加入从人肝癌组织标本中提取并纯化的HSP70/HSP70-PCs,观察HepG2细胞是否发生EMT。我们的实验发现,在细胞外HSP70/HSP70-PCs的刺激下, HepG2细胞的上皮细胞标志E-cadherin消失,间充质细胞标志α-SMA表达增加,使其获得间充质化表型。也就说肝癌细胞HepG2在细胞外HSP70/HSP70-PCs的诱导下会发生EMT。
细胞外HSP70/HSP70-PCs是通过何种方式调控肝癌细胞EMT发生的呢?通过检索文献,我们发现PI3K/AKT信号转导及其下游的HIF-1α可能参与其中。 PI3K/AKT信号转导通路广泛存在于细胞中,参与调节细胞生长、增殖、分化的信号转导通路[15]。PI3K/Akt信号通路可以感受肿瘤微环境中多种因素的刺激,调控肿瘤细胞生物学行为的变化,促进其增殖及侵袭力[8]。肿瘤病灶的一个主要特征是肿瘤细胞快速生长并伴缺氧微环境的形成[16]。在缺氧条件下,肿瘤细胞启动一系列缺氧适应性反应,其中就包括HIF-1相关的基因诱导[7]。HIF-1由α和β亚基组成,其中HIF-1α是受氧分子调节的主要功能亚基。人体肿瘤组织中HIF-1α高水平表达,表达程度与肿瘤的进展程度、转移和放/化疗抵抗力呈正相关。研究表明,HIF-1α高表达能引起卵巢癌、前列腺癌、胆囊癌、肝细胞癌等多种肿瘤细胞发生EMT特征的转变,提高其侵袭转移能力[17]。Krishnamachary 等[17]发现HIF-1α是肿瘤细胞EMT 的一个重要信号,HIF-1α高表达导致细胞发生E-cadherin等上皮标志丢失和α-SMA等充间质标志获得的EMT 改变。我们通过real-time RT-PCR与Western blotting证实,在细胞外HSP70/HSP70-PCs诱导HepG2 EMT的同时,PI3K与HIF-1α在mRNA和蛋白水平的表达明显上调,说明二者可能参与了细胞外HSP70/HSP70-PCs诱导HepG2 EMT的过程。进一步的阻断实验发现,PI3K抑制剂能有效阻断细胞外HSP70/HSP70-PCs诱导的HIF-1α蛋白的表达,并且EMT标志性蛋白分子变化发生逆转。该结果提示细胞外HSP70/HSP70-PCs诱导肝癌细胞EMT改变可能是通过PI3K调控HIF-1α发挥作用。
综上所述,细胞外HSP70/HSP70-PCs对肝癌的EMT起着重要作用,这种作用是通过PI3K/HIF-1α途径来实现的。本研究结果为肝癌侵袭的发病机制和防治研究提供了新的理论和实验依据。
[1] Lee TK, Poon RT, Yuen AP, et al. Twist overexpression correlates with hepatocellular carcinoma metastasis through induction of epithelial-mesenchymal transition [J]. Clin Cancer Res, 2006, 12(18): 5369-5376.
[2] Gheldof A, Berx G. Cadherins and epithelial-to-mesenchymal transition [J]. Prog Mol Biol Transl Sci, 2013, 116: 317-336.
[3] Rérole AL, Jego G, Garrido C. Hsp70: anti-apoptotic and tumorigenic protein [J]. Methods Mol Biol, 2011, 787: 205-230.
[4] Schmitt E, Gehrmann M, Brunet M, et al. Intracellular and extracellular functions of heat shock proteins: repercussions in cancer therapy [J]. J Leukoc Biol, 2007, 81(1): 15-27.
[5] Ge C, Xing Y, Wang Q, et al. Improved efficacy of therapeutic vaccination with dendritic cells pulsed with tumor cell lysate against hepatocellular carcinoma by introduction of 2 tandem repeats of microbial HSP70 peptide epitope 407-426 and OK-432 [J]. Int Immunopharmacol, 2011, 11(12): 2200-2207.
[6] 隋春阳, 李航宇, 胡 勇, 等. HSP70肿瘤肽复合物的纯化及其对肝癌细胞株HepG-2增殖的作用 [J]. 世界华人消化杂志, 2006, 14(18): 1775-1779.
[7] 赵志成, 庄 莉, 贾长库, 等. EGCG抑制肝癌细胞株HepG2增殖及HIF-1α/VEGF的表达[J]. 中国病理生理杂志, 2010, 26(4): 713-720.
[8] Jung KH, Choi MJ, Hong S, et al. HS-116, a novel phosphatidylinositol 3-kinase inhibitor induces apoptosis and suppresses angiogenesis of hepatocellular carcinoma through inhibition of the PI3K/AKT/mTOR pathway [J]. Cancer Lett, 2012, 316(2): 187-195.
[9] 余桂芳, 严跃红,王瑞鑫, 等. 不同缺氧状态对人肝癌HepG2细胞侵袭和转移能力的影响[J]. 中国病理生理杂志, 2012, 28(2): 281-286.
[10] Thiery JP, Acloque H, Huang RY, et al. Epithelial-mesenchymal transitions in development and disease [J]. Cell, 2009, 139(5): 871-890.
[11] Kalluri R, Neilson EG. Epithelial-mesenchymal transition and its implications for fibrosis [J]. J Clin Invest, 2003, 112(12): 1776-1784.
[12] Nirdé P, Derocq D, Maynadier M, et al. Heat shock cognate 70 protein secretion as a new growth arrest signal for cancer cells [J]. Oncogene, 2010, 29(1): 117-127.
[13] Wu FH, Yuan Y, Li D, et al. Extracellular HSPA1A promotes the growth of hepatocarcinoma by augmenting tumor cell proliferation and apoptosis-resistance [J]. Cancer Lett, 2012, 317(2): 157-164.
[14] Walsh N, Larkin A, Swan N, et al. RNAi knockdown of Hop (Hsp70/Hsp90 organising protein) decreases invasion via MMP-2 down regulation [J]. Cancer Lett, 2011, 306(2): 180-189.
[15] Prasad R, Vaid M, Katiyar SK. Grape proanthocyanidin inhibit pancreatic cancer cell growthinvitroandinvivothrough induction of apoptosis and by targeting the PI3K/Akt pathway [J]. PLoS One, 2012, 7(8): e43064.
[16] Swartz MA, Iida N, Roberts EW, et al. Tumor microenvironment complexity: emerging roles in cancer therapy [J]. Cancer Res, 2012, 72(10): 2473-2480.
[17] Krishnamachary B, Zagzag D, Nagasawa H, et al. Hypo-xia-inducible factor-1-dependent repression of E-cadherin in von Hippel-Lindau tumor suppressor-null renal cell carcinoma mediated by TCF3, ZFHX1A, and ZFHX1B [J]. Cancer Res, 2006, 66(5): 2725-2731.
EffectofextracellularHSP70/HSP70-PCsonepithelial-mesenchymaltransitionofhumanhepatocellularcarcinomaHepG2cells
LI Hang-yu1, LI Yan1, LIU Dan1, SUN Hong-zhi2, LIU Jin-gang1
(1DepartmentofGeneralSurgery,ShengjingHospitalAffiliatedtoChinaMedicalUniversity,Shenyang110004,China;2DepartmentofGeneralSurgery,theFirstHospitalAffiliatedtoLiaoningMedicalCollege,Jinzhou121001,China.E-mail:liujg@sj-hospital.org)
AIM: To investigate the effect of extracellular heat-shock protein 70 (HSP70)/HSP70-peptide complexes (HSP70-PCs) on epithelial-mesenchymal transition (EMT) of human hepatocellular carcinoma HepG2 cells and its probable mechanism.METHODSHepG2 cells were divided into 3 groups: control group, HSP70/HSP70-PCs (2 mg/L) group and LY294002+HSP70/HSP70-PCs group. The mRNA and protein expression of epithelial cell surface marker E-cadherin, mesenchymal cell surface marker α-smooth muscle actin (α-SMA), phosphatidylinositol 3-kinase (PI3K) and hypoxia-inducible factor 1α (HIF-1α) was examined by real-time RT-PCR and Western blotting.RESULTSExtracellular HSP70/HSP70-PCs promoted the initiation of EMT of HepG2 cells. The expression of HIF-1α and PI3K significantly increased in the process of EMT of HepG2 cells. After PI3K was blocked by LY294002, EMT did not occur and HIF-1α was not up-regulated in HepG2 cells.CONCLUSIONExtracellular HSP70/HSP70-PCs may promote EMT of hepatocellular carcinoma cells via PI3K/HIF-1α signaling pathway.
Epithelial-mesenchymal transition; HepG2 cells; Heat-shock protein 70
R735.7
A
1000- 4718(2013)09- 1631- 06
2013- 03- 27
2013- 06- 26
国家自然科学基金资助项目(No.81071955);辽宁省教育厅科技项目计划(No.L2010634)
△通讯作者Tel: 024-96615-31611; E-mail: liujg@sj-hospital.org
10.3969/j.issn.1000- 4718.2013.09.016
