hAFP及hTERT双启动子调控的针对人IGF-II基因的siRNA特异性抑制人肝癌细胞生长*
2013-10-24汤绍辉吴胜兰王旷靖张良鹏罗羽宏曹明溶周鸿科
汤绍辉, 吴胜兰, 王旷靖, 张良鹏, 罗羽宏, 曹明溶, 周鸿科
(暨南大学附属第一医院 1消化科, 2普通外科,广东 广州 510632)
hAFP及hTERT双启动子调控的针对人IGF-II基因的siRNA特异性抑制人肝癌细胞生长*
汤绍辉1, 吴胜兰1, 王旷靖1, 张良鹏1, 罗羽宏2△, 曹明溶2, 周鸿科1
(暨南大学附属第一医院1消化科,2普通外科,广东 广州 510632)
目的设计并筛选高效沉默胰岛素样生长因子II(IGF-II)基因的小干扰RNA(siRNA)序列,构建由重组人甲胎蛋白(hAFP)和人端粒酶逆转录酶(hTERT)双启动子调控的该siRNA表达载体,观察其对肝癌细胞生长的影响。方法根据siRNA设计原则,参照IGF-II mRNA序列设计3对siRNA序列及1对阴性对照序列,转染人肝癌Huh7细胞,转染24 h后采用实时荧光定量PCR检测IGF-II mRNA表达量变化,筛选干扰效率最高的siRNA序列。采用PCR扩增出hAFP及hTERT启动子的核心序列,应用基因重组技术构建重组hAFP和hTERT双启动子调控的该siRNA表达载体。将上述siRNA表达载体转染Huh7细胞及L-02人正常肝细胞,观察IGF-II mRNA表达及细胞生长情况变化。结果实时荧光定量PCR显示,siRNA3在25 nmol/L浓度时抑制效率最高,约90%。成功扩增hAFP及hTERT启动子核心序列,将其分别克隆入pGL3-Basic载体,构建成重组pGL3-hAFP-hTERT载体;将siRNA3克隆至pGL3-hAFP-hTERT载体,构建成重组pGL3-hAFP-hTERT-siRNA3表达载体。Huh7细胞IGF-II mRNA表达量显著降低,抑制效率达86%,细胞增殖受到明显抑制,G1期细胞比例显著增加;L-02细胞上述指标无明显改变。结论成功构建双重RNA聚合酶II启动子(hAFP及hTERT双启动子)调控的针对IGF-II基因的siRNA表达载体,即pGL3-hAFP-hTERT-siRNA3;该siRNA表达载体可特异性抑制IGF-II mRNA表达及肝癌细胞生长。
hAFP/hTERT双启动子; RNA干扰; 人胰岛素样生长因子II; 癌,肝细胞
RNA干扰(RNA interference,RNAi)是一种高效、特异沉默靶基因的新技术。其作用机制是通过双链RNA(double-stranded RNA, dsRNA)经外界导入细胞或细胞内合成后运输到胞浆中,被Dicer酶识别并加工成21~23 nt长度的小干扰RNA(small interfering RNA,siRNA),siRNA的反义链使同源mRNA降解,从而抑制靶基因表达[1]。目前制备siRNA的方法主要分为两类:体外合成法与表达载体法。构建siRNA表达载体是通过将siRNA对应的DNA双链克隆到驱动小发夹RNA表达所用的启动子下游而实现的。驱动这些启动子转录的酶有RNA聚合酶II(RNA polymerase II,Pol II)和RNA聚合酶III(Pol III),这些启动子分别被称为Pol II和Pol III启动子[2]。Pol III启动子可在几乎所有细胞中持续表达,无组织特异性,在肿瘤治疗中可能导致人体正常组织损伤;Pol II启动子,如人甲胎蛋白(human alpha-fetoprotein,hAFP)启动子和人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)启动子,则具有组织特异性[2],可使靶基因在特定的肿瘤组织中沉默[3]。
人胰岛素样生长因子II(insulin-like growth factor II,IGF-II)是一种由67个氨基酸残基组成的多肽。研究表明,IGF-II的过表达是目前己知的肝细胞癌变过程中发生最早的基因改变事件,对肝癌的发生发展具有重要影响[4-6]。那么,抑制IGF-II的过表达对肝细胞癌是否具有较好的治疗作用?目前国内外尚未见深入的研究报道。鉴于此,本研究拟构建双重RNA聚合酶II启动子(hAFP及hTERT双启动子)调控的针对IGF-II基因的siRNA表达载体,观察其对肝癌细胞生长的影响,为肝癌基因靶向治疗开辟新途径奠定基础。
材 料 和 方 法
1材料
pGL3-Basic 载体(图1)、Lipofectamine® RNAiMAXTM转染试剂和Wizard®基因组DNA 纯化试剂盒均为Promega产品,Trizol试剂为Invitrogen产品,T4 DNA连接酶为TaKaRa产品,DNA凝胶回收试剂盒为广州东盛生物科技有限公司产品,SYBR Green PCR Master Mix为Toyobo产品,人肝癌细胞株Huh7和人正常肝细胞株L-02购自武汉大学中国典型培养物保藏中心。

Figure 1. Structure of pGL3-Basic vector.
图1pGL3-Basic载体结构图
2方法
2.1针对IGF-II基因的siRNA设计与筛选 根据siRNA设计原则,参照IGF-II mRNA序列(GenBank数据库:NM_000612)设计并合成3对siRNA序列(siRNA1、siRNA2和siRNA3)及1对无任何靶基因的siRNA(NC siRNA)作为阴性对照。培养Huh7细胞至汇合度为30%~50%,采用Lipofectamine® RNAiMAXTM转染试剂进行细胞转染siRNA。实验分为4个组,即空白对照组(NC siRNA)和3个实验组(siRNA1、siRNA2和siRNA3),每组设置25 nmol/L、50 nmol/L和100 nmol/L siRNA浓度梯度。转染24 h后,按Trizol试剂盒说明抽提Huh7细胞总RNA,逆转录合成cDNA并进行实时荧光定量PCR扩增。IGF-II mRNA上游引物为5’-CTG GAG ACG TAC TGT GCT A-3’,下游为5’-GAC TGC TTC CAG GTG TCA T-3’,片段长度为128 bp;以18S rRNA为内参照。每个样本同时扩增3复管,并连续进行2次实验。采用相对定量法(2-ΔΔCt) 计算目的基因表达量。
2.2重组hAFP和hTERT双启动子调控的、针对IGF-II基因的siRNA表达载体构建
2.2.1pGL3-hAFP-hTERT载体构建 根据hAFP基因及hTERT基因启动子序列设计引物,从L-02细胞基因组中扩增hAFP及hTERT启动子核心片段(分别为269 bp及456 bp)。hAFP启动子上游引物为5’-cgg ggt acc TGA GGA GAA TAT TTG TTA TAT-3’(含KpnI位点),下游引物为5’-cta gct agc TGT TAT TGG CAG TGG TGG AAG-3’(含NheI位点);hTERT启动子上游引物为5’-cta gct agc TGG CCC CTC CCT CGG GTT ACC C-3’(含NheI位点),下游引物为5’-ccg ctc gag CAT CGC GGG GGT GCC GGG G-3’(含XhoI位点)。
取pGL3-Basic载体及hAFP启动子PCR产物分别行KpnI与NheI双酶切,将hAFP启动子插入pGL3-Basic载体多克隆位点KpnI与NheI之间构建成pGL3-hAFP载体。取pGL3-hAFP载体及hTERT启动子PCR产物分别行NheI与XhoI双酶切,将hTERT启动子插入pGL3-hAFP载体hAFP启动子下游构建成pGL3-hAFP-hTERT载体。上述重组载体送华大基因公司进行测序分析。

2.3重组hAFP和hTERT双启动子调控的siRNA对Huh7细胞IGF-II mRNA表达及细胞生长的影响2.3.1细胞转染及IGF-II mRNA表达分析 采用LipofectamineTM2000转染试剂将pGL3-hAFP-hTERT-siRNA3表达载体及阴性对照载体pGL3-hAFP-hTERT分别转染Huh7细胞及L-02细胞。实验中,每个共转染实验同时做3复孔,并连续进行2次实验。转染48 h后收集细胞,按Trizol试剂盒说明抽提细胞总RNA,检测IGF-II mRNA 表达水平,方法同前。
2.3.2MTS法检测细胞增殖 取上述各组转染细胞,计数,调整细胞浓度为1×108/L,分到96孔板,每孔100 μL。细胞贴壁后,收集各个时点的细胞(0 h、24 h、48 h和72 h),加入MTS,比例为1/10。孵育4 h后,酶标仪测定A490值。
2.3.3流式细胞仪检测细胞周期 转染48 h后每样离心收集1×106细胞,用PBS洗细胞2次,加入预冷70%乙醇,于4 ℃固定过夜。离心收集细胞,用PBS洗细胞1次,加入含50 mg/L溴化丙啶和100 mg/L RNase A的PBS,4 ℃避光孵育30 min,以标准程序用流式细胞仪检测。
3统计学处理
数据以均数±标准差(mean±SD)表示,组间均数比较采用One-way ANOVA,应用SPSS 13.0统计软件进行分析,以P<0.05为差异有统计学意义。
结 果
1针对IGF-II基因的siRNA设计与筛选结果
根据IGF-II mRNA序列,设计并合成了3对siRNA,即siRNA1、siRNA2及siRNA3,见表1,分别转染Huh7细胞。转染24 h后,采用实时荧光定量PCR检测Huh7细胞IGF-II mRNA表达量变化。结果显示,转染siRNA1、siRNA2和siRNA3的Huh7细胞中IGF-II mRNA表达量均有不同程度的降低,抑制效率约为65%~90%,其中siRNA3在25 nmol/L浓度时抑制效率最高,达90%,见图2。
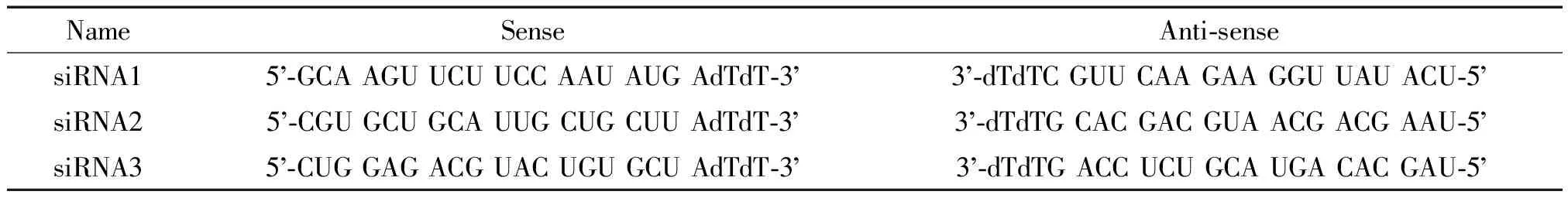
表1 siRNA序列
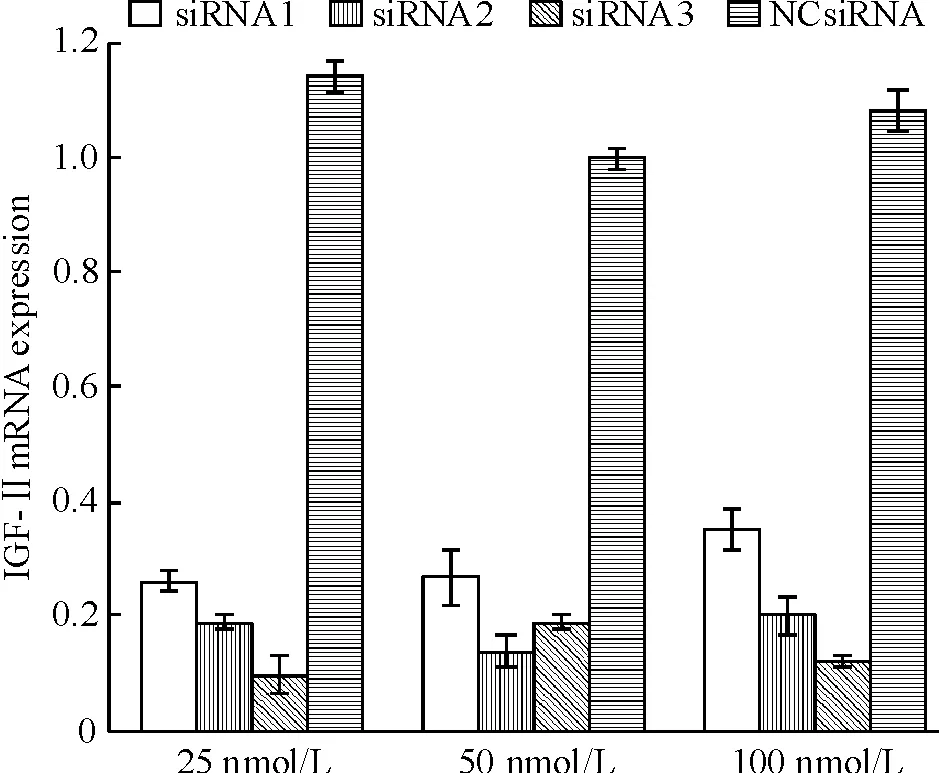
Figure 2. Effects of siRNAs targetingIGF-IIgene on IGF-II mRNA expression in Huh7 cells detected by real-time fluorescence quantitative PCR.Mean±SD.n=6.
图2各siRNA转染Huh7肝癌细胞24h后对IGF-IImRNA表达的影响
2hAFP和hTERT双启动子调控的、针对IGF-II基因的siRNA表达载体构建结果
图3显示pGL3-hAFP-hTERT重组载体2个阳性克隆的双酶切产物电泳结果。根据上述筛选出的siRNA3,设计表达siRNA3的序列,制备双链siRNA3,克隆入pGL3-hAFP-hTERT载体双启动子下游(XhoI与HindIII位点之间)构建成pGL3-hAFP-hTERT-siRNA3表达载体。测序结果显示,上述各重组载体插入片段序列正确,无突变。

Figure 3. Electrophoresis analysis of pGL3-hAFP-hTERTvectors (A) and their dual enzyme (KpnI andNheI) digestion products (B). M: DNA marker.Arrows indicate the positive target fragments of about 725 bp (hAFP-hTERTdual promoter fragment).
图3pGL3-hAFP-hTERT载体及其双酶(KpnI和NheI)切产物电泳分析
3重组hAFP和hTERT双启动子调控的siRNA可特异性抑制Huh7细胞IGF-IImRNA表达及细胞生长
图4显示,与转染阴性对照载体pGL3-hAFP-hTERT(negative control)及空白对照(blank control)相比,转染pGL3-hAFP-hTERT-siRNA3表达载体(siRNA)的Huh7细胞IGF-II mRNA表达量显著降低,抑制效率达86%(P<0.05)。如此同时,在L-02细胞中,3组IGF-II mRNA表达量无明显变化(P>0.05)。

Figure 4. Effects of siRNAs targetingIGF-IIgene driven byhAFP/hTERTdual promoters on IGF-II mRNA expression in Huh7 cells (A) or L-02 cells (B).Mean±SD.n=6.*P<0.05vsnegative control or blank control.
图4hAFP和hTERT双启动子调控的siRNA对Huh7细胞及L-02细胞IGF-IImRNA表达的影响
图5与图6显示,与转染negative control及blank control相比,转染siRNA的Huh7细胞增殖受到明显抑制,转染后第2天及第3天差异有统计学意义(P<0.05);细胞周期检测显示G1期细胞比例显著增加(P<0.05)。而3组L-02细胞增殖及G1期细胞比例无明显差异(P>0.05)。
讨 论
人IGF-II基因是一个复杂的转录调控单位,具有9个外显子和4个启动子(P1~P4)[7]。在个体不同组织及不同生长发育阶段,4个启动子呈现动态活性,总共编码5种5′端非翻译区不同的IGF-II mRNA,但其成熟蛋白产物相同。例如,在胎儿和新生儿肝脏中,IGF-II mRNA高水平表达,其转录来源于P2~P4启动子激活,其中P3 活性最大,P1 失活;在出生2个月后,肝脏IGF-II mRNA表达量则显著下调,约为新生儿峰值的1/10,一直至成人期都维持于此低水平状态,其表达主要受控于P1 启动子,P2~P4启动子活性弱或呈关闭状态[8]。

Figure 5. Effects of siRNAs targetingIGF-IIgene driven byhAFP/hTERTdual promoters on the proliferation of Huh7 cells (A) or L-02 cells (B).Mean±SD.n=6.*P<0.05vsnegative control or blank control.
图5hAFP和hTERT双启动子调控的siRNA对Huh7细胞及L-02细胞增殖的影响
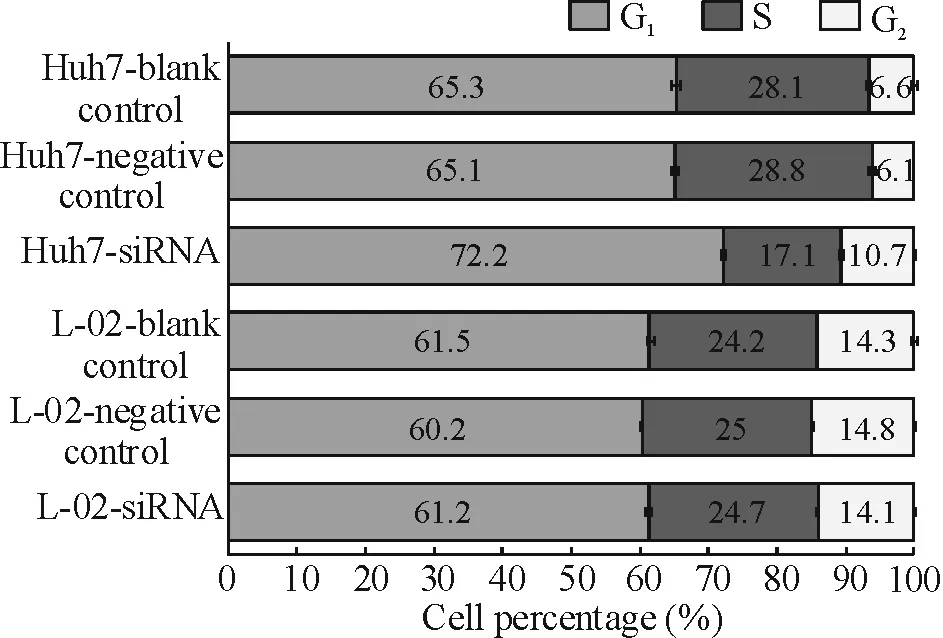
Figure 6. Effects of siRNAs targetingIGF-IIgene driven byhAFP/hTERTdual promoters on the cell cycle distribution of Huh7 cells or L-02 cells.Mean±SD.n=6. The percentage of Huh7 cells in G1phase increased significantly in siRNA group compared with negative control or blank control group (P<0.05), and there were no differences of the cell cycle distribution of L-02 cells among the above three groups (P>0.05).
图6hAFP和hTERT双启动子调控的siRNA对Huh7细胞及L-02细胞细胞周期分布的影响
我们课题组和其他学者研究发现,由于P3、P4启动子再激活而导致的IGF-II过表达与肝细胞癌的发生发展密切相关[4-6,9-10]。Dong等[10]报道,肝细胞癌的癌灶、癌旁和远离癌灶的非癌组织中IGF-II mRNA的表达率分别为100%、53.3%和0%,提示IGF-II特异表达于癌变肝细胞及部分不典型增生的癌前肝细胞,正常肝细胞则无表达。将IGF-II反义RNA导入HepG2肝癌细胞后,细胞增殖率下降,凋亡率增加,AFP分泌水平降低,且恶性表型受到显著抑制[11-12]。上述结果提示,IGF-II的过表达对肝细胞癌的发生发展具有重要影响,抑制IGF-II的过表达可能成为肝细胞癌治疗的新靶点。
RNAi是一种经济、快捷、高效抑制特异基因表达的新技术[13],可能成为恶性肿瘤基因治疗新的选择和希望。siRNA是RNAi过程中的关键中间产物,目前构建siRNA表达载体采用的启动子有Pol II和Pol III启动子,前者包括survivin、hTERT、hAFP启动子等,后者包括H1、U6、tRNA启动子等[2]。Pol III启动子的优点是能够在精确的位置启动与终止转录,表达的siRNA可以在体内实现高效而稳定的基因沉默,但其不足是无组织特异性,在肿瘤基因治疗时可能导致人体正常组织损伤[3]。Pol II启动子的优点是具有组织特异性,可使靶基因在特定的肿瘤组织中沉默,但其不足是转录活性较低[14]。有研究显示,串联2个启动子的核心序列可以增强其转录活性[15-16]。
hAFP是目前特异性最强的肝细胞癌肿瘤标记物,肝细胞癌中hAFP 的阳性率为70%~90%。但是,生殖腺胚胎瘤及少数胃癌、肝炎、肝硬化可较低水平表达hAFP。hTERT是维持端粒酶活性所必需的催化亚单位,hTERT 在85%~90%的恶性肿瘤及86%肝细胞癌中高表达,而正常细胞则低表达或几乎不表达[17]。因此,将hAFP启动子及hTERT启动子二者串联构建成双启动子来调控siRNA表达,理论上可能只对表达hAFP和(或)hTERT的肝癌细胞靶基因产生特异性沉默作用,而对正常肝细胞几乎不产生影响。
在本研究中,我们根据siRNA设计原则,参照IGF-II mRNA序列设计3对siRNA序列及1对阴性对照序列,分别以25 nmol/L、50 nmol/L和100 nmol/L浓度通过脂质体法转染肝癌细胞Huh7。结果显示,转染siRNA1、siRNA2和siRNA3的Huh7细胞IGF-II mRNA表达量均显示不同程度的下降,其中siRNA3在25 nmol/L浓度时抑制效率最高,为90%。随后,我们成功构建成重组pGL3-hAFP-hTERT-siRNA3表达载体,并将其转染Huh7细胞(表达IGF-II、hAFP 及hTERT)及L-02细胞(表达IGF-II,不表达hAFP 及hTERT)。结果显示,Huh7细胞IGF-II mRNA表达量显著下调,细胞生长受到明显抑制,而L-02细胞IGF-II mRNA表达量及细胞生长无明显改变,提示hAFP/hTERT双启动子调控的siRNA可特异性抑制肝癌细胞IGF-II表达及细胞生长,对正常肝细胞无明显影响,为肝癌的基因靶向治疗提供一种新的选择奠定了基础。本结果与Chen等[16]的研究报道相似,他们发现hAFP/hTERT双启动子有较高的转录活性,并可靶向介导miR-26a在肝癌细胞中表达,特异性抑制其生长。
[1] Melnyk CW, Molnar A, Baulcombe DC. Intercellular and systemic movement of RNA silencing signals [J]. EMBO J, 2011, 30(17):3553-3563.
[2] Giering JC, Grimm D, Storm TA, et al. Expression of shRNA from a tissue-specific pol II promoter is an effective and safe RNAi therapeutic [J]. Mol Ther, 2008, 16(9):1630-1636.
[3] Heng TL, Chang WT. Construction of simple and efficient DNA vector-based short hairpin RNA expression systems for specific gene silencing in mammalian cells [J]. Me-thods Mol Biol, 2007, 408:223-241.
[4] Breuhahn K, Schirmacher P. Reactivation of the insulin-like growth factor-II signaling pathway in human hepatocellular carcinoma [J]. World J Gastroenterol, 2008, 14(11):1690-1698.
[5] Tang SH, Yang DH, Huang W, et al. Differential promoter usage for insulin-like growth factor-II gene in Chinese hepatocellular carcinoma with hepatitis B virus infection [J]. Cancer Detect Prev, 2006, 30(2):192-203.
[6] Tang SH, Yang DH, Huang W, et al. Hypomethylated P4 promoter induces expression of the insulin-like growth factor-II gene in hepatocellular carcinoma in a Chinese population [J]. Clin Cancer Res, 2006, 12(14):4171-4177.
[7] 汤绍辉, 张良鹏, 吴小娟, 等. 乙型肝炎病毒X蛋白通过降低P4启动子甲基化水平上调人IGF-II基因的转录[J]. 中国病理生理杂志, 2012, 28(9):1633-1638.
[8] Li X,Cui H,Sandstedt B,et al.Expression levels of the insulin-like growth factor-II gene (IGF2) in the human liver: developmental relationships of the four promoters [J]. J Endocrinol, 1996, 149(1): 117-124.
[9] Qiu LW, Yao DF, Zong L,et al. Abnormal expression of insulin-like growth factor-II and its dynamic quantitative analysis at different stages of hepatocellular carcinoma development [J]. Hepatobiliary Pancreat Dis Int, 2008, 7(4):406-411.
[10] Dong ZZ, Yao DF, Yao DB, et al. Expression and alteration of insulin-like growth factor II-messenger RNA in hepatoma tissues and peripheral blood of patients with hepatocellular carcinoma [J]. World J Gastroenterol, 2005, 11(30):4655-4660.
[11] 杨冬华, 张鸣青, 杜 江, 等. 人胰岛素样生长因子-Ⅱ反义RNA 对肝癌细胞恶性表型的抑制作用[J].中华肝脏病杂志, 1999, 7(1):39-41.
[12] 宁晓燕, 杨冬华, 杜 江, 等. 反义胰岛素样生长因子Ⅱ对人肝癌细胞生物学特性的影响[J]. 中华肝脏病杂志, 2001, 9(4):254.
[13] 郑时玉, 王 丽, 刘泽兵, 等. 慢病毒介导的c-metRNA干扰对人乳头状甲状腺癌K1细胞生物学行为的影响[J]. 中国病理生理杂志, 2012, 28(10):1819-1824.
[14] Ren GL, Fang Y, Ma HH, et al. The short hairpin RNA driven by polymerase II suppresses both wild-type and lamivudine-resistant hepatitis B virus strains [J]. Antivir Ther, 2007, 12(6):865-876.
[15] Tomizawa M, Saisho H, Tagawa M. Regulatory regions of growth-related genes can activate an exogenous gene of the alpha-fetoprotein promoter to a comparable degree in human hepatocellular carcinoma cells [J]. Anticancer Res, 2003, 23(4): 3273-3277.
[16] Chen L, Zheng J, Zhang Y, et al. Tumor-specific expression of microRNA-26a suppresses human hepatocellular carcinoma growth via cyclin-dependent and-independent pathways [J]. Mol Ther, 2011, 19(8):1521-1528.
[17] Hu Y, Shen Y, Ji B, et al. Combinational RNAi gene therapy of hepatocellular carcinoma by targeting human EGFR and TERT [J]. Eur J Pharm Sci, 2011, 42(4): 387-391.
HumanIGF-IIsiRNAdrivenbyhAFP/hTERTdualpromotersspecificallysuppressesgrowthofhumanhepatocellularcarcinomacells
TANG Shao-hui1, WU Sheng-lan1, WANG Kuang-jing1, ZHANG Liang-peng1, LUO Yu-hong2, CAO Ming-rong2, ZHOU Hong-ke1
(1DepartmentofGastroenterology,2DepartmentofGeneralSurgery,theFirstAffiliatedHospital,JinanUniversity,Guangzhou510632,China.E-mail:yuhongluo123@163.com)
AIM: To design and screen the most effective siRNA targeting human insulin-like growth factor II (IGF-II) gene, to construct an siRNA expression vector driven byhAFP(human alpha-fetoprotein)/hTERT(human telomerase reverse transcriptase) dual promoters, and to observe the effect of the siRNA on the growth of human hepatocellular carcinoma cells.METHODSThree siRNAs targetingIGF-IIgene and one negative control siRNA were designed and synthesized. They were transfected into human hepatocellular carcinoma Huh7 cells. The expression IGF-II mRNA in Huh7 cells was detected by real-time fluorescence quantitative PCR 24 h after transfection to screen the most effective siRNA. The core sequences ofhAFPandhTERTpromoters and the most effective siRNA were cloned into pGL3-basic vector to construct the siRNA expression vector driven byhAFPandhTERTpromoters. The siRNA expression vector was transfected into Huh7 cells and human normal liver L-02 cells, and then the IGF-II mRNA expression in these cells and the cell growth were evaluated.RESULTSThe inhibitory effect of siRNA3 on IGF-II mRNA expression was the strongest at the concentration of 25 nmol/L, with an inhibitory rate of approximately 90%. The core sequence fragments ofhAFPandhTERTpromoters and siRNA3 were successfully cloned into pGL3-basic vector. The expression of IGF-II mRNA in the transfected Huh7 cells was reduced by approximately 86%, and proliferation inhibition and G1-phase arrest of the cells were also observed. However, there were no differences of the above parameters in L-02 cells before and after transfection.CONCLUSIONThe siRNA expression vector targeting humanIGF-IIgene driven byhAFP/hTERTdual promoters was successfully constructed. The siRNA3 expression vector may specifically suppress the expression of IGF-II mRNA and the growth of hepatocellular carcinoma cells.
hTERT/hAFPdual promoters; RNA interference; Insulin-like growth factor II; Carcinoma,hepatocellular
R735
A
1000- 4718(2013)08- 1422- 06
2013- 03- 18
2013- 07- 02
广东省科技计划(No.2012B031800399);广州市科技计划(No.2011J4100077);暨南大学第一临床医学院科研培育专项基金资助项目(No.2013107)
△通讯作者Tel: 020-38688039; E-mail: yuhongluo123@163.com
10.3969/j.issn.1000- 4718.2013.08.014
