水苏糖对猪精液冷冻保存效果的影响
2013-10-23贾东平刘家慧
杨 升,贾东平,刘家慧
(1.天津农学院,天津 300384;2.青岛滨海学院,山东 青岛 266555)
自1956年Polge首次利用冷冻精液人工授精获得仔猪至今,猪精液冷冻技术虽然经过多年的发展,但与奶牛冷冻精液的应用相比,仍有很大差距。早在1930年,Milovanov等对猪人工授精进行了试验,并提出最初的猪精液稀释剂(葡萄糖-硫酸盐和葡萄糖-酒石酸盐)。近年来猪精液冷冻保存液中非渗透性保护剂糖类物质的加入引起了研究人员的高度关注,糖类在生物活性细胞脱水的情况下在细胞膜外形成一层保护膜,从而在冷冻过程中保护细胞膜的完整性,最终达到保护精子的作用。
1 材料与设备
1.1 材料
1.1.1 试验动物
天津某种猪场提供的1.5~2岁、体格健壮、性欲旺盛的8头约克夏种公猪。
1.1.2 试验药品
Hepes (H-3375),Hoechst33342(H33342 ;B-2261), Propidium Iodide(PI; P-4170),Fluorescein-labeled lectin from Arachis hypogaea(FITC-PNA; L-7381), Anhydrous Dimethyl Sulfoxide (DMSO;D-2650)和 Bovine Serum Albumin (BSA;A-4503)等及一些常用试验药品如葡萄糖;柠檬酸;柠檬酸钠等均购自 Sigma化学公司(St. Louis, MO,美国),Mito Tracker® Orange CMTMRos(MITO, M-7510),Yo-Pro-1 (Y-3603)和 erocyanine 540(M24571)购自分子探针公司(Eugene, OR,美国),其他试剂为国产分析纯均为市售药品。
1.1.3 液体的配制
ZO液: 葡 萄 糖1.15 g,EDTA 0.23 g,柠檬酸钠1.17 g,碳酸氢钠0.125 g,Tris 0.65 g, 柠 檬 酸 0.41 g,半肤胺0.01 g,BSA 0.5 g;
冷冻液I:葡萄糖1.5 g,乳糖3.0 g,甘氨酸8 g,卵黄24 mL/l00 mL;
冷冻液II:在I液中加入6%甘油。
1.2 设备
高速离心机 Eppendorf centrifuge 5810R,德国
水浴锅 W20M-2E,美国
超纯水仪 Millpore,法国
高压灭菌锅 HV-110,日本
超净工作台 ESCO,新加坡
精子贮藏冰箱 Hisense BC-50,中国北京
移液器 EPPENDORF,德国
荧光正置显微镜 Nikon ECLIPSE 50i,日本
伟力彩色精子质量检测系统(CASA)WLJY-9000,中国北京
2 试验方法
2.1 精液的采集
精液采集采用手握法,采精后选择中段精液,经4层消毒纱布过滤去除胶状物,收集精子富集部分。精液采集后立即用显微镜进行常规品质检查,精子活率在0.7以上、色泽为乳白色的精液,在35~37 ℃于1 h内运抵实验室备用。
2.2 精液稀释与冷冻
在室温条件下,过滤后的精液先用常温保存液ZO液按照(V/V)稀释,避光静置1 h后以2 400 g离心3 min去上清再添加冷冻稀释I液,于5 ℃平衡1 h再添加等量的稀释II液,使甘油的工作浓度为3%,继续在5 ℃平衡1~3 h装入0.25 mL细管,用聚乙烯醇粉末封口,单层放置液氮面上3 cm平衡10 min后直接投入液氮保存,冻精解冻时,从液氮中取出细管,迅速投入37 ℃水浴30 s,然后稀释至2 mL解冻液中,室温放置10 min待检。
2.3 冻精质量评定
2.3.1 精子活力
移液枪取10 μL精液于载玻片上,置于37 ℃恒温载物台上,在400×显微镜下评定精子活力(直线前进),每个片子至少检查200个精子。
2.3.2 质膜完整性
将解冻后的精液用果糖-柠檬酸钠低渗液稀释,调整精子密度为 1×106~ 2×106/mL,37 ℃ 孵 育30 min后,取20 μL精子悬液于血细胞计数板上,400×倒置显微镜下观察不同部位5个视野,每次至少数200个精子,计算弯尾精子的百分率。
2.3.3 顶体完整性
将解冻后的精液滴到含3%等温PVP液的离心管内,800×g离心6 min,弃上清液;沉淀精子用37 ℃的PBS溶液重悬,调整精子密度为(1~2)×106/mL。移液枪吸取30 μL精子悬液,涂片,空气中自然干燥后,用纯甲醇固定10 min,再加入30 μL FITC-PNA染液,37 ℃、黑暗潮湿环境下孵育30 min。之后再用PBS溶液冲洗,空气中自然干燥后加少许增光剂混匀,盖上盖玻片,尽快用400×荧光显微镜观察。每次检测时,每个片子计数200个精子。
2.3.4 精子获能
首 先 在50 μL精 液 中 加 入500 μLHepes缓冲液,以 500 g离心5 min,弃掉上清,用 20 μL Hepes缓冲液重悬沉淀。染色时,将处理的精液加入100 μL添加有0.025 μL H33342、2 μLMerocyanine540 和 2 μLYo-Pro-1基础液的Hepes缓冲液中,混匀后在37 ℃水浴中避光平衡20 min;然后用同样的方法对染色后的精液进行离心洗涤。最后取5 μL处理后的精液于载玻片,用上述方法对精子的获能状况进行检测。其中,非膜渗透性的核酸荧光染料Yo-Pro-1,标记细胞膜受损的和去稳定的精子细胞核,呈现绿色荧光;M540 使有活力的精子(未被 Yo-Pro-1 染色)呈现2种类型的荧光,荧光弱的表示精子未获能,而荧光强的表示精子获能。
3 试验方案
1)以ZO液为基础液,进行前期的处理,对照组使用冷冻液I和II进行冷冻,试验组用水苏糖代替冷冻液I中的葡萄糖和乳糖,并调节水苏糖的剂量进行最适剂量的选择。
2)以前一步筛选的水苏糖的剂量进行试验,观察水苏糖在精子冷冻过程中对精子生理参数的影响。
4 统计分析
通过SPSS统计软件,利用t检验和方差分析进行数据处理。
5 结果与分析
5.1 添加水苏糖浓度的筛选
精液解冻后,用不同荧光染色剂进行特异性染色,根据激发荧光不同利用荧光显微镜分别评定,结果见表1。
从表1可以看出,不同添加剂量的水苏糖对精子冻后活力具有很大影响,水苏糖在稀释液中的最佳添加量为4.5 g,此时对精子的保护作用最强,精子冻后效果最佳。随着水苏糖添加比例的增减对精子的保护效果不同,其适宜的添加量为4.5 g。根据试验数据显示,在此冷冻配方中可以用水苏糖代替葡萄糖和乳糖,其冷冻效果比原来配方的冷冻效果好。

表1 不同浓度水苏糖对解冻精子活力的影响
5.2 添加水苏糖对解冻后精子质膜的影响
从表2可知,在4.5 g的添加量时水苏糖在冷冻-解冻过程中对猪精子起到较好的保护作用,水苏糖显著提高冻后精子的顶体完整性,顶体完整率最高达到69.4%。而随着添加比例的增加,精子的顶体完整率逐渐提高,各浓度水平间差异显著。
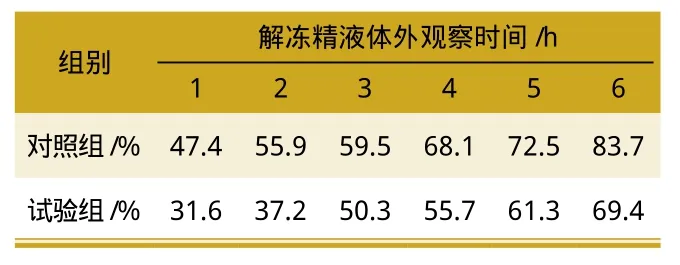
表2 不同添加浓度水苏糖对猪冻精质膜完整性的影响
5.3 添加水苏糖对解冻后精子顶体完整性的影响
精子顶体覆盖了精子头部的80%,含有能穿透卵细胞外卵丘和透明带的酶,如果受到损伤,精子就会失去使卵子受精的能力。同样,如果精子质膜受到损伤或者发生变化,直接导致精子活力和受精能力下降。从表3可知,在4.5 g的添加量时水苏糖在冷冻-解冻过程中对猪精子起到较好的保护作用。

表3 水苏糖对解冻后精子顶体完整性的影响
5.4 添加水苏糖对解冻后精子获能的影响
在冷冻-解冻过程中,精子的获能状态可主要由Ca2+浓度及其分布确切反映。水苏糖可以进入细胞内的高浓度Ca2+区间,且与Ca2+结合,而水苏糖-Ca2+复合物容易与细胞膜内的疏水区结合,在荧光显微镜下根据激发荧光的强度和分布,反映获能过程中精子各时期Ca2+短暂的变化和分布规律,从而分析精子顶体完整状态。不同添加比例对水苏糖获能处理前后精子的获能情况的影响见表4。

表4 水苏糖对解冻后精子获能的影响
从表4可见,在获能处理前,与对照组相比,水苏糖可以明显地降低冷冻-解冻过程中精子的获能百分率,在4.5 g的添加比例时精子获能率仅3.68%。从获能处理后精子的获能情况分析,添加水苏糖可以显著提高冻后精子的获能潜力,其最佳添加量为4.5 g,获能精子的百分率为28.6%,随着体外观察时间的延长,精子的获能也有所增加。
6 讨论与结论
从本研究可以看出,稀释液中添加25%的水苏糖可以明显提高冷冻-解冻后精子的活率、活力、线粒体活性和质膜完整性等。随着水苏糖添加比例的增加,精子的顶体完整率越高,说明水苏糖可以有效保护冷冻-解冻过程中精子顶体的完整性,与Bayarad等在山羊精子冷冻保存的研究结果一致[1];在保护精子质膜方面,也与本研究结论一致[1]。但是,关于对冻后水苏糖精子活率的影响与Aboagla等在山羊和Woelders等在牛精子冷冻方面的研究结论不同[2-3],这可能是由于不同种家畜其精子对不同稀释液渗透压的耐受能力不同,猪精子对高渗溶液的耐受性较山羊精子和牛精子差,渗透压的升高导致精子迅速脱水死亡的缘故。水苏糖是一种稳定的非还原性双糖,对生物体或生物大分子具有独特的非特异性保护作用,研究发现,水苏糖作为一种水分替代分子,冷冻过程中避免了细胞膜在固相-液相转变中受伤害,在细胞内主要作为一种亲和性溶质来抗衡胞外的渗透压变化。关于水苏糖保护细胞的分子理,不同学者提出不同学说,但众多研究表明,水苏糖的保护机制与其晶体结构、溶液的物理构和化学特性密切相关[4-5]。在精子冷冻时,水苏糖可强有力地束缚水分子,与膜脂质共同拥有结合水者本身起到代替膜结合水的功用,保持细胞内湿润,防止细胞因失水而造成养分的损失和细胞的损伤,具有稳定细胞膜和蛋白质结构的特性。
[1]Bayarad M N, et al.The effect of antioxidants on post-thawed Angora goat (Capra hircus ancryrensis)sperm parameters, lipid peroxidation and antioxidant activities[J].Small Ruminant Research,201089(1):24-30.
[2]Woelders, D. and M. Kurpisz,Reactive oxygen species and sperm cells [J]. Reprod Biol Endocrinol,2004,2(12):1-7.
[3]Aboagla, S.G., H2O2, a necessary evil for cell signaling [J]. Science,2006, 312(5782): 1882-1883.
[4]Bansal,A.K.and G.S.Bilaspuri,Impacts of Oxidative Stress and Antioxidants on Semen Functions.Veterinary Medicine International,2011.
[5]Garrido N, et al. Pro-oxidative and anti-oxidative imbalance in human semen and its relation with male fertility [J].Asian journal of andrology, 2004, 6(1): 59-66.
